SOCS1基因沉默增强DC疫苗应用于肺癌动物模型中的效果研究
2020-12-28曹瑞萍王策
曹瑞萍 王策
【摘要】目的探究SOCSI基因沉默增强DC疫苗应用于肺癌动物模型中的效果。方法选取SPF'级的雌性近交鼠系,均进行细胞培养、荷瘤动物的建模与治疗。观察转染siRNA抑制SOCSl表达情况、DC疫苗抑制肿瘤生长情况、DC疫苗对肿瘤的特异杀伤能力。结果经荧光显微镜下观察大部分细胞呈现绿色,证明转染siRNA抑制了socsi表达。经治疗后,自14 d开始,lvsate-mDC和lvsat elsiRNA-mDC肿瘤生长缓慢,PBS生长依然迅速。DC沉默SOCS1后对TCL的特异性杀伤效果更好,未沉默时对其杀伤效果不好。结论研究发现沉默后的DC对肺癌患者治疗效果更优,在临床肿瘤治疗的应用性很广。
【关键词】SOCS1基因;DC疫苗;肺癌动物模型
DOI: 10.14163/j.cnki.ll-5547/r.2020.19.095
最新的调查数据显示,由于吸烟等有害习惯以及其他不可控因素近年来肺癌的发病人数直线上升,这种肿瘤的死亡率很高,甚至在所有恶性肿瘤中位居首位。但是对于癌症的治疗仍旧是一大难题,微小的病灶通过手术的方式很难清除,而小细胞肺癌患者不能耐受化疗,因此DC生物疫苗的治疗就受到了众多关注。DC是通过将肿瘤细胞荷载,然后激活T淋巴细胞的免疫功能,使其清除肿瘤细胞[1]。DC治疗比手术安全性更高,且并发症副作用情况相对少。但是在应用中发现,DC激发出的免疫性能非常有效,不能快速清除肿瘤细胞,因此治疗情况一般[2]。因为肿瘤细胞也会灵活躲避免疫系统的攻击,有很多逃逸机制。因此需要采取其他方法对原有的DC进行改良修饰,提高抗原提呈能力,提高激发的免疫功能应答能力。因此,本文通过肺癌动物模型的案例,对DC进行SOCSI沉默,观察对比沉默之前与沉默之后的治疗效果,为临床肺癌治疗提供指导依据。
l材料与方法
1.1材料
1.1.1制备细胞株及肿瘤裂解物肺癌细胞株购白美国模式培养物集存库,将肺癌细胞株放培养在含有10%的FCS、浓度为10 mmol/L的羟乙基哌秦乙硫磺酸、浓度为每毫升酶活为100的青霉素和100 ug/ml的链霉素(利君制药)的RPMI1640完全培养基中。等到肺癌细胞株占据瓶底的4/5时,将其铲下再经过三次磷酸缓冲盐溶液洗涤,在-80℃冷冻然后在37℃溶解这个过程重复5次,裂解方法采用超声波,最后经离心机离心然后对上清收集即可。
1.1.2实验动物 由于对致癌物近交鼠系有很高的敏感性,因此本实验选取SPF级的雌性近交鼠系,实验小鼠的周龄为3-6周,从中科院上海生物科学研究院购买,数量共36只。
1.2方法
1.2.1细胞培养首先获取小鼠的骨髓细胞在去除红细胞后经过5-7 d的培养后,将培养板中的悬浮和松散贴壁的细胞取出,这些细胞是极为不成熟的DC细胞。用lvsate-mDC和lvsate/siRNA-mDC分别标记未沉默SOCS1的iDC和沉默SOCSI的iDC,最后检验其纯度。
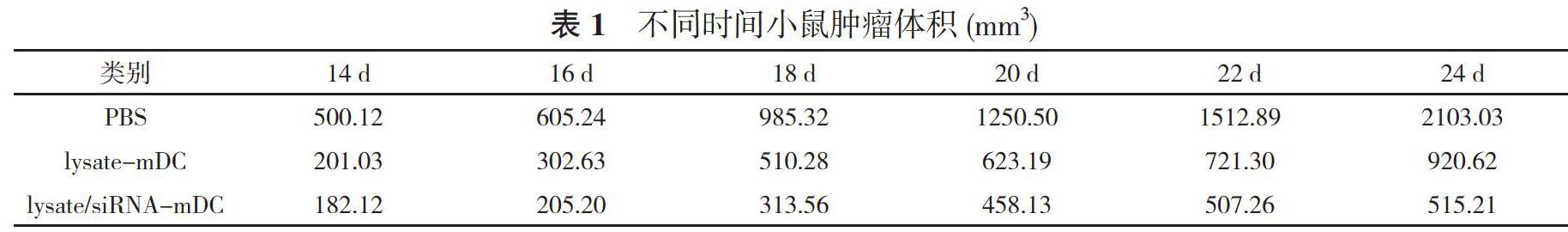
1.2.2荷瘤动物的建模与治疗将灭菌50ug的灭菌PBS、lysate-mDC(I×106细胞/50 ul)、lvaste/siRNA-mDC(lx 106细胞/50 ul)在小鼠接种肿瘤的14 d注射至小鼠的足垫皮下,要想使DC充分成熟,在接种疫苗后的3d内对每只小鼠每天注射30 ug/200 uI的LPS。在当天用洗涤重选后的PBS以每细胞/5×lO-4在小鼠腋窝皮下接种。从第8天开始,每2d用游标卡尺测量1次小鼠的肿瘤体积。在接种后的第18天杀死小鼠取其脾细胞分别培养后分别检测LDH的吸光度、斑点数、干扰素-r(IFN-r)等。
1.3观察指标观察转染siRNA抑制SOCS1表达情况、DC疫苗抑制肿瘤生长情况、DC疫苗对肿瘤的特异杀伤能力。显微镜下DC颜色:因为直观观察转染的效果,用荧光染料标记siRNA,若转入DC则呈现绿色。
2结果
2.1转染siRNA抑制SOCS1表达情况 经荧光显微镜下观察大部分细胞呈现绿色,证明转染siRNA抑制了SOCSI表达。
2.2 DC疫苗抑制肿瘤生长情况经治疗后,白14 d开始,lvsate-mDC和Ivsate/siRNA-mDC肿瘤生长缓慢,PBS生长依然迅速。见表1。
2.3 DC疫苗对肿瘤的特异杀伤能力DC沉默SOCSI后对TCL的特异性杀伤效果更好,未沉默时对其杀伤效果不好。
3讨论
RNAis是近年来生理学以及生物学领域的一大发现,对于它的原理可以这样解析,在它与mRNA重组结合以后,进而使其降解,达到对基因的转录并沉默的效果[3]。这一原理的提出為生理学的发展进步起到重大推动作用,通过这个理论解析使我们更加清楚基因信息控制的基本原理,在生物学中的地位也是不容忽视的,为许多疑惑进行一定程度的解答[4]。这项原理理论的特异以及撼动价值使其在各个领域的应用广泛,在医学中的理论指导也有很多涉及。对于DC肿瘤疫苗的预备性研究也采取了该理论的应用技术[5]。
研究过程中发现一个有趣的现象,当siRNA沉默在SOCSI调节分子后,能够提高刺激之后的共刺激分子的表达能力。进而能够提高抗原输出性能以及使成熟度进一步提升[6]。其他研究者也发现了类似的情况。研究者对Dil h+单核细胞进行了观察研究,研究人员发现,LPS原本是来自于细菌中细胞壁结构中的成分,它的配体是一种叫做Toll-样受体4(TLR4)的受体[7],如果对SOCSI的运动进行抑制阻碍,单核细胞以及DC对LPS的反应活性也会相应升高[8]。这一研究说明,SOCSI对于很多通路的调节过程起着非常重要的作用[9],无论是JAK/STAT还是TLR4参与的通路,SOCSI的参与性不可忽视[10]。
本研究对小鼠进行了肺癌动物模型的模拟实验,在对小鼠摄入疫苗治疗之后,可以得到一个结论,在SOCSI没有进行沉默的小鼠治疗之后发现疫苗的效果也有一定成效,但是SOCSI沉默之后的疫苗对于小鼠的治疗效果更为显著。沉默之后的肿瘤细胞的生长繁殖受抑制明显,CD4+对于体外肿瘤细的清除扼杀力度增强,这个过程分泌产生的免疫性细胞因子增多。结果表明,SOCSI是对于疫苗的功能反馈控制的重要因素,沉默SOCSI能够提高患者的免疫能力,对于DC功能是强化作用。对于未来DC疫苗的临床应用治疗,SOCSI的作用可以进一步利用,医学应用性非常显著,对于肺癌患者的治疗也是非常有效的改良手段,为患者带来希望。
