基于洋麻秆衍生的三维多孔碳/硫堇比率型抗坏血酸电化学传感器
2020-12-25吴娜申源汪莉宋永海
吴娜 申源 汪莉 宋永海


摘 要 通过碳化洋麻秆得到三维多孔碳材料(3D-KSC),然后将硫堇(Thi)分子直接组装在其孔壁上,制备了比率型抗坏血酸(AA)电化学传感器。采用扫描电子显微镜和能谱仪等对3D-KSC进行结构表征,发现3D-KSC孔壁表面较光滑,同时还存在一些微孔和缺陷, 这些孔隙与缺陷的存在,可使Thi分子牢固地固载到3D-KSC的孔壁上。3D-KSC/Thi修飾电极催化AA的氧化峰出现在0.015 V处,而Thi自身在-0.24 V处的氧化峰不随AA浓度的增加而改变,利用这两个氧化峰的峰电流密度之比设计了一种比率型AA电化学传感器。电化学测试结果表明,3D-KSC/Thi具有导电性能好、电阻值较小、电极与电解液间的离子扩散速率快等特点。3D-KSC/Thi对AA的检测具有良好的选择性、宽的线性范围(18.2 μmol/L~8.0 mmol/L)和低的检出限(6.0 μmol/L)。 用于维生素片中AA含量测定,回收率为100.7%~101.2%,表明此传感器具有潜在的实际应用前景。
关键词 多孔碳; 硫堇; 比率型电化学传感器; 抗坏血酸
1 引 言
抗坏血酸(AA),即维生素C,是人体新陈代谢过程中所必需的维生素,缺乏AA会导致坏血病。坏血病[1~3]是一种由于缺乏AA而导致的皮肤和粘膜下出血、牙龈肿胀、关节和肌肉疼痛的疾病。AA还可用于治疗精神疾病、癌症、感冒、不孕不育以及提高身体的免疫力,因此在人体的新陈代谢过程中起着至关重要的作用[4,5]。由于人体自身不能产生AA,必须通过其它途径(如水果、蔬菜、血清等)获得。因此,定量检测各种样品中的AA含量具有重要的意义。
目前,检测AA的方法包括高效液相色谱法[6]、分光光度法[7]、液相色谱法[8]、气相色谱法[9]、固相微萃取与LC-UC二极管阵列法[10]和电化学传感器法[11~17]。其中,电化学传感器因响应速度快、操作简单、成本低、易于微型化和灵敏度高等优点而被广泛应用。然而,由于多巴胺(DA)和尿酸(UA)等常见共存物的干扰,电化学传感器常难以得到满意的检测结果[17,18]。为了解决这一问题,碳纳米材料(如石墨烯、碳纳米管和碳纤维等)被用于制备碳基AA电化学传感器[19,20]。虽然已经取得了一些进展,但如何控制材料在电极表面的均匀分散仍存在挑战。例如,二维的石墨烯易在电极表面积聚,从而阻碍内部材料与反应物的接触,并将进一步影响电极表面的传质速率; 此外,修饰材料容易从电极上脱落,进而影响电极的稳定性。
基于上述原因,比率型电化学传感器[21~23]引起了研究者的广泛关注。通常,在构建比率型电化学传感器时,需要在电极上获得两种不同的电化学响应信号,通过测定其比值的变化对物质进行定量分析。Li等[24]在碳纤维微电极上组装了单壁碳纳米管,然后用浸泡法在其上修饰二茂铁,并进一步固定过氧化氢酶(Cat),从而制得Cat+Fc/SWNT/CFME电极,通过Cat的还原峰电流与二茂铁(Fc)的还原峰电流之比构建比率型传感器,用于检测H2O2和pH值。由此构筑的电化学传感器可以进行自校准,检出限低,并且克服了环境和人为因素造成的误差,大大提高了电极的重复性、准确性、选择性和稳定性。
本研究在碳化洋麻秆获得的三维多孔碳(3D-KSC)[25]上直接组装硫堇(Thi)分子,构建了一个比率型AA电化学传感器。三维多孔碳材料具有比表面积大、孔隙率高、导热导电性能好、在空气中稳定等优势,可以显著提升电化学传感器的导电性和传质速率。采用洋麻杆作为原材料衍生三维多孔碳材料具有成本低、易制备、环保、可持续使用等优势。AA的氧化峰位于0.015 V,而Thi自身在-0.24 V处的氧化峰电流不会随着AA浓度的增加而发生改变,利用这两个氧化峰的峰电流密度之比可以设计比率型AA电化学传感器。本研究采用电化学信号输出,大大降低了背景信号以及共存物的干扰,方法选择性好,制备的3D-KSC/Thi比率型AA电化学传感器具有良好的性能。
2 实验部分
2.1 仪器与试剂
HITACHI S-3400N扫描电子显微镜(日本日立公司);CHI 760D型电化学工作站(上海辰华公司)。采用传统的三电极体系,其中, 铂丝电极与饱和甘汞电极分别作为对电极和参比电极,3D-KSC/Thi自支撑电极作为工作电极。所有实验均在氮气饱和的0.2 mol/L磷酸盐缓冲溶液(PBS, Na2HPO4-NaH2PO4, pH=7.0)中进行。
硫堇(Thi,阿法埃莎公司); 过氧化氢(H2O2,Aladdin公司); AA、DA、UA、果糖(Fructose)、半乳糖(D-Galactose)、NaCl(99%)、KCl(≥99.5%)、无水乙醇(北京化学试剂厂)。所有试剂均为分析纯,未进一步纯化,直接使用。支持电解液为0.2 mol/L PBS缓冲溶液(pH=7.0),实验用水均采用Millipore-Q System提供(≥18.2 MΩ cm)的超纯水。洋麻杆(KS)由江西吉安富田农场提供。
2.2 实验方法
2.2.1 3D-KSC的制备 由KS经过碳化制得3D-KSC[25]。具体方法如下:剥掉KS的外皮,露出里面白色的杆,将其切成适合瓷舟的长度(约7.5 cm),于80℃烘箱中干燥12 h,再置于管式气氛炉中,在氮气环境下,以5℃/min的速率升温至900℃后维持2 h,即得到3D-KSC。将得到的3D-KSC削成直径约1.2 mm的杆状,待用。
2.2.2 3D-KSC/Thi的制备 将处理好的3D-KSC浸泡在1.0 mg/mL Thi溶液中,超声处理1 h,用水冲洗掉吸附不牢固的Thi,烘干待用。将已合成的3D-KSC/Thi制作成自支撑电极,具体步骤如下: 将200 mL 移液枪的枪头前端削去,将3D-KSC/Thi材料装入枪头中,尽量使每一根露出的长度相同。采用由石墨粉与石蜡油调配好的碳糊将枪头尾部填满,并将抛光过的铜丝插入碳糊中,使之导电。采用封口膜固定枪头后端与铜丝相连接处。3D-KSC/Thi一体电极制备过程如图1所示。
2.2.3 电化学测定AA 以3D-KSC/Thi电极为工作电极,铂丝电极与饱和甘汞电极分别作为对电极和参比电极,在氮气饱和的0.2 mol/L PBS缓冲溶液(pH=7.0)中,加入不同浓度的AA,在-0.45~0.30 V的电压范围内,以-0.45 V为起始电位, 进行微分脉冲伏安(DPV)扫描,记录氧化电流。电位增量为0.01 V,脉冲振幅为0.1 V,脉冲频率为20 Hz。
2.2.4 实际样品分析 以3D-KSC/Thi电极为工作电极,铂丝电极与饱和甘汞电极分别作为对电极和参比电极,在氮气饱和的0.2 mol/L PBS缓冲溶液(pH=7.0)中,加入不同浓度的实际样品,在-0.45 V的电压范围内, 以-0.45 V为起始电位,进行DPV扫描,记录氧化电流。电位增量为0.01 V,脉冲振幅为0.1 V,脉冲频率为20 Hz)。
3 结果与讨论
3.1 3D-KSC/Thi电极的表征
采用SEM和EDS技术表征所制备的3D-KSC和3D-KSC/Thi自支撑电极。如图2A和2B所示,3D-KSC具有三维大孔结构,有利于物质传输。小分子Thi可以通过π-π相互作用牢固地附着在其孔壁上。由图2D和2E可见,3D-KSC与Thi结合后,表面变得更加粗糙,有些微孔被填满。结合EDS图(图2C),得知3D-KSC中的主要元素为C、O、K、Ca、Mg。在3D-KSC/Thi的EDS谱图(图2F)中,增加了N和S两种元素,表明Thi成功组装到3D-KSC电极表面。采用EDS中的Mapping模式对目标3D-KSC/Thi电极进行表征, 各元素的分布情况如图3所示,其中,N和S两种元素均匀地分布在3D-KSC上(图3C和3D)。由此证明成功制备了3D-KSC/Thi。
3.2 修饰电极3D-KSC/Thi的电化学行为
图4A和4B分别为不同电极在含5 mmol/L [Fe(CN)6]3-/4-的0.1 mol/L KCl溶液中的循环伏安(CV)和电化学阻抗谱(EIS)图。在3D-KSC电极的CV曲线(图4A曲线a)上有一对明显的氧化还原峰(氧化峰峰电位~0.26 V,还原峰峰电位~0.13 V),而在3D-KSC/Thi电极(曲线b)上的峰-峰电位差明显减小,峰电流增大,这可能是由于Thi带正电荷,能吸引带负电荷的[Fe(CN)6]3-/4-,从而促进了电子的传递。EIS图谱结果与CV结果吻合,3D-KSC/Thi电极(图4B曲线b)的电子转移阻抗(Rct)远小于3D-KSC电极(曲线a)的Rct值, 进一步证明成功制备了3D-KSC/Thi自支撑电极。
采用CV探究了3D-KSC/Thi修饰电极在氮气饱和的0.2 mol/L PBS(pH=7.0)缓冲溶液中的电化学行为。如图5A所示,在-0.24 V附近出现一对明显的氧化还原峰,随着扫描速率从10 mV/s增加到100 mV/s,峰电流逐渐增加,并且还原峰电位逐渐负移。由图5B可见,随着扫描速率增大,氧化峰和还原峰的峰电流均与扫描速率成正比,表明是表面控制的电子转移过程。
考察了不同浓度Thi制备的3D-KSC/Thi自支撑电极的电化学响应。如图6所示,当制备用的Thi浓度从0.25 mg/mL增大到1.0 mg/mL时,Thi的氧化峰电流密度随之增大; 当Thi浓度继续增大到1.25 mg/mL时,Thi的氧化峰电流密度增加的幅度减小。考虑到实验成本,选择制备3D-KSC/Thi 自支撑电极时Thi的浓度为1.0 mg/mL。
3.3 修饰电极3D-KSC/Thi对AA的检测
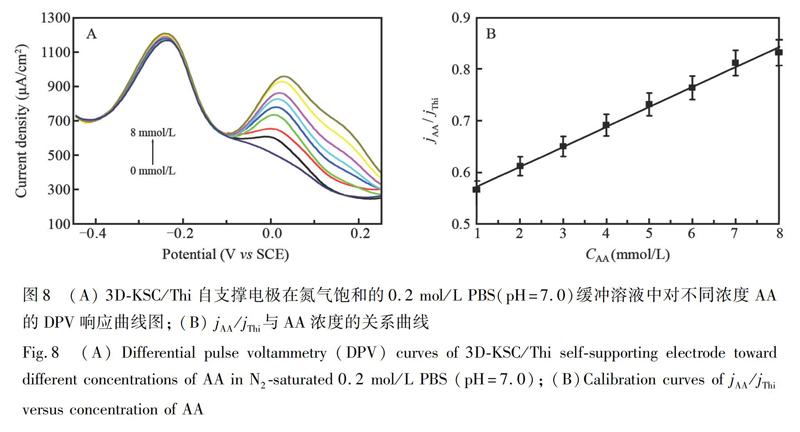
采用DPV探究了不同修饰电极在相同条件下对1 mmol/L AA的催化响应。如图7所示,在-0.24 V 能观察到Thi在GCE/Thi电极上的氧化峰,但此电极对AA并没有催化响应,表明Thi本身不能催化AA。采用3D-KSC电极对AA进行检测,可以观察到加入1 mmol/L AA后,在0.06 V附近出现了一个氧化峰,这可能是由于3D-KSC生物碳材料对AA有催化氧化作用。3D-KSC/Thi自支撑电极在1 mmol/L AA中除了在-0.24 V处出现了Thi的氧化峰,还在0.015 V处出现了AA的催化氧化峰。加入不同浓度的AA,Thi的峰电流密度不变,但AA的电流密度随浓度的改变而改变。基于此,可构建检测AA的比率型电化学为了探究3D-KSC/Thi自支撑电极对AA的催化响应,采用DPV方法,测定在氮气饱和的0.2 mol/L PBS缓冲溶液(pH=7.0)中电极对不同浓度AA的催化响应电流。如图8A所示,随着AA浓度增大,AA的氧化峰电流密度也随之增大,而Thi在-0.24 V附近的氧化峰电流密度保持不变。在18.2 μmol/L~8.0 mmol/L范围内,jAA/jThi与AA浓度呈良好的线性关系(图8B),线性回归方程为jAA/jThi=0.533+0.038CAA(R2=0.998),检出限为6.0 μmol/L(S/N=3)。
对未修饰Thi的裸3D-KSC电极催化AA的性能进行了考察。由图9A可见,随着反应过程中AA浓度的变化,3D-KSC对AA的催化基线也发生了偏移,而3D-KSC/Thi自支撑电极采用比率的方法,克服了实验条件对电极的影响。如图9B所示,3D-KSC电极检测AA的线性回归方程为Δj=79.76CAA-5.28(R2=0.998), 线性范围为37.9 μmol/L~8.0 mmol/L,检出限为12.5 μmol/L(S/N=3)。檢出限比3D-KSC/Thi自支撑电极高,表明3D-KSC/Thi自支撑电极的检测性能优于裸3D-KSC电极。
将本研究制备的AA电化学传感器与其它AA传感器的性能进行了对比(表1)。结果表明,3D-KSC/Thi电极的线性范围(18.22~8000 μmol/L)宽于Chitosan-graphene-GC的线性范围(50~1200 μmol/L)[26]及GO-PAN/GCE电极(150~1050 μmol/L)[27]和RGO-PAMAM-MWCNT-AUNP/GCE电极(20~1800 μmol/L)[31], 传感器的检出限(5.99 μmol/L)也低于GO-PAN/GCE(50 μmol/L)[27]和MWCNT/CCE电极(7.71 μmol/L)[29]。
3.4 3D-KSC/Thi比率型AA电化学传感器的选择性、重复性及稳定性研究
考察了常见电活性物质对3D-KSC/Thi自支撑电极电化学传感器检测AA的干扰。生物碳材料对多巴胺和尿酸也会有催化响应,对AA、DA、UA混合物的检测结果表明,3D-KSC/Thi自支撑电极对三者都有响应(图10A),但由于出峰位置不同,多巴胺和尿酸并不影响3D-KSC/Thi自支撑电极检测AA。在测试过程中,利用jAA/jThi的比值(即j0.015/j-0.24)进行比较,选择AA检测常见的干扰物(包括葡萄糖、多巴胺、尿酸、果糖、甘露糖、NaCl和KCl),发现5倍浓度的其它干扰物的电极响应信号小于AA响应信号的5%,结果如图10B柱状图所示。实验结果表明,自支撑电极对AA检测具有较好的选择性。同时,考察了目标电极的稳定性。采用制备好的3D-KSC/Thi自支撑电极对1 mmol/L 的AA连续检测15次后, jAA/jThi仅下降3.2%,表明此电极具有良好的稳定性。
3.5 实际样品分析
采用本方法检测了市售维生素C片剂样品中AA的含量。取两片市售维生素C片(1200 mg/片, 每片含Vc 213 mg),用研钵研磨,取1.5 mg样品,用0.2 mol/L PBS缓冲溶液(pH 7.0)溶解,并超声8 min。溶解后的样品中所含Vc标示含量为1.5 mmol/L,采用本方法测试3次,得到样品中Vc含量与标示值一致。在其中加入一定浓度的AA标准溶液,进行标准加入回收实验,结果见表2,回收率为100.7%~101.2%,相对标准偏差(RSD)为2.0%~2.6%。市售维生素C片含有食用玉米淀粉和木糖醇等成分,但对测试结果无明显影响,因此,所制备的基于3D-KSC/Thi修饰电极可用于检测Vc片剂中的AA含量,具有良好的实用性。
4 结 论
制备了一种基于3D-KSC/Thi的比率型AA电化学传感器,以Thi为参比,可减小AA检测的误差。此电化学传感器在0.015 V、0.2 mol/L PBS(pH=7.0)缓冲溶液中检测AA,检测电位低,检测环境温和,选择性及稳定性良好。
References
1 Hsieh Y C, Tsou P Y, Wang Y H, Chao C C T, Lee W C, Lee M G, Wu J Y, Chang S S, Chen P Y, Lee C C. J. Intensive Care Med., 2020, 35(1): 34-41
2 Kiani M E. U.S. Patent Application 10/226,576. 2019-3-12
3 Piliponsky A M, Shubin N J, Lahiri A K, Truong P, Clauson M, Niino K, Tsuha A L, Nedospasov S A, Karasuyama H, Reber L L, Tsai M, Mukai K, Galli S J. Nat. Immunol., 2019, 20(2): 129-140
4 Blaszczak W, Barczak W, Masternak J, Kopczynski P, Zhitkovich A, Rubis B. Molecules, 2019, 24(3): 453
5 Jothi L, Neogi S, Jaganathan S K, Nageswaran G. Biosens. Bioelectron., 2018, 105: 236-242
6 Jin P F, Xia L F, Li Z, Che N, Zou D, Hu X. J. Pharm. Biomed. Anal., 2012, 70(11): 151-157
7 Tunca A K, Ozaraz M. Int. J. Life Sci. Pharm. Res., 2019, 9(4): 45-60
8 Tsochatzis E, Papageorgiou M, Kalogiannis S. Foods, 2019, 8(10): 514
9 Wawrzyniak R, Jasiewicz B. Food Chem., 2019, 301: 125264
10 Aresta A, Zambonin C. J. Pharm. Biomed. Anal., 2016, 121: 63-68
11 Maduraiveeran G, Sasidharan M, Ganesan V. Biosens. Bioelectron., 2018, 103: 113-129
12 JI Wen-Liang, ZHANG Mei-Ning, MAO Lan-Qun. Chinese J. Anal. Chem., 2019, 47(10): 1559-1571
紀文亮, 张美宁,毛兰群. 分析化学, 2019, 47(10): 1559-1571
13 Zhang L J, Wang G H, Wu D, Xiong C, Zheng L, Ding Y S, Lu H B, Zhang G B, Qiu L Z. Biosens. Bioelectron., 2018, 100: 235-241
14 Rizwan M, Elma S, Lim S A, Ahmed M U. Biosens. Bioelectron., 2018, 107: 211-217
15 Alam A U, Qin Y, Howlader M M R, HU N X, Deen M J. Sens. Actuators B, 2018, 254: 896-909
16 LI Rui-Yi, CHU Hong-Xia,YU Min-Yi, LI Shu-Han, LI Zai-Jun. Chinese J.Anal.Chem., 2020, 48(7): 871-880
李瑞怡, 儲红霞, 余敏仪, 李姝晗, 李在均. 分析化学, 2020, 48(7): 871-880
17 Alba P A, Adover J C, de la R R. ACS Sens., 2020, 5(1): 147-153
18 Bobulescu I A, Park S K, Xu L H R, Blanco F, Poindexter J, Adams-Huet B, Davidson T L, Sakhaee K, Maalouf N M, Moe O W. Clin. J. Am. Soc. Nephrol., 2019, 14(3): 411-420
19 Anuar N S, Basirun W J, Ladan M, Shalauddin M, Mehmood M S. Sens. Actuators B, 2018, 266: 375-383
20 Zhou L, Hou H F, Wei H, Yao L N, Sun L, Yu P, Su B, Mao L Q. Anal. Chem., 2019, 91(5): 3645-3651
21 Wang X X, Liu G M, Qi Y X, Yuan Y, Gao J, Luo X L, Yang T. Anal. Chem., 2019, 91(18): 12006-12013
22 Song Y H, Xu M L, Gong C C, Shen Y, Wang L Y, Xie Y, Wang L. Sens. Actuators B, 2018, 257: 792-799
23 Li Y R, Chang Y Y, Ma J, Wu Z Y, Yuan R, Chai Y Q. Anal. Chem., 2019, 91(9): 6127-6133
24 Li S, Tian Y. Electroanalysis, 2018, 30(6): 1047-1053
25 Song Y H, Lu X P, Li Y, Guo Q H, Chen S L, Mao L Q, Hou H Q, Wang L. Anal. Chem., 2016, 88(2): 1371-1377
26 Han D X, Han T T, Shan C S, Ivaska A, Niu L. Electroanalysis, 2010, 22(17-18): 2001-2008
27 Bao Y, Song J X, Mao Y, Han D X, Yang F, Niu L, Ivaska A. Electroanalysis, 2011, 23(4): 878-884
28 Cai W H, Lai J W, Lai T, Xie H T, Ye J S. Sens. Actuators B, 2016, 224: 225-232
29 Habibi B, Pournaghi-Azar M H. Electrochim. Acta, 2010, 55(19): 5492-5498
30 Fernandes D M, Costa M, Pereira C, Bachiller B B, Rodriguez R I, Guerrero R A, Freire C. J. Colloid Interface Sci., 2014, 432(20): 207
31 Wang S Y, Zhang W, Zhong X, Chai Y Q, Yuan R. Anal. Methods, 2015, 7: 1471-1477
On-Off Ratiometric Electrochemical Sensor for Ascorbic Acid
Based on Three-dimensional Kenaf Stem Porous
Carbon/Thinion Integrated Electrode
WU Na, SHEN Yuan, WANG Li, SONG Yong-Hai*
(Key Laboratory of Functional Small Organic Molecule, Ministry of Education,
College of Chemistry and Chemical Engineering, Jiangxi Normal University, Nanchang 330022, China)
Abstract A ratiometric ascorbic acid (AA) electrochemical sensor was directly constructed by implanting thionine (Thi) on three-dimensional porous carbon derived from Kenaf stem (3D-KSC). The treated 3D-KSC and 3D-KSC/Thi were characterized by scanning electron microscopy (SEM) and energy dispersive spectroscopy (EDS). There were some micropores and defects situated in the wall of 3D-KSC's hole, which provided a large surface area and good catalytic activity. Owing to these pore defects, Thi molecules could adhere to its interior firmly. The 3D-KSC/Thi electrode had a catalytic effect against AA at 0.015 V (“on”), while the oxidation peak of Thi at-0.24 V did not change with the increase of concentration of AA (“off”), therefore, a ratiometric AA electrochemical sensor was designed by using the ratio of peak current density of these two oxidation peaks. The “on-off” ratiometric type of AA electrochemical sensor had high selectivity, wide linear detection (from 18.2 μmol/L to 8.0 mmol/L), low detection limit (6.0 μmol/L), and showed good potential application prospect.
Keywords Porous carbon; Thionine; Ratiometric electrochemical sensor; Ascorbic acid
(Received 18 July 2020; accepted 21 September 2020)
This work was supported by the National Natural Science Foundation of China (Nos. 21765009, 21964010, 21465014, 21665012).
2020-07-18收稿; 2020-09-21接受
本文系國家自然科学基金项目(Nos. 21765009, 21964010, 21465014, 21665012)资助
* E-mail: yhsonggroup@hotmail.com
