miR-17在体外脑缺血损伤中对Smad锚着蛋白的负性调控作用
2020-12-25石晓花王姣琦徐忠信
石晓花,董 玥,付 超,徐 磊,袁 罡,莽 靖,王姣琦*,徐忠信*
(1.吉林大学中日联谊医院 神经内科,吉林 长春130033;2.吉林大学中日联谊医院 神经外科,吉林 长春130033)
激活素A(Activin A,ActA)是目前较为公认的神经保护因子[1]。研究发现,在体内外缺血性脑损伤中,ActA主要通过下游Smads信号通路发挥神经保护、抗氧化应激和自噬调控等作用[2,3]。课题组近期研究发现,缺血性脑损伤后ActA/Smads信号仅短时活化,随后在Smad锚捉蛋白(Smad anchor for receptor activation,SARA)的调控下出现自发衰减[4,5]。研究发现,microRNA-17(miR-17)可通过调控SARA的表达阻断食管鳞状细胞癌的迁移和侵袭[6]。在脑缺血损伤过程中,miR-17是否通过SARA调控ActA/Smads信号尚不清楚。为探讨该问题,本研究通过miR-17 mimic转染及双荧光素酶报告基因检测,初步探讨了miR-17在体外脑缺血损伤过程中对SARA的调控作用,为延长ActA/Smads信号活化时程,提高ActA神经保护作用提供潜在干预位点。
1 材料与方法
1.1 主要材料
大鼠高分化肾上腺嗜铬细胞瘤(PC12 细胞)购自上海生物科学院细胞资源中心。miRNA qRT-PCR试剂盒、riboFECTTM CP Reagent转染试剂、双荧光素酶报告基因载体、mimic及阴性对照NC购自广州锐博公司。兔抗大鼠SARA抗体购自美国Epitomics公司;二抗购自北京博奥森生物技术有限公司。
1.2 实验方法
1.2.1细胞的培养及OGD模型的复制 高分化PC12细胞在10 %胎牛血清的高糖DMEM中培养,在37℃,5 % CO2的潮湿培养箱中孵育。利用含连二亚硫酸钠(NaS2O4,终浓度1 mM)的无糖DMEM培养液在37℃,5% CO2、95% N2的培养箱中氧糖剥夺(Oxygen Glucose Deprivation,OGD)处理细胞[5]。OGD计时0、1.5、3、6、12 h。
1.2.2miR-17的表达检测 为检测miR-17在体外氧糖剥夺模型中的表达变化,本研究收集OGD不同处理时长的高分化PC12细胞,Trizol法提取总RNA,使用miR-qRT-PCR试剂盒,按照说明书步骤进行加尾、逆转录和实时定量PCR检测,以U6为内参对照。基因引物如下:miR-17逆转录引物:5′-CTCAACTGGTGTCGTGGAGTCG GCAATTCAGTTGAGCTACCTGC-3′,上游引物:5′-ACACTCCAGCTGGGC AAAGTGCTTACAGTGC-3′,下游引物:5′-TGGTGTCGTGGAGTCG-3′;U6 逆转录引物:5′-AACGCTTCACGAATTTGCGT-3′,上游引物:5′-CTCGC TTCGGCAGCACA-3′,下游引物:5′-AACGCTTCACGAATTTGCGT-3′。应用ABI7500Fast 型实时荧光定量PCR仪进行荧光收集及分析。PCR运行参数:95℃预变性20 s,然后95℃变性10 s,60℃退火20 s,70℃延伸10 s,共40个循环。应用Relative Quantification (ddCt) Study进行相对表达量(relative quantity,RQ)RQ分析,计算SARA基因的相对表达水平。检测实验重复3次。
1.2.3miR-17 mimic转染 将生长状态良好的高分化PC12细胞接种于6孔板,细胞密度达70-80%。次日更换6孔板内的细胞培养液为无血清的高糖DMEM,按照说明书步骤进行转染操作。转染mimic的终浓度为50 nM。转染6 h后将培养液更换为含血清的完全培养液。在转染24 h、48 h和72 h分别收集细胞,每组3个复孔。
1.2.4Western blot蛋白水平表达检测 将转染不同时间分组的细胞提取总蛋白,BCA法测定蛋白浓度,调整上样量。按照操作步骤进行电泳、转膜和封闭,使用含5 %脱脂奶粉的TBST溶液稀释一抗(1∶1000),4 ℃孵育过夜后洗膜,二抗(1∶1000)室温孵育1 h,洗膜后ECL显影压胶片。凝胶图像分析,扫描胶片,吸光度分析,计算目的条带与相应内参条带的灰度值,使用两者的比值表示目的蛋白的表达水平。
1.2.5双荧光素酶报告基因检测 SARA又称Zfyve9。利用MiRDB(http://mirdb.org/)和TargetScan(http://www.targetscan.org/)在线分析软件,预测miR-17对SARA 3’ UTR区的潜在调控位点:GCACTTTA(57-64)和GCACTTT(403-409)。将SARA 3’ UTR区克隆至pmiR-RB-REPORTTM双荧光素酶报告载体。根据两个预测位点,委托广州锐博公司设计并合成野生型及突变型报告载体,分别为:R-Zfyve9-WT1(野生型)、R-Zfyve9-MUT1(57-64位突变,CGTGAAAT)、R-Zfyve9-MUT2(403-409位突变,CGTGAAA)和R-Zfyve9-MUT3(57-64位突变,CGTGAAAT和403-409位突变,CGTGAAA)。所有载体的报告荧光为位于目的基因3’ UTR区上游的海肾荧光素酶基因(hRluc),校正荧光为萤光虫荧光素酶基因(hluc)。将miR-17 mimic(终浓度50 nM)与报告基因载体(250 ng/孔)使用LipofectamineTM2000共转染接种于96孔板的293T细胞,每组3复孔。转染6 h后更换新鲜培养液。转染48 h后吸出培养基,加入luciferase底物,振荡10 min后加入Stop reagent,振荡后荧光照度计测定荧光值。通过报告基因相对荧光值的下调来印证miRNA与靶基因的相互作用。
1.3 统计学分析
2 结果
2.1 miR-17在体外缺血损伤中的动态变化
利用实时定量PCR技术检测miR-17的表达情况。结果miR-17在OGD早期1.5 h即可检测到表达上调,至OGD 3 h时达到高峰,超过OGD 0 h组10倍(P<0.05,如图1)。随着OGD时间延长,miR-17表达显著降低,到OGD 6 h和12 h时表达量与OGD 0 h比较差别无统计学意义(P>0.05)。
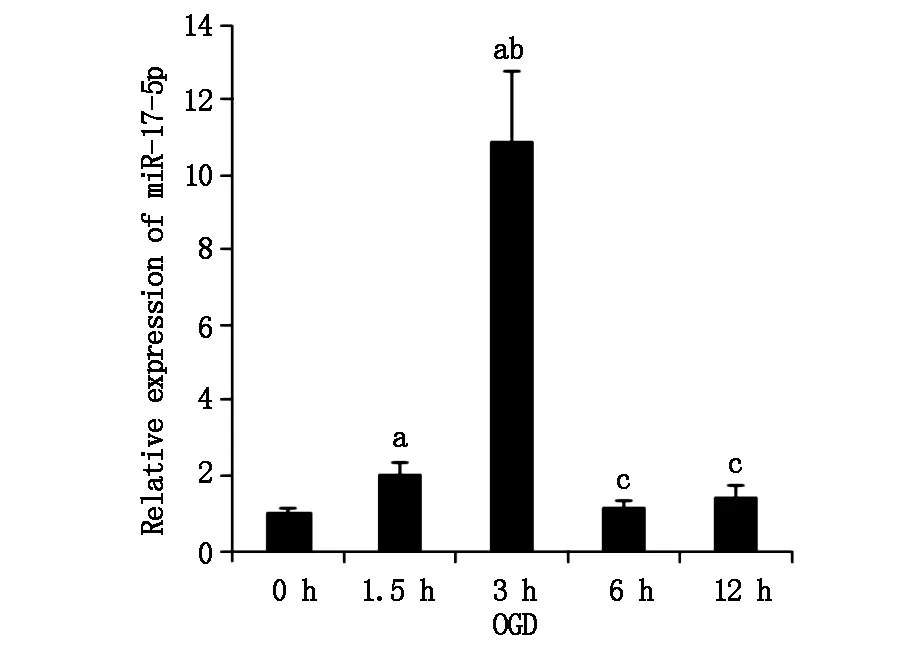
图1 miR-17表达随OGD动态变化a与OGD 0 h组比较P<0.05,b与OGD 1.5 h组比较P<0.05,c与OGD 3 h组比较P<0.05,n≥3/组
2.2 miR-17下调SARA蛋白表达
为明确miR-17对SARA的表达调控作用,本研究利用miR-17 mimic转染高分化PC12细胞,并使用Western blot技术对转染不同时间的SARA蛋白水平进行检测。结果,不同转染时间的mimic NC组SARA蛋白表达水平与对照组(control)相比,差别无统计学意义(P>0.05)。miR-17 mimic转染抑制SARA蛋白表达,转染24 h组SARA蛋白水平下调了57.01%。随着转染时间的延长,miR-17 mimic转染组SARA蛋白水平虽略有回升,但miR-17 mimic仍能有效抑制SARA蛋白表达直至mimic转染72 h(P<0.05,如图2)。
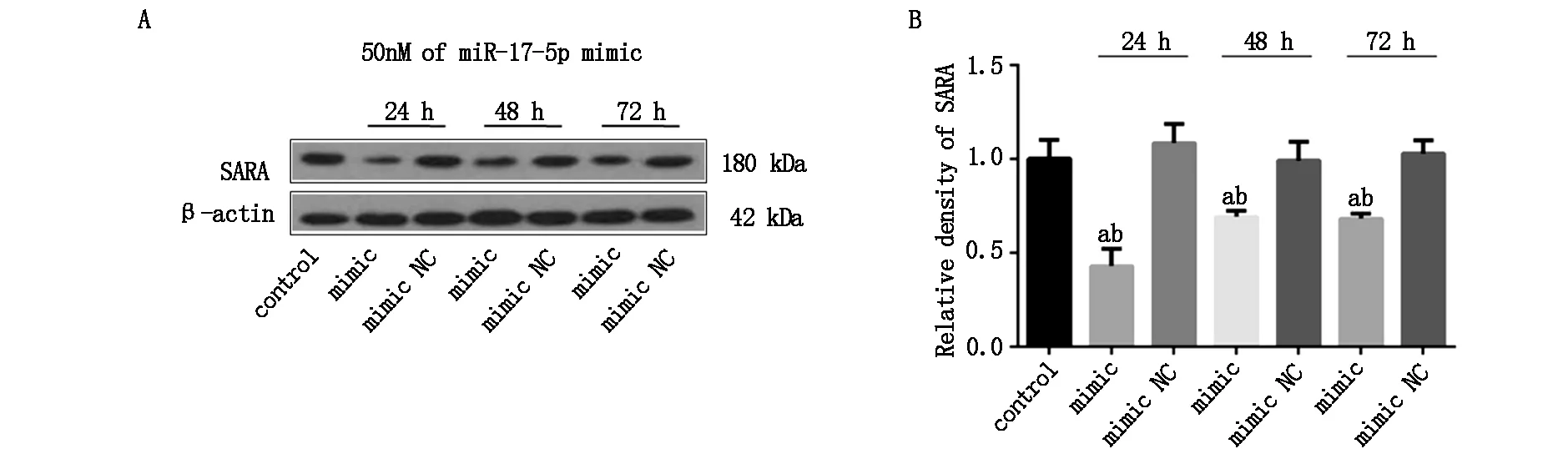
图2 miR-17 mimic抑制SARA蛋白表达(A)SARA蛋白表达检测;(B)SARA蛋白表达的灰度分析(a与对照组比较P<0.05,b与相应转染时间的mimic NC组比较P<0.05,n≥3/组)
2.3 miR-17靶向调控SARA表达
R-Zfyve9-WT1、R-Zfyve9-MUT1、R-Zfyve9-MUT2和R-Zfyve9-MUT3 4种双荧光素酶报告基因载体分别与miR-17 mimic或 NC转染后荧光分析示: 与R-Zfyve9-WT1+NC组比较,R-Zfyve9-WT1+miR-17 mimic组报告荧光显著下调,说明miR-17对SARA基因的3’UTR 区存在靶向调控。对两个预测靶位点进行突变后发现,突变型载体Mut1、Mut2、Mut3与miR-17 mimic共转染荧光强度较R-Zfyve9-WT1+miR-17 mimic组明显恢复(P<0.05,如图3)。说明位点(57-64)和位点(403-409)是miR-17调控SARA表达的靶点,且位点(57-64)和位点(403-409)的调控功能上呈现一定的协同作用。
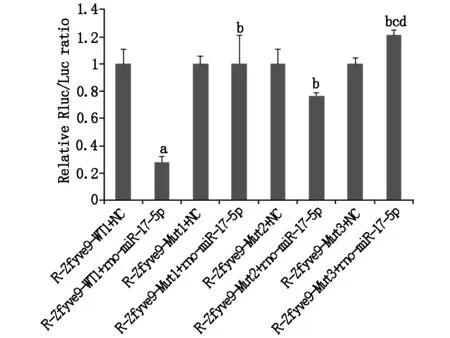
图3 双荧光素酶报告基因检测鉴定miR-17作用靶点a与R-Zfyve9-WT1+NC组比较P<0.05,b与R-Zfyve-WT1+rno-miR-17-5p组比较P<0.05,c与R-Zfyve-Mut1+rno-miR-17-5p组比较P<0.05,d与R-Zfyve-Mut2+rno-miR-17-5p组比较P<0.05
3 讨论
激活素A (ActA),是转化生长因子β(transforming growth factor-β,TGF-β)超家族的成员之一。通过ActA/Smads跨膜信号转导,ActA在缺血性脑损伤、神经系统退行性疾病以及神经精神类疾病中均发挥神经保护作用。前期研究发现,与经典的ActA/Smads线性通路不同,ActA/Smads信号具有正反馈环路作用模式:环路活化呈细胞外ActA浓度梯度依赖,信号活化后可反过来上调ActA基因的表达[4]。这样在外界刺激诱导ActA基因表达上调后,ActA信号可在短时间内实现跨膜信号的级联放大和活化,继而在SARA的辅助下通过膜受体激活Smads(R-Smads)的磷酸化活化和核内迁移,实现靶基因的表达调控,为ActA在急性脑缺血损伤的早期应答奠定生物学基础。然而ActA/Smads环路在短时程激活后自发衰减,呈现一定的自限性[4]。尽管ActA在缺血损伤的早期及延时缺血再灌注过程中均被发现具有神经保护作用[7,8],但是受环路自限性的影响,内源性ActA信号在缺血性脑卒中早期活化后很快进入衰竭阶段,将难以持续发挥生物学功能。因此,阐明ActA环路自限性及信号衰减的可能机制,并以此为切入点,寻找相应的干预靶点,延长ActA信号环路活化时程,是ActA内源性神经保护研究有待解决的关键问题。SARA作为TGF-β/Smads信号通路的衔接蛋白,是R-Smads向膜受体募集的重要辅助因子,具有调控R-Smads与膜受体定位,影响R-Smads平衡和分布的作用。在体外脑缺血性损伤模型中,SARA是ActA信号下游R-Smads磷酸化活化的辅助因子[9],其表达下调是ActA环路自限性的一个调控因素[4]。但引起SARA表达下调,ActA信号环路衰减的因素尚不清楚。
近期研究发现,miR-17可通过调控SARA的表达阻断食管鳞状细胞癌的迁移和侵袭[6]。miRNA基因转录的初级产物经剪切产生双链RNA双体(microRNA:microRNA*),即成熟的miRNA和其互补序列所组成的二聚体。成熟的microRNA单链会选择性地整合入RISC(RNA induced silencing complex)中识别靶基因,通过mRNA剪切和抑制蛋白质翻译的方式负性调控靶基因表达。microRNA*可能会被快速降解。大部分成熟microRNA来源于5’末端RNA链。本研究中的miR-17也一样。它在包括脑组织在内的多种组织细胞广泛表达。既往研究发现,miR-17在胚胎发育、神经元分化方面发挥作用,而且还调控了TGF-β超家族中骨形态发生蛋白(Bone morphogenetic protein,BMP)及TGF-β的信号通路转导[10-12]。但在ActA介导的抗脑缺血损伤信号环路中,miR-17的生物学功能尚不清楚。TargetScan、miRDB检测提示,miR-17与SARA的调控位点多物种间具有高度保守性。本研究在上述前期工作基础上,通过实时定量PCR检测发现miR-17在体外脑缺血性损伤后表达上调,在OGD3 h时达到高峰,随后降低。miR-17的这种表达变化特点与既往前期研究中发现的ActA/Smads信号强度变化规律相符。进一步对miR-17功能研究发现,miR-17 mimic瞬时转染可显著下调SARA蛋白表达。说明miR-17可以通过调控SARA的表达水平调控ActA信号活化强度。进一步的双荧光素酶报告基因检测证实miR-17能够通过这(57-64)和(403-409)位点靶向调控 SARA 表达,并且在对位点(57-64)和位点(403-409)的调控功能上呈现一定的协同作用。这样靶向miR-17的干预可通过上调SARA表达来实现增强ActA信号的作用,并为明确ActA信号衰减机制提供数据参考。
