胎盘生长因子在慢性哮喘大鼠肺组织中的表达
2020-12-24郑敏辉
郑敏辉,邱 琴,林 霞
支气管哮喘(简称哮喘)是一种慢性气道炎性反应性疾病,并伴有气道结构的改变及气道重塑,气道重塑的发生和进行性加重是哮喘进行性加重的重要原因。气道重塑的主要病理生理学表现为气道增厚、缩窄,上皮下胶原蛋白、上皮细胞脱落、间质化转变,杯状细胞增生、化生,气道平滑肌增生、增厚和血管生成等。胎盘生长因子(placenta growth factor,PlGF)是血管内皮生长因子(VEGF)家族中的一员。近来研究发现PlGF和VEGF-1在哮喘患者痰液中的表达增高[1],在COPD患者血清和支气管肺泡灌洗液的表达也增高[2]。PlGF与哮喘相关的研究目前较少,本实验通过建立慢性哮喘大鼠模型,观察慢性哮喘大鼠气道上皮损伤、气道炎性反应及气道重构,并检测慢性哮喘大鼠气道上皮及肺泡灌洗液中PlGF的表达,旨在观察PlGF在慢性哮喘大鼠中表达水平。
1 材料与方法
1.1 材料
1.1.1 实验动物健康清洁级 雄性SD大鼠45只,均购于山东鲁抗公司(SCXK(鲁)2017-0001),4~5周龄,体重130~160 g,实验1周前饲养于福建医科大学动物房内,恒温清洁环境,标准饲料,自由取水。
1.1.2 试剂卵清蛋白(ovalbumin,OVA) 干粉(吉泰科技生物)、氢氧化铝(恒兴试剂)、PAS染色试剂盒(北京索莱宝科技有限公司)、Masson三色染色试剂盒(北京索莱宝科技有限公司)、兔抗大鼠PlGF多抗(上海钰博生物科技有限公司)、PlGF Elisa试剂盒(上海博耀生物有限公司)。
1.1.3 主要仪器 雾化器(boy037G6000型,德国Pari公司);有机玻璃雾化箱;Olympus显微镜(日本奥林巴斯公司);酶标仪(美国Molecular Devices)。
1.2 方法
1.2.1 实验分组 将45只雄性SD大鼠随机分为3组(每组15只):(1)正常大鼠组(A组):未行特殊干预处理。(2)OVA致敏及生理盐水吸入大鼠组(B组):应用OVA致敏大鼠,生理盐水激发;(3)慢性哮喘大鼠组(C组):应用OVA致敏和反复激发的方法制备大鼠慢性哮喘模型。
1.2.2 建立慢性哮喘大鼠模型 参考Palmans等的方法[3],现用现配OVA 1 mg+氢氧化铝100 mg+生理盐水1 ml混悬液,在第1天及第8天,分别于每只大鼠腹部、两前足跖、两侧腹股沟处,每处皮下注射0.2 ml,另腹腔注射0.2 ml,并于腹腔处注射灭活百日咳杆菌菌苗2次,每次1ml,检测致敏的有效性。从第15天开始至第57天,将各组大鼠放于定制有机玻璃雾化箱内,给予雾化吸入1%OVA生理盐水溶液,总共6周,每周3次,每次30 min。
1.2.3 手术及取材 将各组大鼠于末次激发24 h后腹腔注射10%水合氯醛(0.3 ml/100 g)麻醉,固定于手术台上,剪开颈部皮肤,暴露气管,于气管插管处插入改造后的静脉留置针,并固定,快速打开胸腔,找出右主支气管,将其根部用细线结扎,取右肺上叶置-80 ℃中保存待用,取右肺下叶置于4 %多聚甲醛中固定72 h,后行脱水、石蜡包埋,切3 μm厚组织切片,行苏木精-伊红(HE)染色、过碘酸雪肤(PAS)染色、Masson三色染色,并行PlGF免疫组化染色。于气管插管处经静脉留置针将10 ml PBS液注入左主支气管行肺泡灌洗,回收BALF经离心机1000 r/min离心10 min,取上清液,ELISA 法测定BALF上清中PlGF水平。
1.2.4 肺组织病理图象的形态学测量及分析 将染色后的肺组织切片在Olympus显微镜下放大100~400倍观察,采集图像,各只大鼠随机选取5个视野,并应用Image Pro-Plus software 6.0软件进行肺组织病理图象的形态学测量及分析[4-6]。
1.2.5 大鼠肺组织切片PlGF免疫组化染色 右肺下叶石蜡切片行免疫组化染色,一抗为兔抗大鼠PlGF单抗,工作浓度为1∶100,二抗为辣根酶标记抗兔IgG聚合物,经DAB染色、苏木素复染。阴性对照:用生理盐水代替一抗,确定有无特异性结合。结果:PlGF阳性信号为胞浆着色,胞核不着色,为炎性细胞及Ⅱ型肺泡上皮细胞显示黄色或棕黄色的颗粒。Olympus显微镜下放大400倍,连续记数100个细胞,计算阳性细胞的平均百分数。染色强度分为阴性(0分),弱阳性(1分),阳性(2分)、强阳性(3分),阳性指数PI=阳性细胞百分数(%)×强度积分[7]。
1.2.6 ELISA法定量检测BALF上清液中PlGF的浓度 取各组大鼠BALF上清液,依照PlGF ELISA试剂盒使用说明正确操作,在450 nm处测出各标本吸光度(OD)值,并通过标准曲线求出各组大鼠上清液中PlGF浓度。

2 结 果
2.1 慢性哮喘模型的验证 HE染色示:正常大鼠组(A组)、OVA致敏生理盐水吸入大鼠组(B组)大鼠细支气管及肺泡结构清晰正常,支气管黏膜上皮完整,未见气道上皮损伤脱落,也未见明显的气道炎症细胞浸润。慢性哮喘大鼠组(C组)大鼠可见散在上皮细胞坏死和脱落,支气管黏膜皱襞增多卷曲,管腔狭窄。气道壁黏膜、黏膜下可见大量的炎性细胞浸润(图1)。

图1 各组大鼠气道炎性浸润及上皮细胞脱落病理学观察及形态学分析(HE,×200)
PAS染色示:染成玫瑰红色的面积表示杯状细胞增生程度。A组、B组大鼠未见明显的气道上皮杯状细胞增生及黏液分泌增多。C组大鼠的气道上皮可见杯状细胞增生,且黏液分泌增多(图2)。
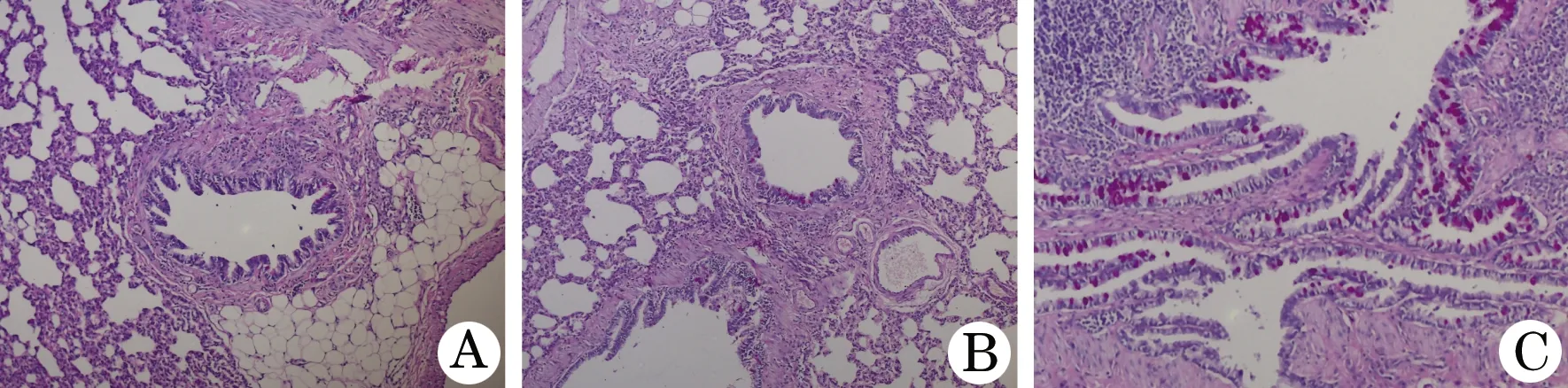
图2 各组大鼠气道上皮杯状细胞增生病理学观察(PAS,×100)
Masson三色染色示:上皮下染成蓝色的面积表示胶原纤维沉积程度。A组、B组大鼠上皮下未见明显的胶原纤维沉积,相比之下,C组大鼠上皮下可见明显的胶原纤维沉积(图3)。

图3 各组大鼠气道上皮下胶原纤维沉积病理学观察(Masson三色,×200)
2.2 各组大鼠气道上皮PlGF的表达 PlGF免疫组化染色阳性信号为胞浆着色,胞核不着色,为炎性细胞及Ⅱ型肺泡上皮细胞显示黄色或棕黄色的颗粒。显示正常大鼠组(A组)及OVA致敏生理盐水吸入大鼠组(B组)大鼠气道上皮均未见明显PlGF表达(PI分别为0.89±0.08、0.94±0.12),A组与B组间无明显差异,与A组、B组相比,慢性哮喘大鼠组(C组)大鼠气道上皮PlGF表达显著增加,PI为2.28±0.18(P<0.01,图4)。
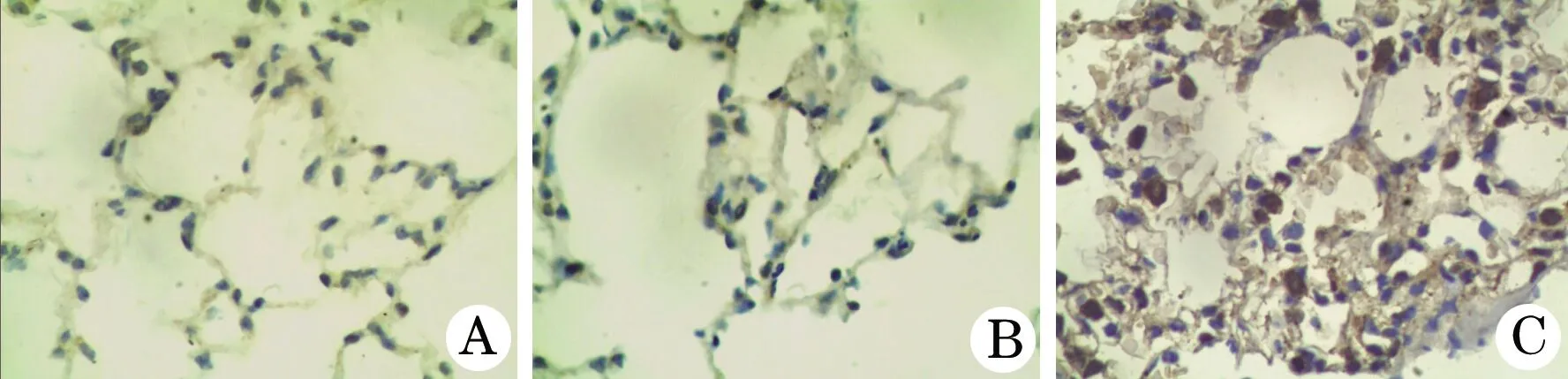
图4 各组大鼠免疫组织化学染色肺组织切片(SABC,×400)
2.3 各组大鼠肺泡灌洗液(BALF)上清中PlGF的水平 慢性哮喘大鼠组(C组)大鼠BALF上清中PlGF水平为18.87±4.53 ng/ml,高于正常大鼠组(A组)测得的12.35±1.94 ng/ml及OVA致敏生理盐水吸入组(B组)测得的13.14±2.52 ng/ml,差异均有统计学意义(P<0.05),A组与B组差异无统计学意义。
3 讨 论
哮喘的病因和发病机制一直是国内外研究的热点,文献[8]研究发现,PlGF在吸烟哮喘患者的血清及痰液中表达增加,且PlGF的表达水平与支气管壁的厚度呈正相关,而与肺功能呈负相关。在吸烟哮喘患者中,PlGF可以通过促进血管生成来促进气道重构。人类肺微血管内皮细胞积极参与哮喘患者气道壁的血管重塑[9],而内皮细胞中的PlGF可促进新血管的形成[9, 10]。PlGF属于VEGF家族,PlGF不仅能够促进血管内皮细胞,尤其是微血管内皮细胞的增殖,还具有诱导血管内皮细胞的迁移和激活作用,并且可作为内皮细胞生长因子的趋化因子来调节内皮细胞的生长[11]。另外PlGF还具有促进单核细胞及内皮细胞的游走、增加内皮细胞通透性的作用。PlGF在肺内主要由肺上皮细胞分泌[1]。PlGF是促血管生成因子,同时能促进炎性反应,推测PlGF的表达增加在哮喘气道重构中起着重要作用。
本研究采用免疫组织化学方法首次检测了OVA致敏和反复激发的慢性哮喘大鼠肺组织中PlGF蛋白表达。根据肺组织病理学检测,其病理变化符合哮喘的基本病理特征,也与Clarke等[12]提出的哮喘动物模型特征基本相符,慢性哮喘大鼠模型复制成功。本研究显示慢性哮喘大鼠气道上皮细胞PLGF表达与正常大鼠及OVA致敏生理盐水吸入处理大鼠相比均明显增加,BALF中PLGF水平也升高。
研究表明,PlGF在正常鼠肺组织肺泡结构发育完整后仅有低度表达[13]。本实验中,在OVA致敏和反复激发的慢性哮喘大鼠肺组织中,PlGF呈高表达,主要为炎性细胞表达,提示其可能一方面参与急性炎症损伤肺组织的修复,另一方面通过促进炎症介质表达扩大了炎性反应。在细胞培养实验中,PlGF能增强肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)mRNA 的表达,提高IL-8、单核细胞炎性蛋白-1β(MIP-1β)的水平[14];PlGF能通过Flt-1促进单核细胞趋化蛋白-1(MCP-1)、粘附分子的活化和迁移,可能在哮喘气道重构中有着重要作用[15]。另外,转化生长因子-β(TGF-β)能上调PlGF的表达,而TGF-β在哮喘气道炎性反应与气道重塑中扮演着重要的作用[16],而且TGF-β在PQ致肺纤维化过程中表达明显升高[17],提示PlGF可能参与了TGF-β介导的病理进程。
综上,本研究表明,PlGF与哮喘气道重塑关系密切,因此,有理由认为PlGF在哮喘的诱发及进展中发挥一定作用。但本研究样本量较小、设计较为简单,仍需进一步完善实验设计及明确PlGF的具体表达通道,进行更深入地研究。
