大熊猫犬瘟热病毒(CDV-PA-1421 株)微载体悬浮培养工艺研究
2020-12-22静李艳玲朱明媛谷孝玉李
刘 静李艳玲朱明媛谷孝玉李 润
(唐山怡安生物工程有限公司,河北唐山063020)
犬瘟热(Canine distemper,CD)是由犬瘟热病毒(Canine distemper virus,CDV)引起的一种急性、高度接触性传染病,有较高发病率和病死率,临床上以厌食、双相热、结膜炎、严重的胃肠炎和神经症状为典型特征。 大熊猫是我国重点保护濒危珍稀野生动物,随着犬瘟热感染宿主范围的日益扩大,从1983 年开始,享有“活化石”之称的国宝大熊猫也相继有感染犬瘟热死亡的报道。 2014 年12 月至2015 年楼观台秦岭大熊猫繁育基地,6 只被CDV感染的大熊猫中有5 只死亡,幸存的1 只因早前接种过CDV 疫苗,体内存在CDV 中和抗体,未表现临床症状,这表明中和抗体可以使大熊猫免受CDV强毒的致死性攻击[1-2]。 因此,及时进行疫苗免疫是防控犬瘟热病的关键措施,可提高大熊猫的抵抗力[3-4]。
目前,国内外用于大熊猫CDV 免疫预防的疫苗主要有三类:(1)弱毒疫苗。 弱毒疫苗已在国内外普遍应用并取得了一定的效果,但弱毒疫苗接种后保护效果较弱或安全性不足[5]。 (2)基因工程疫苗。 基因工程疫苗相对而言比较安全,仅能在哺乳类动物机体发生复制,不能产生感染[6],但免疫持续期短,不能产生足够的记忆细胞维持长期免疫力[7]。 (3)灭活疫苗。 国内部分动物园使用该苗作为大熊猫的预防疫苗,多年来未发现任何临床CDV 病例,也未出现疫苗源性的安全问题,但目前还没有熊猫源性的犬瘟热灭活疫苗,多联苗在疫病防控上效果欠佳,因此,研发大熊猫犬瘟热专用灭活疫苗迫在眉睫。 本研究采用正交试验确定Vero细胞培养、MOI、pH 值、温度、收获时间等工艺参数,建立大熊猫犬瘟热灭活疫苗(CDV -PA -1421株) 的悬浮培养工艺,制备高质量的大熊猫犬瘟热灭活疫苗。
1 材料和方法
1.1 试验材料 Vero 细胞,批号Vero-B0402-002,130 代,由唐山怡安生物工程有限公司制备并贮存。 大熊猫犬瘟热病毒(CDV-PA-1421 株),保存于中国微生物菌种保藏管理委员会普通微生物中心(保藏号:18179)。 MSVP 培养基购于上海源培生物科技股份有限公司,胰蛋白酶购于GIBCO,新生牛血清购于兰州民海生物公司,谷氨酰胺购于Invitrogen,微载体Cytodex 1 购于GE。 生物反应器(C-10 -2 CC 型)购自德国Sartorius。 实验动物,18 ~22 g 小鼠10 只,购自北京华阜康生物科技股份有限公司。
1.2 方法
1.2.1 Vero 细胞微载体培养参数 采用正交试验,选择细胞接种浓度、微载体浓度、细胞生长液3 个影响细胞增殖的因素,每个因素设置3 个水平条件(表1)。 通过选择的条件进行Vero 细胞培养,37 ℃培养96 ~168 h 后进行计数,根据最高细胞密度,比较不同因素对细胞增殖的影响。
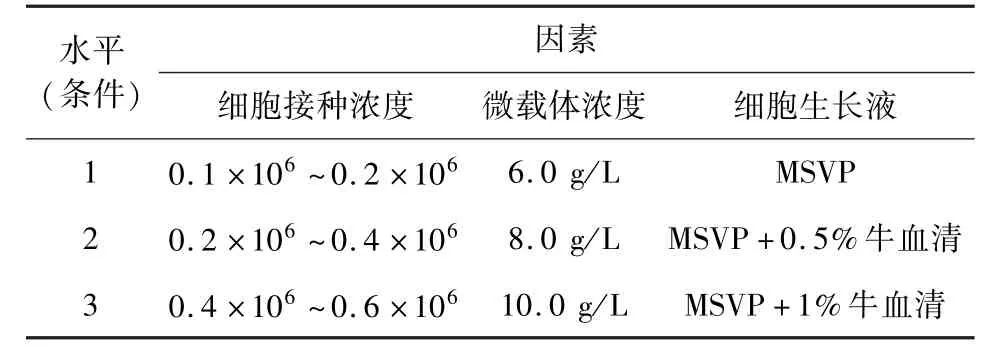
表1 Vero 细胞微载体培养正交试验设计表Tab 1 Orthogonal experiment design table of Vero cell microcarrier culture
1.2.2 病毒培养条件 采用正交试验确定病毒培养条件,选择不同MOI、pH 值、温度、收获时间4 个因素,每个因素分别设置不同水平(表2)。 根据最高病毒含量,比较不同因素和水平对病毒增殖的影响。

表2 大熊猫犬瘟热病毒正交试验设计表Tab 2 Orthogonal experiment design table of giant panda canine distemper virus
1.2.3 10L 反应器病毒培养工艺验证 根据确定培养条件,将长成单层的Vero 细胞消化,接种到10L 反应器中,加入细胞生长液至工作体积。 待细胞长成单层后,接种大熊猫犬瘟热(CDV -PA -1421株)毒种,在37 ℃pH7.2 条件下培养96 ~120 h,观察细胞病变(CPE)。 CPE 达到70% ~80%时收获上清液,按Reed -Muench 法计算其半数细胞感染量(TCID50),检测病毒含量。 连续培养3 批病毒,验证工艺的稳定性。
1.2.4 疫苗制备及检验 将收获液过滤去除细胞碎片后,经澄清、浓缩、灭活、配比、分装等工序,获得大熊猫犬瘟热病毒灭活疫苗(CDV-PA-1421 株),参照《中国兽药典》(2015 年版)进行性状、装量、无菌、pH 值、安全检验。
2 结果与分析
2.1 Vero 细胞微载体培养条件 对正交试验结果进行极差分析可知(表3),影响细胞增殖的因素细胞接种浓度>微载体浓度>细胞生长液,优水平组合为A2B2C3,即细胞接种浓度0.2×106~0.4×106/mL、微载体浓度8.0 g/L、细胞生长液MSVP。 方差分析结果显示(表4),细胞接种浓度、微载体浓度对试验结果的影响高度显著,细胞生长液无显著影响。

表3 Vero 细胞微载体培养极差分析Tab 3 Range analysis of Vero cell microcarrier culture
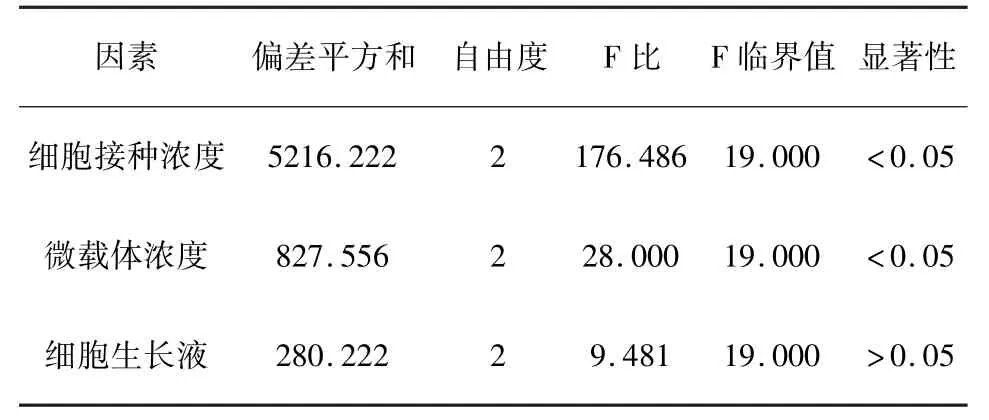
表4 Vero 细胞微载体培养方差分析Tab 4 Variance analysis of Vero cell microcarrier culture
2.2 病毒培养条件 对正交试验结果进行极差分析可知(表5),优水平组合为A1B1C2D3,即MOI 0.01、温度37 ℃、pH 7.2、收获时间96 ~120 h,影响病毒增殖的因素,收获时间>MOI >温度>pH值。 方差分析结果显示(表6),MOI、温度、收获时间对试验结果高度显著,pH 值无显著影响。

表5 大熊猫犬瘟热病毒培养极差分析Tab 5 Range analysis of giant panda canine distemper virus

表6 大熊猫犬瘟热病毒培养方差分析Tab 6 Variance analysis of giant panda canine distemper virus culture
2.3 工艺重复性验证 如图1 所示,3 批收获液病毒含量达到107.0~107.5TCID50/0.1 mL。

图1 大熊猫犬瘟热疫苗工艺重复性验证Fig 1 The repeatability test of the culture craft for canine distemper vaccine of giant pandas
2.4 疫苗检验 经检验,大熊猫犬瘟热灭活疫苗(CDV - PA -1421 株)性状为乳白色至淡红色液体,静置后底部有白色沉淀,轻轻振摇,呈均匀悬液,pH 值为7.2。 使用18 ~22 g 小鼠10 只,腹腔注射,每只0.5 mL,观察21 d,小鼠全部健活,没有出现任何的局部和全身不良反应。
3 结论与讨论
犬瘟热病毒自1809 年报道以来,在世界范围内广泛流行[8]。 随着CDV 毒株基因的不断变异,宿主范围已由犬和猫扩大到其他哺乳动物,尤其是濒危的大熊猫[9]。 犬瘟热已经成为威胁大熊猫种群数量和生命安全的第一大烈性传染病[10-11],然而现有犬瘟热疫苗的免疫效果有所降低,针对熊猫源的专用疫苗更是欠缺,迫切需要研发更为有效的疫苗制剂。 本研究所用大熊猫犬瘟热病毒(CDV-PA-1421 株)是陈德坤团队2015 年提取分离的大熊猫犬瘟热病毒陕西株,属强毒株,与已发表CDV SD(14)11 毒株(亚洲-1 型)同源性为98%[12],毒株十分宝贵。 本试验基于已有的大熊猫犬瘟热搅拌瓶工艺参数,利用正交试验对培养基、细胞接种浓度、微载体浓度、pH 值、病毒MOI 等关键参数进行研究,从而确定大熊猫犬瘟热病毒(CDV-PA-1421 株)微载体悬浮培养工艺。
Vero 细胞微载体培养方差分析结果显示:微载体浓度、细胞接种密度对试验结果影响高度显著,但并不是细胞接种密度及微载体浓度越高越好。微载体浓度低时,细胞增殖受限,最高细胞密度较低。 微载体浓度过高,搅拌速度较大,对细胞造成损伤,不仅不利于细胞生长,微载体成本也较高。此外,细胞接种密度为0.4 ×106/mL ~0.6 ×106/mL反而比0.2 ×106/mL ~0.4 ×106/mL 的最高细胞密度低。 这是由于过高的接种密度,会造成营养物质过快耗竭,影响细胞增殖,更不利于后期的病毒繁殖。 细胞生长液优选条件为MSVP +1%血清,但是否添加血清对最高细胞密度影响较小,方差分析也显示细胞生长液对细胞增殖的影响不显著。 此外,血清的添加也存在诸多问题:无论是进口或国产血清均可能存在外源病毒污染的风险,影响疫苗产品的安全性;血清白蛋白易吸附在微载体表面,细胞贴附率明显下降;杂蛋白、激素、多肽等多种杂质增大下游分离纯化的难度。 因此,本试验选择MSVP无血清培养基作生产培养基。
病毒培养方差分析显示:MOI 对病毒增殖影响显著,但0.01、0.03、0.1 结果差异较小,显著性主要来自0.3 MOI 水平与其他水平的差距。 当MOI大于0.3 时,细胞病变过快,细胞维持时间短,影响病毒增殖,最终收获液的病毒含量偏低,从而确定最适MOI 为0.01 ~0.1。 温度对病毒增殖影响显著,37 ℃条件下的病毒含量明显高于34 ℃。 收获时间对病毒增殖影响高度显著,培养96 ~120 h 病毒滴 度 高 于107.0TCID50/0. 1mL,与 水 貂 犬 瘟 热(CDV3 -CL 株)在100 ~120 h 获得高滴度病毒液一致[13]。
本研究确定大熊猫犬瘟热病毒(CDV-PA-1421株)培养工艺为:将长成单层的Vero 细胞消化,接种到10L 生物反应器中,细胞接种浓度为0.2 ×106/mL ~0.4 ×106/mL,微载体浓度为8.0 g/L,细胞生长液为MSVP 培养基。 按0. 01 ~0. 1MOI 接毒,37 ℃pH 值7.2 条件下培养96 ~120 h 收获上清液,即可获得高于107.0TCID50/0.1mL 的收获液。 连续进行3 批重复性验证结果显示,病毒培养工艺稳定,收获液病毒含量在107.0~107.5TCID50/0.1mL,批间差异小,为大熊猫犬瘟热灭活疫苗的研究奠定良好基础。 由于大熊猫的保护限制,无法对其进行犬瘟热攻毒试验研究,难以确定大熊猫犬瘟热特异性抗体保护效价,本研究将继续利用制备的灭活疫苗免疫其他动物,进行异源精制抗体的研究,以期为大熊猫犬瘟热的治疗提供更多的解决方案。
