不同肝纤维化程度乙型病毒性肝炎患者血清HBV DNA、Ⅲ型前胶原肽的表达水平及意义
2020-12-22赵楠李宗尧
赵楠,李宗尧
(南阳市中心医院 检验科,河南 南阳 473000)
肝纤维化是由多种致病因子导致的肝内结缔组织增生异常,最重要的致病因素为乙型肝炎病毒(hepatitis B virus,HBV)[1]。HBV长期存在于机体内可持续性损伤肝脏结构和功能,继而致使肝细胞严重坏死和肝脏内纤维增生,从而发生肝纤维化,控制效果欠佳时易进展为肝硬化[2]。随着医疗技术的发展,研究发现肝纤维化可以逆转,需进一步对肝纤维化病理生理、逆转机制进行研究,以寻找更加有效的治疗方案[3]。本研究探讨不同肝纤维化程度乙型病毒性肝炎患者血清HBV DNA、Ⅲ型前胶原肽(type Ⅲ procollagen,PCⅢ)的表达意义。
1 资料与方法
1.1 一般资料选取2018年1月至2019年6月南阳市中心医院收治的120例乙型病毒性肝炎患者。120例患者:男63例,女57例;年龄33~50岁,平均(41.52±4.22)岁;病程2~7 a,平均(4.53±1.20)a;肝纤维化分期为S0期32例,S1期30例,S2期29例,S3期29例;肝炎程度为轻度42例,中度39例,重度39例。本研究经南阳市中心医院医学伦理委员会审核通过。告知患者及家属本研究内容后其签署知情同意书。
1.2 选取标准(1)纳入标准:①经乙肝五项、穿刺活检等综合性检查确诊为乙型病毒性肝炎;②符合肝纤维化分期中S0~S3期;③临床资料完整;④符合恩替卡韦的用药适应证者,其适应证包括病毒复制活跃、谷丙转氨酶(alanine transaminase,ALT)持续增加或者肝脏组织结果显示有活动性病变等。(2)排除标准:①严重认知障碍;②合并精神疾病;③合并全身性免疫系统疾病;④合并其他感染性疾病;⑤对治疗药物甘草酸二铵、还原型谷胱甘肽以及恩替卡韦成分过敏。
1.3 治疗方法给予所有患者甘草酸二铵[华润双鹤利民药业(济南)有限公司,国药准字H20065108]、还原型谷胱甘肽(福安药业集团湖北人民制药有限公司,国药准字H20183085)、恩替卡韦(正大天晴药业集团股份有限公司,国药准字H20100019)联合治疗。口服恩替卡韦,每次0.5 mg,每日1次。取150 mL甘草酸二铵溶于50 g·L-1的 250 mL葡萄糖溶液中,静脉滴注,每日1次。取还原型谷胱甘肽1.2 g溶于50 g·L-1的250 mL的葡萄糖溶液中,静脉滴注,每日1次。
1.4 检测方法取晨起肘静脉血5 mL,离心速度为1 500 r·min-1,持续15 min,取血清,利用深圳匹基生物工程股份有限公司生产的Roche Light Cycle荧光PCR荧光定量仪以及检测试剂盒,对血清HBV DNA水平进行定量检测,利用放射免疫分析法检测血清PCⅢ水平。试剂盒由上海海研医学生物科技有限公司提供,操作步骤严格按照说明书进行。
1.5 观察指标(1)不同肝纤维化程度乙型病毒性肝炎患者的血清HBV DNA、PCⅢ水平。(2)血清HBV DNA水平与血清PCⅢ水平的相关性。(3)治疗前和治疗1、3、6个月的血清HBV DNA、PCⅢ水平。

2 结果
2.1 不同肝纤维化程度乙型病毒性肝炎患者的血清HBV DNA、PCⅢ水平与S0期比较,S1期、S2期、S3期血清HBV DNA、PCⅢ水平较高(P<0.05);与S1期比较,S2期、S3期血清HBV DNA、PCⅢ水平较高(P<0.05);S3期血清HBV DNA、PCⅢ水平高于S2期(P<0.05)。见表1。
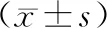
表1 不同肝纤维化程度乙型病毒性肝炎患者的血清 HBV DNA、PCⅢ水平比较
2.2 血清HBV DNA水平与血清PCⅢ水平的相关性经Pearson分析可知,HBV DNA与PCⅢ呈正相关(r=0.437,P=0.027)。
2.3 不同时间点血清HBV DNA、PCⅢ水平治疗6个月,血清HBV DNA、PCⅢ水平低于治疗前、治疗1个月、治疗3个月相应的血清HBV DNA、PCⅢ水平(P<0.05);治疗3个月,血清HBV DNA、PCⅢ水平低于治疗前、治疗1个月相应的血清HBV DNA、PCⅢ水平(P<0.05);治疗1个月,血清HBV DNA、PCⅢ水平低于治疗前相应的血清HBV DNA、PCⅢ水平(P<0.05)。见表2。
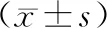
表2 不同时间点血清HBV DNA、PCⅢ水平比较
3 讨论
乙型病毒性肝炎患者免疫功能失调,加上致病因素持续作用致使胶原蛋白等细胞外基质沉积于肝内,引发肝细胞纤维组织的异常增生,最终产生肝纤维化[4]。研究显示,肝纤维化病理过程具有可逆性,早期给予患者及时的治疗可有效阻滞肝纤维化的进展,从而缓解病情,提高患者的生存质量[5]。临床诊断肝纤维化的方式以肝组织病理活检为主,其属于创伤性检查,部分患者无法耐受,故临床运用时存在局限性,影响治疗效果[6]。因此,需寻找更为安全以及有效的肝纤维化程度评估方法。
临床诊断乙型病毒性肝炎的直接、灵敏、特异的指标为HBV DNA,可根据HBV DNA的水平对病情进行评估,具有快捷、操作简单、无创等优势。PCⅢ水平可直接反映肝纤维化程度[7]。本研究结果显示,随着肝纤维化程度的加重,血清HBV DNA、PCⅢ水平逐渐升高。经Pearson分析可知,HBV DNA水平与PCⅢ水平呈正相关,说明HBV DNA水平也可反映肝纤维化程度,为临床评估肝纤维化提供可靠依据。HBV水平变化反映病毒复制程度,而病毒复制主要在肝脏内进行,在大量复制过程中可激发机体正常免疫系统清除病毒,还可诱发机体发生一系列免疫病理反应,致使肝细胞发生损伤,肝功能异常,继而诱发肝纤维化。肝纤维化的重要机制为免疫损伤,在乙型病毒性肝炎缓慢进展的过程中,HBV感染所致免疫激活或者再激活是乙型病毒性肝炎相关性纤维化、肝硬化以及肝癌发生和进展的重要机制。随着肝纤维化的进展,HBV感染时可通过肝脏内的驻留细胞以及肝星状细胞分化、转化,导致PCⅢ合成增加,PCⅢ水平升高[8]。如果发现PCⅢ合成速度提高,便可早期反映出肝脏内有活跃性纤维形成,此时给予患者积极的治疗可减缓疾病进展过程。但在临床应用时需注意当处于免疫清除期时,肝脏内的炎症活动较严重,此时部分病毒会被清除,导致HBV DNA水平降低。在耐受期间,病毒复制活跃性升高,HBV DNA水平较高,此时不易准确评估病情,进而影响治疗方案的制定及治疗效果,甚至引发不良事件。本研究结果显示,血清HBV DNA、PCⅢ水平随着治疗时间的延长而降低,说明血清HBV DNA、PCⅢ水平可随治疗效果而发生变化,在临床中具有较高的临床价值。动态监测患者的血清HBV DNA、PCⅢ水平,及时对临床治疗方案进行调整,以提高临床治疗效果。
随着乙型病毒性肝炎患者肝纤维化程度的加重,血清HBV DNA、PCⅢ水平呈上升趋势,可为临床评估病情提供可靠依据。动态监测血清HBV DNA、PCⅢ水平,对病情实时评估和治疗方案的调整具有重要作用。
