芹菜AgLIMS基因的克隆和生物信息学分析及其表达特性
2020-12-18贾丽丽刘洁霞熊爱生
贾丽丽, 尹 莲, 刘洁霞, 王 昊, 沈 迪, 冯 凯, 熊爱生,①
(南京农业大学: a. 园艺学院, b. 作物遗传与种质创新国家重点实验室,c. 农业农村部华东地区园艺作物生物学与种质创制重点实验室, 江苏 南京 210095)
芹菜(ApiumgraveolensLinn.),也即旱芹,隶属于伞形科(Apiaceae)芹属(ApiumLinn.)[1],是重要的叶菜类蔬菜作物之一。芹菜属于冷凉性蔬菜,最适种植温度为15 ℃~ 20 ℃[2],温度是影响芹菜产量和品质的重要因子之一,高温和低温均会引发如烧心、空心和叶柄开裂等常见病害,进而影响芹菜的产量和品质。干旱和高盐等非生物胁迫也会对芹菜的产量和品质有较大的影响。
萜类化合物种类繁多、结构多样,是植物次生代谢产物中种类最多的一类[3],在植物生长发育调控和响应外界环境胁迫时有重要作用[4-6]。在生物和非生物胁迫下,萜类化合物均可被诱导以启动防御反应。例如:在高温条件下,冬青栎(QuercusilexLinn.)利用单萜清除细胞内的自由基团和活性氧等,同时产生大量的挥发性单萜降低树体温度以减少高温伤害[7];在氧化胁迫下,单萜还可通过降低臭氧含量缓解氧化伤害[8]。萜类化合物是伞形科植物挥发油的主要组成成分之一,其在植物防御非生物胁迫过程中的作用为伞形科植物抗逆性研究提供了新的方向和思路。
柠檬烯是萜类化合物中结构最简单的环状功能单萜,是许多环状萜类化合物形成的前体物质。已有研究表明:柠檬烯合酶可作为研究环状单萜合酶的模式酶[9]。自1993年Colby等[10]从留兰香(MenthaspicataLinn.)中克隆获得第1个柠檬烯合酶基因(LIMS基因)以来,研究者陆续从水稻(OryzasativaLinn.)、薄荷(MenthahaplocalyxBriq.)和雷公藤(TripterygiumwilfordiiHook. f.)等植物中克隆获得柠檬烯合酶基因,并对其功能进行了初步研究[11-13]。而芹菜中柠檬烯合酶基因的功能和表达特性,以及在非生物胁迫条件下该基因在芹菜抗逆性诱导和调控中的作用,人们尚未有清晰的了解。
鉴于此,作者以芹菜品种‘六合黄心芹’(‘Liuhe Huangxinqin’)和‘津南实芹’(‘Jinnan Shiqin’)为研究对象,克隆获得其LIMS基因,并采用生物信息学分析方法对该基因及其编码的蛋白质的结构和功能进行分析;采用qRT-PCR技术检测该基因的相对表达量在不同组织及不同胁迫条件下的变化,为进一步研究芹菜对逆境胁迫的抗性机制提供基础研究数据。
1 材料和方法
1.1 材料
供试芹菜品种‘六合黄心芹’和‘津南实芹’的种子均保存于南京农业大学作物遗传与种质创新国家重点实验室伞形科蔬菜作物实验室。
于2019年2月将种子播种并置于人工气候生长室内,参照文献[14]设置培养条件,待幼苗长至2月龄时,分别取近植株顶部的3或4枚叶片(茎叶)以及叶柄(中上部)和根各0.5 g,立即用液氮速冻并保存于-80 ℃冰箱中,用于总RNA提取、cDNA合成及基因表达分析,取样设置3个生物学重复。参照文献[14]的实验设计,并采用相同的培养条件,对2月龄苗分别进行低温(4 ℃)、高温(38 ℃)、干旱(质量体积分数20%PEG6000)和高盐(0.2 mol·L-1NaCl)处理,处理24 h;每处理5盆,每盆6株,共30株;分别在处理0(CK)、1、2、4、8和24 h时,取近植株顶部的3或4枚叶片,立即用液氮速冻并保存于-80 ℃冰箱中,用于qRT-PCR分析,采样时每处理设置3个生物学重复。
1.2 方法
1.2.1 总RNA提取和cDNA合成 分别取2个芹菜品种的叶片,用RNAsimple Total RNA Kit 总RNA提取试剂盒〔天根生化科技(北京)有限公司〕提取总RNA,并用PrimeScriptTMRT reagent Kit反转录试剂盒〔宝生物工程(大连)有限公司〕将总RNA反转录成cDNA。具体操作过程见试剂盒说明书。
1.2.2 基因克隆 基于芹菜转录组和基因组数据库[15-16],检索获得AgLIMS基因;根据该基因序列分别设计正向引物(5′-ATGGCTCTTGCATCCTCTTCTCAGA-3′)和反向引物(5′-TTATCTATCATTCCCAATAAGAGTT-3′)。PCR扩增体系总体积20.0 μL,包括PrimeSTAR Max Premix〔宝生物工程(大连)有限公司〕10.0 μL、双蒸水7.0 μL、5 mmol·L-1cDNA模板1.0 μL及10 μmol·L-1的正向和反向引物各1.0 μL。扩增程序为:94 ℃预变性5 min;94 ℃变性30 s、54 ℃退火30 s、72 ℃延伸30 s,共35个循环;72 ℃延伸10 min。扩增产物交由南京金斯瑞生物科技有限公司进行测序。
1.2.3 生物信息学分析 采用BioXM 2.6软件对克隆获得的AgLIMS基因进行序列分析;采用NCBI数据库中的BLASTp工具对AgLIMS基因编码的氨基酸序列的保守域进行预测,并获得其他植物LIMS基因编码的氨基酸序列;采用DNAMAN 6.0软件对AgLIMS基因与其他植物LIMS基因编码的氨基酸序列进行多重比对,并进行亲水性和疏水性分析;采用MEGA 5.2软件绘制AgLIMS基因与其他植物LIMS基因编码的氨基酸序列的系统进化树;使用ExPASY数据库和序列处理在线工具包(SMS)(http:∥www.bio-soft.net/sms/)分析AgLIMS蛋白的理论相对分子质量、氨基酸组成和理论等电点等;通过SOPMA网站(https:∥npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)对AgLIMS蛋白的二级结构进行在线预测;通过CPHmodels 3.2网站(http:∥www.cbs.dtu.dk/services/CPHmodels/)在线建立AgLIMS蛋白的三级结构模型。
1.2.4 qRT-PCR分析 根据AgLIMS基因测序结果,采用Primer Premier 6.0软件设计荧光定量引物,正向引物序列为5′-TTGGTGGAGGCTCGGTGGTT-3′,反向引物序列为5′-TGCTTCATCACTGCTGCCCATTT-3′;以芹菜actin基因作为内参基因[17],使用qRT-PCR检测系统分析AgLIMS基因的表达水平。反应体系总体积20.0 μL,包括10 μmol·L-1的正向和反向引物各0.4 μL、Hieff qPCR SYBR Green Master Mix(上海翊圣生物科技有限公司) 10.0 μL、双蒸水7.2 μL和5 mmol·L-1cDNA模板 2.0 μL。扩增程序为:95 ℃预变性5 min;95 ℃变性10 s、55 ℃~60 ℃退火20 s、72 ℃延伸20 s,共40个循环。采用2-ΔΔCt法[18]计算AgLIMS基因的相对表达量。
1.3 数据处理分析
用EXCEL 2010和SPSS 24.0软件对AgLIMS基因的相对表达量数据进行整理分析,采用单因素方差分析法和Duncan’s多重比较法进行差异显著性分析。
2 结果和分析
2.1 AgLIMS基因的克隆和测序结果
克隆和测序结果显示:AgLIMS基因的开放阅读框长1 800 bp,编码599个氨基酸。芹菜品种‘六合黄心芹’和‘津南实芹’AgLIMS基因核苷酸序列有2个碱基位点的差异,分别为第954位的C和A以及第1 693位的A和G(图1),核苷酸序列的差异导致其编码的氨基酸位点发生改变,分别为第318位的丝氨酸(Ser)和精氨酸(Arg)以及第565位天冬酰胺(Asn)和天冬氨酸(Asp)。保守域预测结果(图2)显示:AgLIMS基因编码的氨基酸序列在第50至第586位存在植物萜类合酶(Terpene cyclase plant C1)保守区域,具有典型的类异戊二烯合成酶(Isoprenoid Biosyn C1)超家族结构域。
2.2 AgLIMS基因编码的氨基酸序列的生物信息学分析
2.2.1 同源性比对和系统进化分析 芹菜品种‘六合黄心芹’和‘津南实芹’AgLIMS基因与其他13种植物LIMS基因编码的氨基酸序列的多重比对及系统进化分析结果分别见图3和图4。多重比对结果(图3)显示:AgLIMS基因与其他植物LIMS基因编码的氨基酸序列一致性为61.33%,且均含有萜类合酶氨基酸序列的2个高度保守域RRX8W和DDXXD。

方框内序列为有差异的核苷酸位点及对应的氨基酸位点The sequences in the boxes are different nucleotide sites and corresponding amino acid sites. *: 终止密码子Stop codon.

图2 芹菜AgLIMS基因编码的氨基酸序列的保守域预测结果
在系统进化树(图4)上,2个芹菜品种首先聚在一起,并与同科种类细叶糙果芹〔Trachyspermumammi(Linn.) Sprague〕聚在同一小分支中,与同科植物胡萝卜(Daucuscarotavar.sativaHoffm.)聚在同一大分支中,说明同科植物的进化关系较近;而与其他科木本种类,如枣(ZiziphusjujubaMill.)、欧洲栓皮栎(QuercussuberLinn.)、胡桃(JuglansregiaLinn.)和木槿(HibiscussyriacusLinn.)等的进化关系较远。

方框内序列为保守域The sequences in the box are conserved domains; 黑色表示同一位点的氨基酸完全一致,白色表示同一位点的氨基酸不完全一致Black indicates the amino acids at the same site are completely identical, and white indicates the amino acids at the same site are not completely identical.
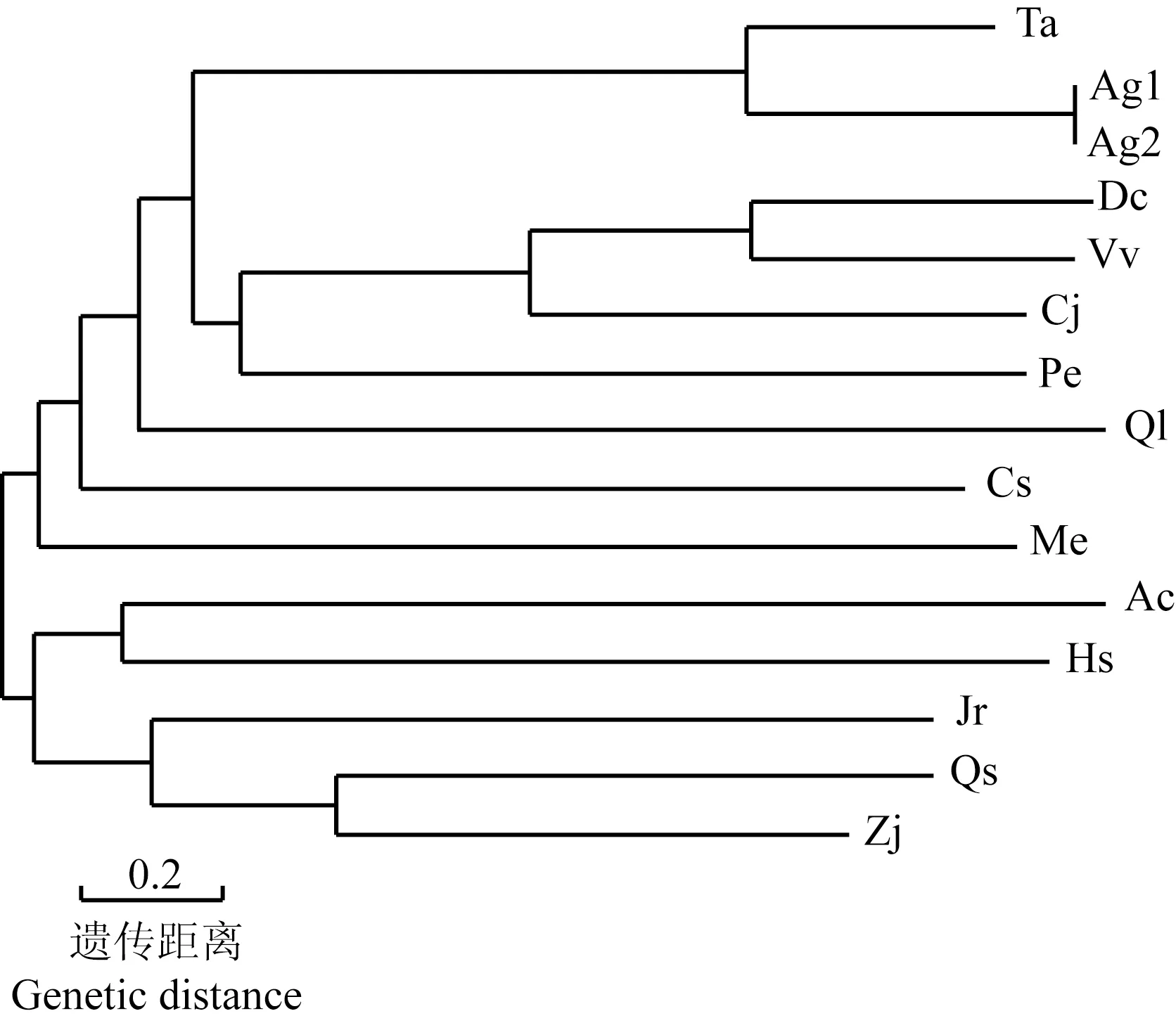
Ac: 中华猕猴桃Actinidia chinensis Planch.; Cs: 茶树Camellia sinensis (Linn.) Kuntze; Vv: 葡萄Vitis vinifera Linn.; Qs: 欧洲栓皮栎Quercus suber Linn.; Ql: 加州白栎Quercus lobata Née; Jr: 胡桃Juglans regia Linn.; Zj: 枣Ziziphus jujuba Mill.; Me: 木薯Manihot esculenta Crantz; Pe: 胡杨Populus euphratica Oliv.; Cj: 金柑Citrus japonica Thunb.; Hs: 木槿Hibiscus syriacus Linn.; Ag1: ‘六合黄心芹’‘Liuhe Huangxinqin’; Ag2: ‘津南实芹’‘Jinnan Shiqin’; Dc: 胡萝卜Daucus carota var. sativa Hoffm.; Ta: 细叶糙果芹Trachyspermum ammi (Linn.) Sprague.
2.2.2 氨基酸组成和理化性质分析 芹菜品种‘六合黄心芹’和‘津南实芹’AgLIMS蛋白的氨基酸组成和理化性质见表1,该蛋白的亲水性和疏水性见图5。
由表1可见:2个芹菜品种的AgLIMS蛋白均由599个氨基酸组成,理论相对分子质量分别为69 120和69 190,理论等电点均为pI 5.52;二者的总平均疏水性略有差异,分别为-0.263和-0.269;2个芹菜品种的AgLIMS蛋白的酸性、碱性、脂肪族和芳香族氨基酸所占比例均相同,表明这2个芹菜品种的AgLIMS蛋白的相似度极高。此外,组成AgLIMS蛋白的氨基酸中,酸性氨基酸与碱性氨基酸的比例相同,均为14%,表明AgLIMS蛋白为中性蛋白。
由图5可见:在AgLIMS蛋白的亲水性区域,第461位的谷氨酸(Glu)的亲水性最强;在该蛋白的疏水性区域,第551位的亮氨酸(Leu)的疏水性最强。组成AgLIMS蛋白的氨基酸中,亲水性氨基酸所占比例为58.3%,疏水性氨基酸所占比例为41.7%,据此推测AgLIMS为亲水性蛋白。
2.2.3 蛋白质二级和三级结构预测结果 对2个芹菜品种‘六合黄心芹’和‘津南实芹’AgLIMS蛋白级结构进行预测,结果显示:在‘六合黄心芹’和‘津南实芹’的AgLIMS蛋白二级结构中,α螺旋分别占65.94%和65.78%,延伸链分别占2.84%和3.17%、β转角分别占3.17%和3.01%,无规则卷曲分别占28.05%和28.05%,2个芹菜品种间差异不明显;总体来说,AgLIMS蛋白二级结构主要由α螺旋和无规则卷曲构成。
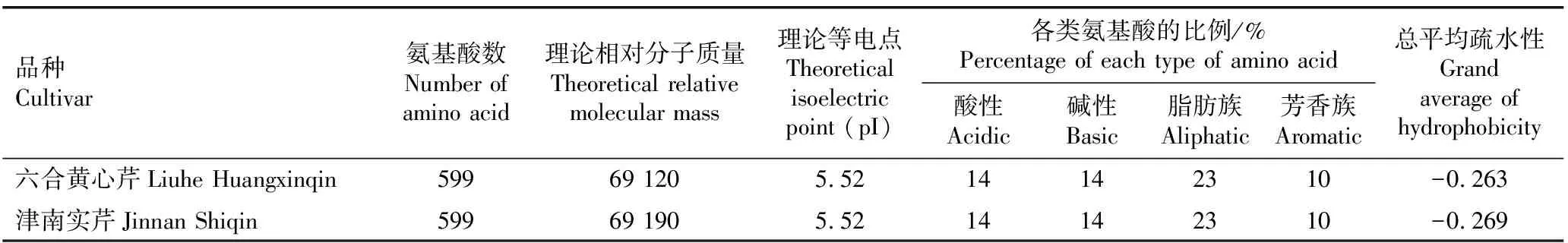
表1 2个芹菜品种AgLIMS蛋白的氨基酸组成和理化性质
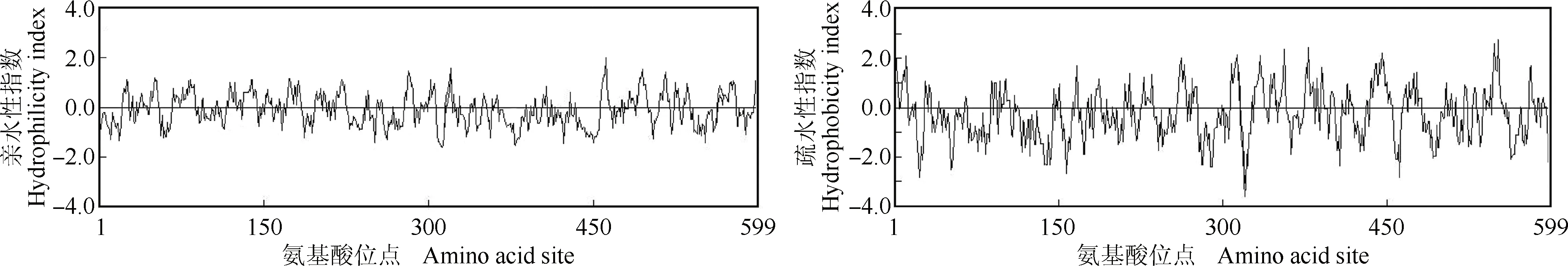
图5 芹菜AgLIMS蛋白的亲水性(A)和疏水性(B)
三级结构模型(图6)显示:‘六合黄心芹’和‘津南实芹’的AgLIMS蛋白三级结构均含有1个β折叠,但2个芹菜品种AgLIMS蛋白三级结构中α螺旋数量有差异,‘六合黄心芹’含25个α螺旋,‘津南实芹’含23个α螺旋。
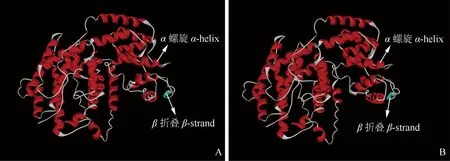
图6 芹菜品种‘六合黄心芹’(A)和‘津南实芹’(B)的AgLIMS蛋白三级结构
2.3 AgLIMS基因表达特性的差异和变化
2.3.1 在不同组织中相对表达量的差异 在芹菜品种‘六合黄心芹’和‘津南实芹’不同组织中AgLIMS基因的相对表达量差异见表2。结果显示:AgLIMS基因在2个芹菜品种叶片、叶柄和根中均有表达,但相对表达量存在显著(P<0.05)差异,均表现为在叶片中最高、在叶柄中次之、在根中最低。在‘六合黄心芹’叶片和根中AgLIMS基因的相对表达量显著高于‘津南实芹’,但在其叶柄中AgLIMS基因的相对表达量与后者无显著差异。
2.3.2 非生物胁迫条件下相对表达量的变化 在非生物胁迫条件下芹菜品种‘六合黄心芹’和‘津南实芹’AgLIMS基因相对表达量的变化见表3。
在高温(38 ℃)条件下处理1~24 h,‘六合黄心芹’和‘津南实芹’AgLIMS基因的相对表达量总体随处理时间的延长呈波动升高的趋势,在处理24 h达到最大值,分别为处理0 h的10.5和8.1倍,且差异显著。
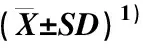
表2 2个芹菜品种不同组织中AgLIMS基因相对表达量的比较
在低温(4 ℃)条件下处理1~24 h,‘六合黄心芹’AgLIMS基因的相对表达量呈小幅波动变化,但总体无显著差异。‘津南实芹’AgLIMS基因的相对表达量则随处理时间的延长呈先升高后降低的变化趋势,总体差异显著;在处理4 h达到最大值(为处理0 h的2.5倍),在处理24 h降至最低(较处理0 h降低51.5%)。
在干旱(质量体积分数20%PEG6000)条件下处理1~24 h,‘六合黄心芹’AgLIMS基因的相对表达量在处理0~4 h内无显著变化,但之后急剧上升,且在处理24 h达到最大值,为处理0 h的16.8倍。‘津南实芹’AgLIMS基因的相对表达量则随处理时间的延长呈波动升高的变化趋势,且与处理0 h差异显著;其中,在处理1~8 h小幅波动,但在处理24 h急剧升高并达到最大值,为处理0 h的30.7倍。
在高盐(0.2 mol·L-1NaCl)条件下处理1~24 h,‘六合黄心芹’AgLIMS基因的相对表达量随处理时间的延长呈先升高后波动降低的变化趋势,其中,在处理1和2 h显著升高,分别为处理0 h的6.9和2.8倍;而在处理4~24 h降低,且与处理0 h无显著差异。‘津南实芹’AgLIMS基因的相对表达量则随处理时间的延长呈波动升高的变化趋势,且与处理0 h差异显著,在处理24 h达到最大值,为处理0 h的14.3倍。
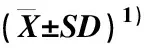
表3 非生物胁迫条件下2个芹菜品种AgLIMS基因相对表达量的变化
3 讨论和结论
柠檬烯合酶基因在植物中普遍存在,但不同植物种类的柠檬烯合酶基因序列差异较大,且功能存在差异。本研究从芹菜品种‘六合黄心芹’和‘津南实芹’中均克隆获得芹菜柠檬烯合酶基因AgLIMS,但2个芹菜品种的AgLIMS基因碱基序列存在2个位点的差异,进而使其编码的氨基酸序列也存在2个位点差异,这种差异可能与栽培地的环境条件差异以及品种间的遗传差异有关,但环境因子对该基因功能的影响尚不清楚,还需进一步深入研究。此外,多重比较和系统进化分析结果显示:同科植物LIMS基因编码的氨基酸序列遗传一致性较高,且在系统树上首先聚在一起,说明同科植物的LIMS蛋白亲缘关系更近,且该基因编码的氨基酸序列具有一定的保守性。
柠檬烯合酶在甜橙〔Citrussinensis(Linn.)Osbeck〕、水稻和薄荷等植物中广泛存在[19-21],且在植物中呈不均衡分布。CitrusunshiuMarc.中柠檬烯合酶基因CitMTSE1在花中特异性表达[22]。本文研究也发现AgLIMS基因在‘六合黄心芹’和‘津南实芹’不同组织中表达存在较大差异,在叶片中的相对表达量显著高于叶柄和根,具有明显的组织特异性。
高温、低温、干旱和高盐等非生物胁迫对芹菜产量和品质均有不同程度的影响[23]。萜类化合物作为植物体内重要的次生代谢产物,能够直接或间接参与植物的防御反应[24]。高温可诱导冬青栎释放大量的单萜[7];干旱处理下,与玉米(ZeamaysLinn.)抗逆性相关的2个倍半萜合酶基因ZmTPS6和ZmTPS8的表达量在玉米品种‘Mo17’中上升,而在品种‘B73’中下调[25];对拟南芥〔Arabidopsisthaliana(Linn.) Heynh.〕中控制合成萜类化合物的直接前体物质法尼基焦磷酸基因进行沉默处理会导致拟南芥非生物胁迫应激反应的调控失常[26]。这些研究结果均表明植物在受到生物与非生物胁迫时会释放单萜和倍半萜等挥发性物质进行间接防御,同时诱导相关基因的表达。在本研究中,对2个芹菜品种进行高温(38 ℃)、低温(4 ℃)、干旱(质量体积分数20%PEG6000)和高盐(0.2 mol·L-1NaCl)胁迫处理,2个芹菜品种的AgLIMS基因均有不同程度的表达,但相对表达量随处理时间延长呈现不同的变化趋势;总体上看,在4种非生物胁迫处理下‘津南实芹’的AgLIMS基因相对表达量不同程度升高;而‘六合黄心芹’的AgLIMS基因相对表达量在高温和干旱胁迫下显著升高,但经低温和高盐处理后变化幅度不大。表明芹菜在受到非生物胁迫时其AgLIMS基因参与对逆境胁迫的生理响应,但该响应效应存在品种间差异[27]。
综合分析结果表明:从芹菜不同品种中均能克隆获得AgLIMS基因,但不同品种间该基因的序列及其编码的氨基酸序列略有差异;该基因与同科植物的LIMS基因具有较高的一致性。AgLIMS基因在芹菜不同组织中均有表达,但在叶片中相对表达量较高;经过高温、低温、干旱和高盐胁迫处理后,AgLIMS基因的表达特性发生变化,但2个芹菜品种AgLIMS基因的表达特性存在差异。表明该基因在芹菜抵御非生物胁迫的过程中发挥重要的调控作用,但AgLIMS基因的表达特性存在组织特异性和品种差异性。
本文通过对芹菜AgLIMS基因的克隆和生物信息学分析及其表达特性的研究,为明确萜类合酶基因在芹菜逆境响应中的作用提供了依据。但植物对非生物胁迫的响应机制相互关联且非常复杂,仅研究其中某个基因无法全面阐述植物响应逆境胁迫的调控途径和代谢机制,因而,后续将扩大芹菜品种数量,针对多个与植物抗逆性相关的基因开展深入研究。
