甘氨酸仿生合成SnO2及其光催化性能的研究*
2020-12-16刘程成王玉锋卞振涛王红艳
刘程成,王玉锋,郭 攀,卞振涛,王 聪,王红艳
(1 宿州学院,安徽 宿州 234000;2 安徽创佳安全环境科技有限公司,安徽 宿州 234000)
目前,工业发展对人类赖以生存和发展的水资源产生了巨大的威胁,有机染料污水是工业污水的重要方面。因此,治理有机染料水体污染是人类绿色发展必须克服的问题[1]。在过去的几十年里,一系列传统金属氧化物,如TiO2、ZnO和SnO2,已经成为光催化降解有机污染物的重要催化剂[2]。SnO2纳米材料是一种宽带隙N型半导体金属氧化物,n型宽带隙半导体材料(Eg=3.6 eV,at 300 ℃),SnO2是一种重要的功能材料在许多领域,如锂离子电池、染料敏感太阳能电池、场效应晶体管、气体传感器,尤其是光催化[3]。现如今有许多制备SnO2纳米材料的方法,汽液固方法,空气中的燃烧化学气相沉积,脉冲激光沉积法,水热和溶剂热合成法,超声化学法,缓慢强制水解法,共沉淀法,固态合成法等[4]。仿生合成是指人为模仿生物有机质调控无机物矿化过程合成方法[5]。氨基酸通过与金属离子之间形成配位作用和静电作用,对纳米材料结晶的早期阶段有多种影响[6]。Lin等[7]报道,采用水热法,以甘氨酸为模板,可控合成了WO3纳米线。本文以甘氨酸为有机模板,以五水四氯化锡晶体为主要原料,采用水热法探讨了甘氨酸对二氧化锡纳米材料形成的影响。
1 实 验
1.1 主要试剂与仪器
本实验所用试剂除亚甲基蓝为指示剂级外,其他试剂均为分析纯。实验所用主要仪器设备为U-3310型紫外可见分光光度计、DX-2600X射线衍射仪(XRD)、ZS90纳米粒度及Zeta电位分析仪。
1.2 二氧化锡纳米材料的制备
本实验是以甘氨酸为模板,以五水合四氯化锡(SnCl4·5H2O)为原料,采用两步法制备二氧化锡纳米材料。具体步骤如下:
1.2.1 二氧化锡前驱体的制备
分别用15 mL去离子水溶解1.05 g SnCl4·5H2O和0.72 g NaOH,然后将氯化锡溶液逐滴加入氢氧化钠溶液中,形成混合溶液。然后将10 mL 200 g/L甘氨酸加入以上混合溶液中。最后将混合溶液在50 mL反应釜中,于电热恒温干燥箱中,在160 ℃的温度反应12 h。将反应得到样品用水和乙醇交替洗涤后,在真空干燥,得到二氧化锡前驱体。控制其他条件不变,仅改变试剂投放种类,做了以下的实验,第1组是氢氧化钠与四氯化锡的反应;第2组是氢氧化钠与甘氨酸的反应;第3组是甘氨酸与四氯化锡的反应。其他条件不变,将氢氧化钠与五水合四氯化锡的质量同时为原来的一倍、两倍和四倍合成二氧化锡前驱体。
1.2.2 二氧化锡纳米材料的制备
将第一步制备的SnO2前驱体用研钵研碎,取适量放入箱式炉中,以5 ℃/min的升温速率从室温上升到350 ℃,并在350 ℃的条件下煅烧2 h,煅烧完成后自然冷却,最后得到SnO2纳米材料。
1.3 光催化实验
根据文献报道方法,进行光催化实验,具体步骤如下:首先,称取50 mg的SnO2纳米材料,取50 mL浓度为0.05 g/L亚甲基蓝溶液放入100 mL烧杯中,将称好的SnO2纳米材料倒入亚甲基蓝溶液中,并放入一个磁子,暗反应30 min达到吸附-脱附平衡。然后在光照下进行光催化反应,每隔30 min取一定量的亚甲基蓝溶液,离心分离出上清液,测量上清液的紫外可见吸收光谱,记下最大峰吸收强度并计算亚甲基蓝的降解率[8]。
2 结果与分析
2.1.1 XRD分析
图1中A为NaOH与SnCl4·5H2O反应产物的XRD, B为甘氨酸与SnCl4·5H2O产物的XRD,C为 NaOH、SnCl4·5H2O与甘氨酸反应制备的二氧化锡前驱体的XRD,D为煅烧后的SnO2纳米材料的XRD。从XRD图谱可以看出,我们用不同的条件所制备出的物质在2θ为26.611°、33.893°、37.949°、51.780°、54.757°、61.870°、64.717°、65.937°都有峰,对比SnO2PDF标准卡(PDF#41-1445)分别为110、101、200、211、220、310、112、301的SnO2晶面衍射峰,与纯二氧化锡的衍射峰基本一致,所以可确认在不同条件下制备的产物为二氧化锡。
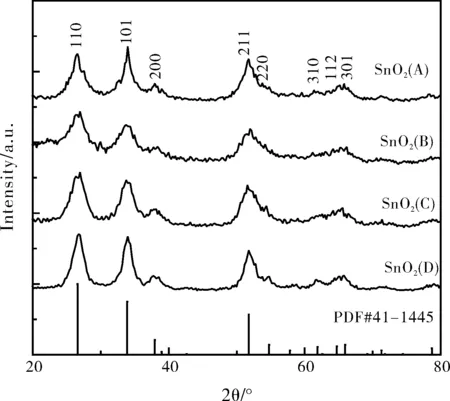
图1 SnO2前驱体及纳米材料 XRD图谱
2.1.2 粒度分析
图2是不同投放原料反应制备的二氧化锡粒度分析图,由图2可知,由NaOH与SnCl4·5H2O反应制备的二氧化锡的粒径是在100~1000 nm之间,粒径分布较大,粒径为171.0 nm到307.6 nm的粒子占79.3%,最小粒径为127.5 nm,最大粒径达到640.7 nm,粒子大小不均匀。由甘氨酸与SnCl4·5H2O反应制备的二氧化锡的粒径在100~1000 nm之间,粒径为229.3 nm到356.2 nm的粒子占90.5%,粒子最小粒径为198.0 nm,粒子的最大粒径达到477.7 nm,粒子尺寸较大。NaOH、SnCl4·5H2O与甘氨酸反应制备的二氧化锡前驱体的粒径尺寸分布在10 nm左右,粒径为9.083 nm到14.11 nm的粒子占84.1%最小粒径为7.843 nm,最大粒径可达到29.39 nm。经过煅烧所得的二氧化锡的粒径在265.6 nm到412.5 nm的粒子占88.3%,粒子最小粒径为229.3 nm,粒子的最大粒径为553.2 nm,我们可以看出煅烧后粒子变大。综上所述,甘氨酸在二氧化锡前驱体制备过程发挥了调节控制的作用,使得二氧化锡的尺寸更小,粒子更均匀。

图2 粒度分析
综合纳米粒度以及XRD分析,我们可以看出,尽管NaOH与SnCl4·5H2O反应以及甘氨酸与SnCl4·5H2O反应都可以得到二氧化锡前驱体,但是粒经不够均匀,尺寸较大,NaOH与SnCl4·5H2O反应后再加入甘氨酸,得到的粒子尺寸小,并且对比纯二氧化锡的PDF标准卡出峰位置也比较一致。由此可见,甘氨酸对二氧化锡纳米材料的尺寸生长有调控作用。所以我们选择甘氨酸仿生方法制备二氧化锡纳米材料。
2.2 不同投放质量实验
2.2.1 XRD分析
图3不同质量原料制备样品的XRD图谱,图3E为NaOH与SnCl4·5H2O为原来质量的一倍, 图3F为NaOH与SnCl4·5H2O为原来质量的两倍,图3G为NaOH与SnCl4·5H2O为原来质量的四倍,图3H为NaOH与SnCl4·5H2O为原来质量的一倍煅烧制备的产物。从图3XRD图谱中可以看出,通过改变NaOH与SnCl4·5H2O的质量原料制备的产物,均为SnO2,结晶度没有明显的变化。NaOH与SnCl4·5H2O为原来质量的一倍制备的样品通过煅烧后结晶度有了明显提高。

图3 不同投放质量制备SnO2 XRD图谱
2.2.2 粒度分析
图4F为NaOH与SnCl4·5H2O为原来质量的两倍制备样品的粒径分析图谱,从粒径分析图谱可以看出SnO2粒子的粒径在100 nm左右,粒径为70.89 nm到127.5 nm的粒子占67.6%,粒子尺寸较大。图4G图为NaOH与SnCl4·5H2O为原来质量的四倍制备样品的粒径分析图谱,图中粒子的尺寸分布在10~100 nm之间,粒径为21.91 nm到34.03 nm的粒子占85.7%,粒子尺寸偏小但是不均匀。总之,一倍质量的氢氧化钠与五水四氯化锡与甘氨酸反应制备的二氧化锡纳米材料尺寸均匀,粒径较小。通过粒径分析结果看出,原料的投入量对二氧化锡纳米材料尺寸有一定的影响。
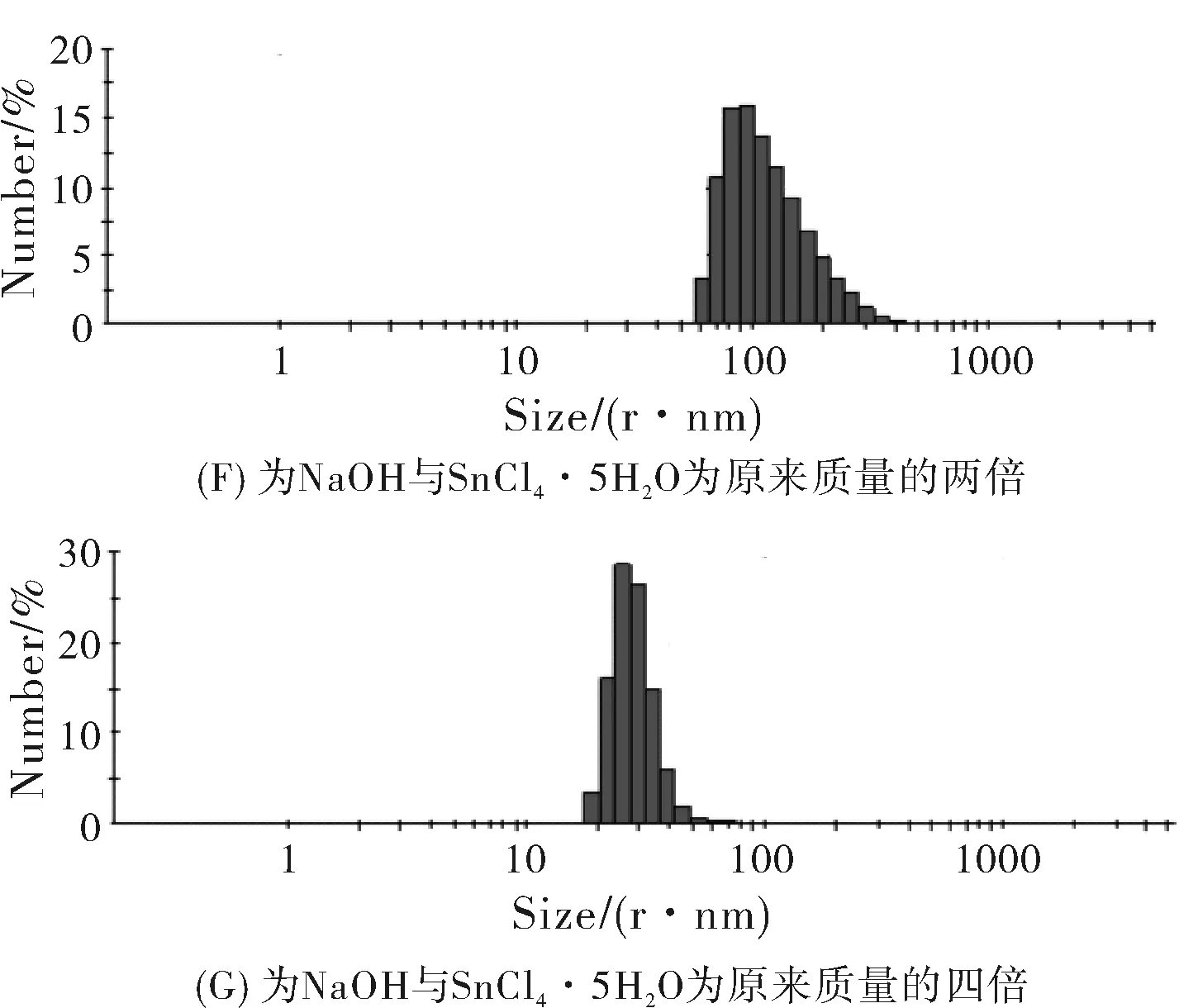
图4 不同质量原料制备样品的粒径分析图谱
2.3 Zate电位分析
从图5可以看出,二氧化锡纳米材料的Zate电位为-31.5 mV。亚甲基蓝是水溶性阳离子染料,SnO2纳米材料表面带负电荷,因此,亚甲基蓝比较容易会被吸附到SnO2纳米材料表面,有利于下一步光催化实验的进行。

图5 煅烧后二氧化锡纳米材料Zate电位分析图
2.4 光催化性能的研究
图6a是SnO2纳米材料降解亚甲基蓝溶液的紫外吸收光谱图,随着时间的延长,亚甲基蓝溶液最大吸光度是不断降低的。由吸收峰的强弱是与亚甲基蓝溶液浓度成正比的,所以我们可以判断,随着时间的推移,亚甲基蓝溶液浓度逐渐降低。图6b是SnO2纳米材料光催化降解亚甲基蓝降解率图,由图6b可以得知当光照180 min后,SnO2纳米材料对亚甲基蓝的降解率达到75.46%。
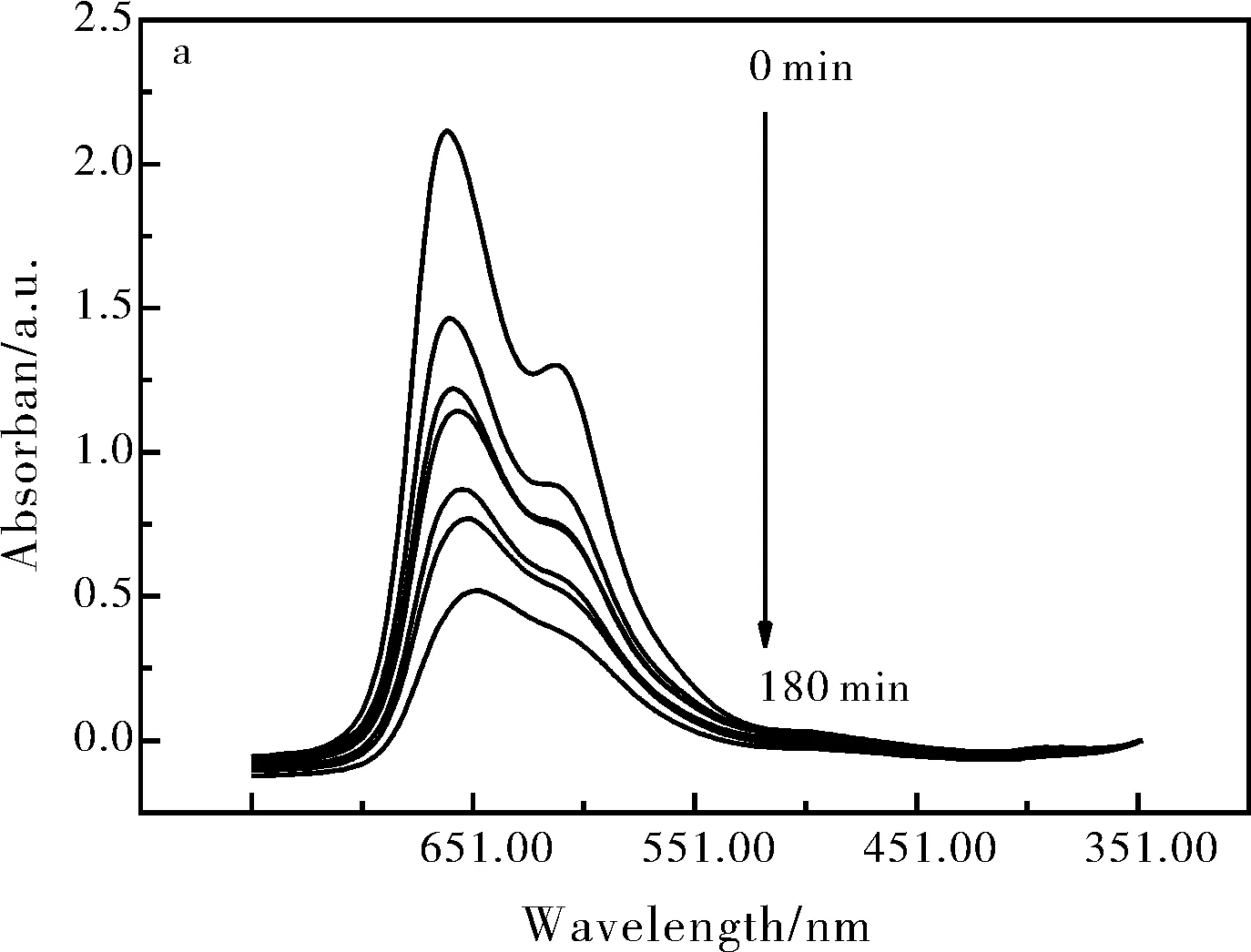
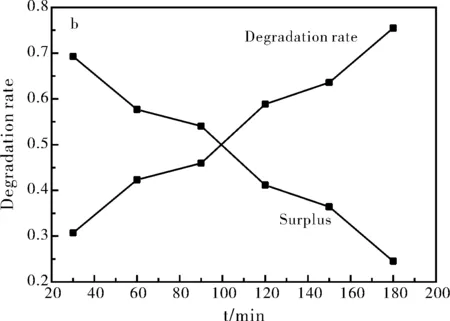
图6 SnO2纳米材料催化降解亚甲基蓝的紫外吸收光谱图(a);SnO2纳米材料对亚甲基蓝的降解率图(b)
3 结 论
本文以甘氨酸为模板,以五水四氯化锡晶体为主要原料,采用水热法仿生合成二氧化锡前驱体,通过箱式炉煅烧得到SnO2纳米材料。通过比较不同投放原料的种类和质量对制备二氧化锡前驱体尺寸的研究,发现甘氨酸在二氧化锡前驱体尺寸有调控作用。在日光下,研究SnO2纳米材料的光催化性能。实验结果表明,50 mg SnO2纳米材料对0.05 g/L的亚甲基蓝溶液进行光催化降解,在180 min时降解率可达到75.46%。
