结构生物学在溶组织内阿米巴致病机制研究中的应用
2020-12-13赵晏庆综述程训佳审校
赵晏庆(综述) 程训佳(审校)
(复旦大学基础医学院病原生物学系 上海 200032)
溶组织内阿米巴(Entamoeba histolytica,Eh)是一种主要寄生在人体肠道的厌氧原虫,可引起严重的阿米巴性结肠炎和肠外脓肿。阿米巴病的严重性在全球寄生原虫病中居第二位,致死率仅次于疟疾。据估计,全世界每年约有5~10 万人死于阿米巴病,5 000 万人出现Eh新感染。Eh感染人体的过程与一系列阿米巴毒力因子蛋白质相关。具有感染性的Eh包囊经口摄入人体,随后通过胃和小肠,在回肠末端或结肠转变为具有致病性的滋养体。滋养体通过细胞表面的半乳糖/乙酰氨基半乳糖可抑制性 凝 集 素(galactose/N-acetyl galactosamineinhibitable lectin,Gal/GalNAc lectin)等物质黏附于宿主肠上皮细胞,随后释放阿米巴穿孔素(amoebapore)和半胱氨酸蛋白酶(cysteine proteases,CP)等毒力因子,通过接触依赖性细胞溶解作用使与之接触的细胞发生坏死或凋亡,亦或通过胞啃作用直接损伤宿主细胞,从而形成烧瓶样的肠道溃疡[1-4]。
结构生物学(structural biology)是一门通过交叉融合生物、化学、物理、数学和计算机等多领域知识来研究生物大分子的结构及其动态变化,进而阐明生命现象的学科,这门学科的出现与发展为药物设计、疫苗开发和蛋白质分子性能改造等应用方向奠定了理论和技术基础[5-6]。结构生物学的起源可以追溯到20 世纪50 年代Waston 和Crick 解析出DNA 双螺旋结构[7]。随着技术的不断发展,结构生物学在核酸和蛋白质结构研究中发挥越来越重要的作用。蛋白质结构坐标数据库(Protein Data Bank,PDB,http://www.rcsb.org/pdb)中收录已解析的蛋白质三维结构数目从1989 年的300 余个增至156 101 个(截至2019 年9 月18 日)。结构生物学技术也已运用到现代生物学和医学研究的各个领域,包括人体寄生虫学研究领域。在人体寄生原虫Eh中,已经解析出150 余种虫体蛋白质的三维结构,为研究阿米巴代谢活动、致病机制以及研发药物和疫苗等提供了重要信息。
结构生物学技术发展概况目前结构生物学的主要研究方法包括X 射线晶体学(X-ray macromolecular crystallography)、核磁共振波谱学(nuclear magnetic resonance spectroscopy)和冷冻电子显微学(cryo-electron microscopy)。
X 射线晶体学 1957 年,英国科学家Kendrew等[8]首次将X 射线晶体学方法运用于蛋白质三维结构的解析,即获得分辨率为6Å 的抹香鲸肌红蛋白晶体结构。之后,Kendrew 等[9]将抹香鲸肌红蛋白晶体结构的分辨率提高到2Å,并获得1962 年诺贝尔化学奖。X 射线晶体学的基本原理是利用X 射线对高纯度蛋白质晶体进行衍射,通过对衍射数据的分析处理来获得近原子分辨率的蛋白质大分子三维结构。经过半个多世纪的理论发展和硬件设备升级,X 射线晶体学已经成为结构生物学研究中最主要的研究手段之一[10-11]。
目前PDB 数据库收录的蛋白质三维结构中有89.1%(139 132 个,截至2019 年9 月18 日)是通过X射线晶体学方法解析得到的。然而,X 射线晶体学的应用仍存在一定的局限,即必须先获得可衍射的蛋白质晶体才能进行结构探测,而在实验室获得蛋白质结晶往往是一个非常耗时且具有挑战性的工作,特别是膜蛋白和超大分子量蛋白质复合物通常难以结晶,往往需要通过诱变和高通量筛选来获得构象稳定的蛋白质样品[5,12-13]。因此,一些重要的蛋白质分子难以通过X 射线晶体学方法获得三维结构信息,需要寻求其他的解决方法。
核磁共振波谱学 20 世纪50 年代,核磁共振技术与X 射线衍射方法几乎同时开始应用于结构生物学研究领域。1957 年,Saunders 等[14]首次成功运用核磁共振波谱学方法解析蛋白质结构即核糖核酸酶的三维结构。多维光谱学、量子计算和高通量核磁共振技术的发展,为核磁共振波谱学提供了理论和技术支撑[15-18]。目前PDB 数据库收录的蛋白质三维结构中有8.1%(12 657 个,截至2019 年9 月18日)是通过核磁共振波谱学方法解析得到的。
核磁共振波谱学通常用于解析溶液中蛋白质的三维结构、动力学特征以及蛋白质间相互作用。与X射线晶体学相比,核磁共振波谱技术解析出的蛋白质结构更接近于生理状态。然而,该技术常用于解析不易结晶的小分子量蛋白质的结构,对于大分子量蛋白质复合体或难溶于水的蛋白质往往不易得到理想的结果。在21 世纪之前,通过核磁共振技术解析结构的蛋白质分子量几乎都不超过25 000。随着技术发展,特别是脉冲序列技术的突破,通过核磁共振解析的最大蛋白质分子量突破1MDa,因此核磁共振波谱学依然具有很好的应用前景[19-20]。
冷冻电子显微学 冷冻电子显微学,又称冷冻电镜技术,是一项从20 世纪70 年代发展起来的新兴技术,现已成功运用于细胞生物学和结构生物学研究。2013 年,由于直接电子相机的应用,冷冻电镜技术成功解析高分辨率膜蛋白三维结构,即分辨率为3.4 Å 的哺乳动物细胞膜蛋白辣椒素受体的三维结构[21]。在此之后,越来越多的膜蛋白和分子量较大的蛋白质及其复合物通过冷冻电镜技术解析出三维结构。目前PDB 数据库收录的蛋白质三维结构中有2.4%(3 755 个,截至2019 年9 月18 日)是通过冷冻电镜技术解析得到的。
冷冻电镜技术的基本原理是将细胞或生物大分子样品快速冷冻,然后利用透射电子显微镜收集冷冻样品的图像,后续通过一系列数据处理方法来重构冷冻样品的三维结构。基本分析方法包括单颗粒三维重构法、电子晶体学方法和电子断层扫描成像技术等,其中单颗粒三维重构法是解析蛋白质分子三维结构最常用的方法。单颗粒三维重构法是根据蛋白质分子的不同取向,将电镜视野中数以百万计的单个蛋白质分子颗粒图像进行分类和平均,提高图像信噪比,从而解析得到高分辨率的蛋白质分子三维结构[22]。在冷冻电镜技术中,蛋白质样品通常无需结晶,只需要很少量蛋白质溶液(如在单颗粒三维重构法中只需3 μL 左右浓度为1~10 μg/μL 的蛋白质溶液)通过快速冷冻即可进行图像收集和处理,可以尽量保持样品的原始状态,得到更有意义的结构分析[23-25]。
结构生物学在Eh 致病机制研究中的应用目前,PDB 数据库中收录的Eh蛋白质三维结构共计156 个,其中有143 个是通过X 射线晶体学方法解析的,另外13 个是通过核磁共振波谱学技术解析的,暂无通过冷冻电镜技术解析的结构。在已解析的Eh蛋白质结构中有39 个是结构蛋白,包括肌动蛋白、肌球蛋白、钙调蛋白等,还有117 个是非结构蛋白,主要是参与阿米巴细胞代谢的各类酶。Eh致病过程相关的重要蛋白质当中,三维结构得到解析的有阿米巴穿孔素A 和半胱氨酸蛋白酶抑制剂。
阿米巴穿孔素A 在Eh几种重要的毒力因子蛋白质中,最先解析出三维结构的是阿米巴穿孔素A。阿米巴穿孔素是一类存在于滋养体细胞质颗粒中的小分子蛋白家族,包括阿米巴穿孔素A、B 和C。当阿米巴滋养体与靶细胞或组织接触时,滋养体可以分泌出阿米巴穿孔素,使得靶细胞表面形成离子通道,破坏靶细胞膜屏障,使靶细胞或组织发生损害[26-27]。早在1982 年,科学家就已经发现阿米巴穿孔素,并对其功能进行研究[28]。1992 年,Leippe等[29]利用阿米巴穿孔素A 的互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA)序列,推导出阿米巴穿孔素A 的氨基酸序列(即一级结构)是由77 个氨基酸残基构成的,其中包括6 个半胱氨酸残基。同年,科学家利用圆二色光谱测定出阿米巴穿孔素的二级结构为全α-螺旋构象。2004年,Hecht 等[27]利用核磁共振波谱学方法解析了阿米巴穿孔素A 的三级结构,证实了此前推测阿米巴穿孔素A 的全α-螺旋构象(图1A),并且通过分子筛色谱、化学修饰和蛋白质交联实验证明了阿米巴穿孔素的激活与pH 依赖的蛋白质二聚化有关。
阿米巴穿孔素是水溶性蛋白质,但同时也可以分散在细胞膜上即具有一定的脂溶性。在阿米巴穿孔素A 的三维结构中观察到该蛋白质的一侧是亲水性的,另一侧是疏水性的,具有两亲性。阿米巴滋养体可以通过调节酸性物质的分泌调控穿孔素的活性。在酸性环境下,阿米巴穿孔素通过静电作用发生二聚化,亲水结构聚集在内侧,疏水结构暴露在外侧,形成整体疏水性的环状结构(图1B、C),使穿孔素可以更好地分布在靶细胞膜上,从而导致靶细胞膜出现寡聚孔。阿米巴穿孔素的二聚体活化机制提示,与阿米巴穿孔素结构类似的可溶性球状蛋白质可能具有破坏细胞膜,从而杀死细菌和真核细胞的作用[27]。
CP 抑制剂 CP 是Eh另一种重要的毒力因子。Eh胞内含有至少50 种CP,其中最主要的是EhCP1、EhCP2 和EhCP5。CP 最初表达为无活性的酶原,其活性由阿米巴精密的调控机制进行调控,其中包含Chagasin 样抑制剂家族的EhCP 抑制剂(Entamoeba histolyticainhibitor forcysteine proteases,EhICP),即EhICP1 和EhICP2[30-33]。2011年,Casados-Vázquez 等[34]利用X 射线衍射技术解析出EhICP2 的晶体结构(图2A)。

图2 EhICP2 的三维晶体结构及其与半胱氨酸蛋白酶相互作用的模型Fig 2 The crystal structure of EhICP2 and its interaction model with a cysteine protease(Papain)
EhICP2 的空间结构由8 条β 链构成的2 个β-折叠片组成,与免疫球蛋白的折叠方式非常相似。EhICP2 中含有致密的疏水核心集团,起到稳定整体结构的作用(图2A、B)。BC、DE 和FG 三个环状结构具有一定的柔性,其功能主要与蛋白质间相互作用有关,其中BC 环中苏氨酸和丝氨酸残基可以与CP 活性中心即催化三联体(His-159,Asn-175 和Cys-25)中的半胱氨酸和组氨酸残基相互作用,从而抑制CP 活性,而DE 和FG 环在EhICP2 结合CP 时可转变构象,起到稳定整体结构的作用(图2C、D)[34]。CP 抑制剂EhICP2 晶体结构的解析,有助于在原子水平上理解Eh中CP 的活性调控机制,为开发抑制虫体CP 药物奠定了基础。
结构生物学在Eh 研究中的发展前景目前在Eh致病过程中起重要作用的Gal/GalNAc 凝集素、CP 和过氧化物氧化还原酶等毒力因子蛋白质的三维结构尚未得到解析[2,35-37],未来对这些毒力因子三维结构的解析可能会成为结构生物学在Eh研究领域的热点。
以EhGal/GalNAc 凝集素为例。研究表明该凝集素包含170 000 重链亚单位(heavy subunit of Gal/GalNAc lectin,hgl)、150 000 中间亚单位(intermediate subunit of Gal/GalNAc lectin,igl)和35/31 kDa 轻链亚单位(light subunit of Gal/GalNAc lectin,lgl),其中hgl是跨膜蛋白,igl和lgl通过糖基磷脂酰肌醇(Glycosyl phosphatidyl inositol,GPI)锚定在细胞膜胞外侧(图3)。已知hgl 由于含有特异性的糖类识别位点(carbohydrate recognition domain,CRD)而具有重要作用,而igl 和lgl 在阿米巴黏附和入侵过程中发挥的作用尚不明确。另外,Gal/GalNAc 凝集素富含半胱氨酸以及由半胱氨酸残基构成的CXXC 或CXC 基序(“C”为半胱氨酸残基,“X”为任意氨基酸残基),研究表明这一特点与滋养体吞噬宿主细胞和导致宿主细胞凋亡相关[38-41]。由于Gal/GalNAc 凝集素的三维结构尚未解析,特别是CXXC 或CXC 基序的结构特点尚不清楚,Gal/GalNAc 凝集素特别是igl 和lgl 两个亚单位在致病过程中所扮演的角色难以从原子水平上进行推测和理解。Eh中Gal/GalNAc 凝集素定位于细胞膜上,属于膜蛋白,不易结晶,难以通过X 射线晶体学方法解析其结构,预计将来可能通过冷冻电镜技术获得其三维结构。在Gal/GalNAc 凝集素中,hgl 和lgl 通过共价键连接形成分子量为260 000 的异源二聚体,再与igl 通过非共价键的方式结合。实验条件下蛋白质间的非共价键不易形成,因此可能需要分别解析hgl-lgl 异源二聚体与igl 的三维结构,再对Gal/GalNAc 凝集素整体的分子结构进行分析。
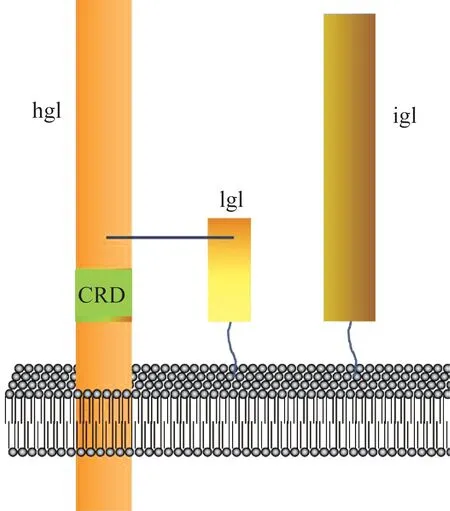
图3 Gal/GalNAc 凝集素结构模型Fig 3 Schematic structural model of Gal/GalNAc lectin
结语在Eh致病机制研究中,结构生物学作为一种新兴的生物学研究方法,已经得到一定程度的应用。近些年,越来越多重要的虫体酶、毒力因子和致病蛋白的三维结构被解析,对于Eh致病机制的理解不断深入,并为抗虫药物和潜在疫苗的研发提供了必要条件。但目前Eh中还有很多重要蛋白质的三维结构尚待研究,如与阿米巴对宿主组织和细胞黏附相关的Gal/GalNAc 凝集素等。另一方面,冷冻电镜技术尚未在Eh研究领域得到成功的运用。随着技术的进步,特别是冷冻电镜技术的发展,结构生物学方法将更加深入地运用到Eh致病机制的研究当中。
