外源脱落酸对干旱胁迫下杨树生长和生理特性的影响
2020-12-11方景涛罗志力毕凌聆毕凌凤冯宇虹
方景涛,敬 辽,罗志力,毕凌聆,毕凌凤,冯宇虹,陈 刚*
(1.四川农业大学 林学院,四川 成都 611130; 2.四川省林业和草原调查规划院,四川 成都 610081)
近年来,随着全球气候变暖等环境问题的不断加剧,加上降水的季节性和区域分布极度不均等情况,水资源短缺已逐渐成为全世界面临的生态挑战。目前,我国干旱形势异常严峻,有超过全国1/3面积的土地处于不同程度的干旱状态[1]。干旱严重影响植物生长和发育,其危害程度在各种自然逆境中占居首位,它对林木不仅造成植株形态矮小、生长减缓,还会导致叶片发黄脱落,造成抗氧化酶活性、渗透调节等一系列生理指标的变化影响植株的正常生理代谢[2-3]。为了抵御和适应水分缺少的环境,植物演化出了一系列复杂的调控机制。长期以来的研究发现,植物内源激素脱落酸(Abscisic acid, ABA)与植物抗旱调控有密切联系[4-5],而且,干旱胁迫下,内源激素ABA显著升高,通过与其他植物激素相互作用,植物适应干旱的能力显著提高[6]。
ABA能通过调节一系列生理过程来提高植物抗旱性。首先,植株在干旱的胁迫下,诱导产生大量的活性氧,会破坏体内的抗氧化防御体系,此体系是由体内的抗氧化物质和清除活性氧的酶系统构成[3]。其次,可溶性糖和可溶性蛋白的积累可以提升植物细胞膜的弹性,增加细胞的粘性,能够阻止细胞脱水,可以有效地避免对细胞造成的机械损伤[7]。处于干旱胁迫中的植物内源ABA含量会增加,因而,干旱胁迫时外源ABA是否/如何引起植物的响应,也得到了越来越多研究者的关注。
目前,关于外源施加ABA缓解植物遭受干旱胁迫时生理响应的相关研究已有一些报道,如,猕猴桃[8]、玉米[9]、大豆[10]和苹果[11],但这些研究多集中在农作物和经济林木类中,对速生用材树种的研究还鲜见报道。在长期干旱状态下(土壤含水量一直保持在某一特定干旱水平),外源长期施加50 μM ABA显著抑制了青杨(PopuluscathayanaRehder)和康定杨(P.kangdingensisC. Wang et Tung)的光合作用和地上部分生长[12],但在长期自然干旱条件下(土壤含水量随干旱时长增加而不断降低),外源ABA对杨树抗旱生理的影响还未见报道。因此,本研究拟通过对杨树施加一系列质量浓度的外源ABA,测定杨树在模拟自然干旱条件下的形态及生理响应差异,探讨ABA对杨树耐受干旱的生理机制,为林木抗旱能力和造林效率的提升提供实践依据和理论参考。
1 材料和方法
1.1 试验地概况
本试验在四川农业大学(成都校区)教学科研试验基地(103°51′E,30°42′N)完成,多年平均气温16.8 ℃,月平均最高温25.9 ℃(7月),月平均最低温6.9 ℃(12月),年均日照时数840.2 h,极端低温38 ℃(7月),极端低温-2 ℃(1月)。年均降雨量759.1—1 155.0 mm,空气平均相对湿度84%,海拔530 m,属于亚热带湿润季风气候。
1.2 试验材料
本试验采用的北京杨(Populus×beijingensis)是一种适应性强、生长量大、抗逆性强、繁殖容易的速生用材树种,由四川农业大学森林培育重点实验室提供。在2020年2月16日于崇州试验基地采集粗细均匀的1 cm杨树营养枝,剪成15 cm插枝,10枝扎1捆放在盆中用自来水缓苗7 d。杨树叶片打开后,于4月21日,改为用沙土培养,为提高扦插成活率,用生根粉稀释为糊剂催根,插穗下端浸蘸半小时晾至半干后扦插。试验用土取自成都温江,为农田土,风干,过1 cm筛后装入规格8 cm6 cm的黑色塑料盆,每盆7.5 kg土壤,扦插时1盆1枝。5月11日,杨树插穗发展出完整根系后,选取长势一致且健康的枝条移栽至16 cm14 cm大盆土壤中。移植后的杨树苗放置于温室大棚内生长,培养至植株约0.3 m高后开始试验处理。
1.3 试验设计
试验共分为4个处理组(每组15盆,共60盆;其中9盆用于叶片生理指标采样,剩下6盆用于测定植物地径和株高的生长),质量浓度分别为0(CK),10(L),50(M)和100(H)mg/L的ABA溶液,每个处理15株。2020年6月10日起,每隔3 d于18:00左右对每株北京杨幼苗喷施ABA溶液10 mL,对照喷洒等量的蒸馏水,使叶片布满水珠且不脱落,共计喷施4次。待喷施完4次ABA处理液后,将杨树幼苗浇充足水,之后停止浇水,使其逐渐自然干旱,在第0,5和10天时,测定杨树生理指标。同时,每隔1 d天用HH2土壤湿度分析仪(DELTA-T MI2x,GBR)测定土壤含水量。对于杨树形态指标,在脱落酸处理前,脱落酸处理后(干旱第0天)及干旱处理后(干旱第10天)进行测定。
1.4 指标测定
形态指标测定:对用于形态指标测定的各处理的6株植物,用游标卡测定自扦插枝长出幼苗的第一片杨树叶处的直径作为地径;用直尺测定第一片杨树叶到植株顶端的高度作为株高。将各时间点用于生理指标测定的杨树幼苗根剪断,洗净并于50 ℃烘箱中烘72 h至恒重后称量,用于根生物量的测定。
生理指标测定:在各采样时间点,每个处理组随机选取3个采样植株,采集第3—5片杨树叶。叶片含水量采用相对含水量的方式测定[13];丙二醛(MDA)和可溶性糖采用硫代巴比妥酸法测定[14];过氧化氢酶(CAT),过氧化物酶(POD), 超氧化物歧化酶(SOD),可溶性蛋白和过氧化氢含量的测定均使用南京建成生物有限公司提供的试剂盒。
1.5 数据分析及处理
试验数据采用SPSS 26.0软件进行统计分析,图表采用Excel 2016绘制。分析前,数据进行方差齐性和正态分布检验。采用重复测量方差分析(repeated measurement ANOVA, RM ANOVA)对单个指标在不同处理不同时间点的差异性进行显著性分析。采用单因素方差分析(One-way ANOVA)对单个指标在不同处理同一时间点的差异性进行显著性分析,并利用LSD法进行多重比较。
2 结果与分析
2.1 外源ABA对干旱胁迫下土壤和杨树叶片含水量的影响
土壤含水量随着干旱时间的增加而显著降低(P<0.05)(见图1-A),并且其降低的程度并不受ABA质量浓度的影响(P>0.05)。虽然,总体上各处理间的土壤含水量存在显著差异(P<0.05),但对各个干旱时间点下各处理间土壤含水量的比较结果表明均不存在显著差异(P>0.05)。叶片相对含水量随着干旱时间的持续而显著下降(P<0.05)(见图1-B),但外源ABA总体上增加了杨树叶片的相对含水量(P<0.05),比如持续干旱10 d后的高H处理(P<0.05),并且ABA对叶片含水量增加的趋势并不受干旱时间的影响(P<0.05)。
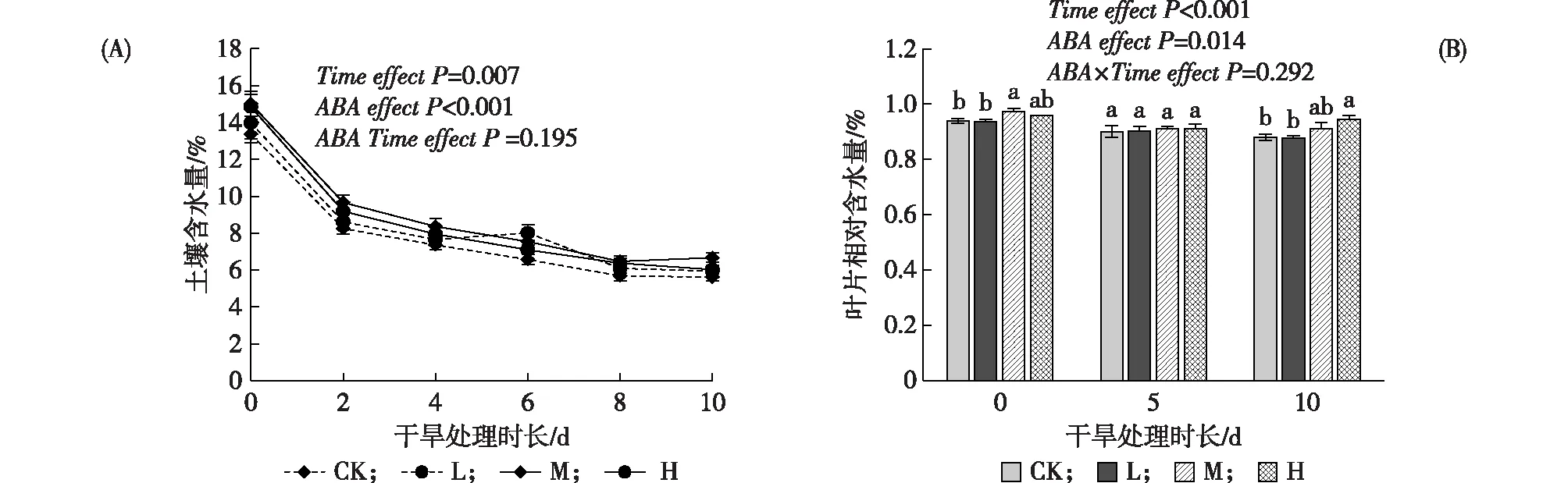
注:图中斜体文字表示重复测量方差分析中的时间效应、ABA添加效应及其交互效应;数据为平均值±标准误;同一取样时间不同小写字母表示处理间在0.05水平存在显著性差异(单因素方差分析,LSD多重比较)。图1 干旱胁迫下不同质量浓度ABA处理的土壤和杨树叶片含水量
2.2 外源ABA对干旱胁迫下杨树形态生长的影响
杨树的地径增长量具有明显的时间变化,在喷施ABA期间(Ⅰ,共12 d),地径增长较快;但在干旱胁迫期间(共10 d),地径基本停止生长,对于CK和H处理,甚至出现抑制的现象(见图2-A)。外源ABA对杨树地径的生长影响不显著(P>0.05),并且在干旱处理前后的效果无显著差别(P>0.05)。与地径类似,杨树的株高在ABA处理期间生长较快,而在干旱胁迫期间较慢;ABA处理对杨树株高增长量产生了显著影响,特别是L和M处理显著高于CK(P<0.05)(见图2-B)。对于地下生物量来说,杨树的根生物量在干旱处理的前5 d生长较快,而在接下来的5 d(干旱第5—10天)中根生长基本处于停滞甚至还有减少的现象;总体上,ABA处理对杨树地下部分应对干旱胁迫并无显著影响(P>0.05)(见图2-C)。

注:I:ABA喷施后到干旱处理前(6月10—22日);II:ABA喷施后到干旱处理结束(6月10日—7月2日)。图中斜体文字表示重复测量方差分析中的时间效应、ABA添加效应及其交互效应;数据为平均值±标准误;同一取样时间不同小写字母表示处理间在0.05水平存在显著性差异(单因素方差分析,LSD多重比较)。图2 干旱胁迫下不同质量浓度ABA处理的杨树地径增长量、株高增长量和根生物量
2.3 外源ABA对干旱胁迫下杨树活性氧清除系统的影响
随着干旱的时间持续增加,杨树叶片的过氧化氢酶、过氧化物酶和超氧化物歧化酶活性均表现出显著下降的趋势(P<0.05)(见图3)。过氧化氢酶和过氧化物酶活性总体上没有明显地受到外源ABA处理的影响(P>0.05),但超氧化物歧化酶的活性显著升高(P<0.05),特别是在干旱10 d后的中质量浓度和高质量浓度ABA处理杨树叶片。

注:图中斜体文字表示重复测量方差分析中的时间效应、ABA添加效应及其交互效应;数据为平均值±标准误;同一取样时间不同小写字母表示处理间在0.05水平存在显著性差异(单因素方差分析,LSD多重比较)。图3 干旱胁迫下不同质量浓度ABA处理的杨树叶片过氧化氢酶、过氧化物酶和超氧化物歧化酶活性
2.4 外源ABA对干旱胁迫下杨树活性氧伤害的影响
杨树叶片过氧化氢的含量整体上在整个干旱胁迫期间没有显著变化(P>0.05)(见图4-A),但外源ABA对其产生了显著的影响(P<0.05),不过对不同干旱胁迫时间点的进一步分析发现,与对照相比,ABA处理的杨树叶片过氧化氢含量变化并不明显(P>0.05)。丙二醛的含量随着干旱胁迫时间的持续表现出明显的上升趋势(P<0.05)(见图4-B),但ABA处理并未显著影响其含量(P>0.05)。

注:图中斜体文字表示重复测量方差分析中的时间效应、ABA添加效应及其交互效应;数据为平均值±标准误;同一取样时间不同小写字母表示处理间在0.05水平存在显著性差异(单因素方差分析,LSD多重比较)。图4 干旱胁迫下不同质量浓度ABA处理的杨树叶片过氧化氢和丙二醛的含量
2.5 外源ABA对干旱胁迫下杨树渗透调节物质的影响
随着干旱胁迫时间的持续增加,杨树叶片可溶性糖含量无显著变化(P>0.05)(见图5-A),但ABA处理整体上降低了其含量(P<0.05),特别是干旱胁迫第5天时的M处理。与可溶性糖含量不完全相同,杨树叶片可溶性蛋白的含量随干旱胁迫时间的持续增加而升高(P<0.05)(见图5-B)。ABA处理显著影响了可溶性蛋白的含量(P<0.05),但ABA的效果与干旱胁迫的持续时间有关(P<0.05),比如,M和H处理的可溶性蛋白的含量与CK相比,在干旱处理的当天和第5天均明无显差异,但在第10天则显著更低。
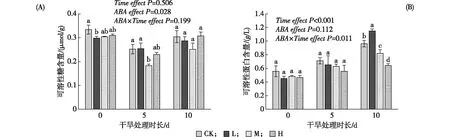
注:图中斜体文字表示重复测量方差分析中的时间效应、ABA添加效应及其交互效应;数据为平均值±标准误;同一取样时间不同小写字母表示处理间在0.05水平存在显著性差异(单因素方差分析,LSD多重比较)。图5 干旱胁迫下不同质量浓度ABA处理的杨树叶片可溶性糖和可溶性蛋白含量
3 讨论与结论
非生物胁迫(包括干旱、高温和盐等)会严重影响植物体内的活性氧的产生和抗氧化防御机制的平衡,最终会引起细胞内活性氧水平的上升。当水平较低时,活性氧可以充当激发逆境胁迫通路相关的激发因子,但是过量时,活性氧对植物造成严重伤害,比如,损害细胞膜、蛋白质和DNA,其中最典型的便是使细胞膜过氧化进而产生丙二醛[15]。过去的研究表明,植物进化出了高效的活性氧清除系统(包括酶促反应与非酶促清除系统)来应对其对植物的伤害[16]。活性氧清除系统可以反映植物在应对干旱胁迫时的调节能力。植物激素脱落酸(ABA)信号通路早已被证实能够调控干旱胁迫[4]。因此,本研究通过测定不同质量浓度ABA处理下,杨树应对干旱胁迫过程中所产生的氧化源、活性氧清除系统以及氧化产物等一系列生理指标,探究外源ABA能否缓解干旱对杨树的胁迫反应。
本研究中,随着干旱时长的持续增加,杨树叶片中的H2O2含量并没有明显变化,活性氧清除系统的酶活性反而有一定程度的下降,并且膜质过氧化产物丙二醛也无明显变化。通常情况下,木本植物在受到5—10 d的自然干旱时,其活性氧浓度和活性氧清除酶系统均会显著升高,比如楠木(Phoebezhennan)中的H2O2含量及过氧化氢酶、过氧化物酶和超氧化物歧化酶活性[13]。本研究中,随着干旱的持续,土壤含水量持续下降,叶片相对含水量也显著下降,这表明杨树的确受到了干旱胁迫。有两个可能的原因来解释杨树活性氧和抗氧化酶促系统未受影响,一是试验所使用的杨树品种北京杨具有较强的抗旱性,在10 d的干旱胁迫中并未对其细胞造成严重生理伤害;二是非酶促活性氧清除系统,包括抗坏血酸、还原型谷胱甘肽、甘露醇和类黄酮等抗氧化物已经将活性氧类清除[17],酶促反应未被激活。本研究中,中高质量浓度ABA处理下的杨树叶片超氧化物歧化酶活性在干旱第10天显著高于对照,而在干旱初期第5天时并无显著差异,这表明,ABA的确能在高度干旱条件下提升植物对活性氧的清除能力。在棉花(Gossypiumhirsutum)中,GhWRKY6-like基因的过表达能激发内源ABA含量并且能显著提高活性氧清除能力[18]。但关于外源ABA的施用能否提高植物,特别是林木,的活性氧清除能力还鲜见报道。
渗透调节主要通过2种方法来影响植物应对干旱胁迫:第一,在干旱胁迫下,水势减小了,植物吸收水分的能力就提高了。第二,调节植物膜系统之间的渗透平衡并保持低叶片水势下功能蛋白的分子构象[19]。另外,很多的研究表明,像可溶性糖和可溶性蛋白等物质是植物应对水分缺乏时最要的物质之一[20-22]。在本试验中,可溶性糖含量并未随干旱时长的增而变化,这与前面提到的酶促活性氧清除系统相似;但可溶性蛋白的含量随干旱胁迫时长的加剧而显著升高。干旱胁迫下可溶性蛋白含量升高这一结果与桢楠和橄榄应对干旱胁迫时一致[13,23]。但是,令人感到意外的是,虽然外源喷施低质量浓度的ABA提高了可溶性蛋白的含量,但中高质量浓度ABA显著降低了可溶性蛋白的含量,特别是在比较严重干旱的第10天时。以前的研究结果表明,在培养基中添加ABA都会增加禾本科植物的渗透调节物质的含量,比如小麦(Triticumaestivum)中可溶性糖和脯氨酸[24]。本研究中杨树叶片可溶性糖含量在高质量浓度ABA处理后下降可能是因为喷施ABA到杨树叶片后,叶片气孔关闭更加迅速,相对于未施或者施加低量ABA的叶片,应对干旱胁迫时,施加较高质量浓度的ABA的叶片散失水分更少,植物的渗透调节作用不强烈。这也可以从叶片相对含水量可以看出,在极度干旱处理的第10天,高质量浓度ABA处理的杨树叶相对含水量显著高于对照。当然,气孔的关闭也会严重影响植物光合作用,最终影响其营养生长。本试验中发现高质量浓度ABA处理下的杨树株高生长量显著比低中质量浓度处理的杨树低,这有可能与气孔关闭导致的光合作用下降有关。因此,本研究表明,低质量浓度的ABA可以通过调节渗透调节物质可溶性蛋白含量提高杨树对干旱的抗性,而高质量浓度的ABA可能会因为叶片气孔关闭等原因导致营养生长受到影响。
本研究表明,在干旱胁迫下,ABA处理后的杨树地上部分株高增长量增加了,这与以前的研究结果外源喷施ABA能够抑制干旱条件下青杨(P.cathayana)和康定杨(P.kangdingensis)的株高和生物量等生长指标不一致[12]。出现这一差异的原因可能有:第一,杨树的品种不一样,因为,他们的试验结果也表明这2种杨树生长受ABA抑制的程度存在显著差异,比如,康定杨比青杨更加敏感[12]。第二,可能与干旱处理的方式有关,本试验中采用自然干旱的方式,在干旱的第10天,土壤含水量只有6%左右,但他们的干旱处理采用固定土壤含水量为10.1%[12]。本试验中逐渐增加干旱程度的干旱方式,可能让杨树对ABA诱导的干旱适应能力有所提升,同时,更加严重的干旱条件可能对杨树的抗旱能力提升更加明显。
综上所述,在干旱的胁迫下,低中质量浓度的外源ABA增加了杨树地上部分株高生长量的积累,表明杨树的抗干旱能力得到了提高。干旱胁迫下的活性氧含量和膜质过氧化物没有明显的变化,这可能与中质量浓度ABA处理下超氧化物岐化酶的活性有关,特别是在干旱较为严重时。总之,本试验中所采用的北京杨,可能本身具有较强抗旱性,在应对较严峻的干旱胁迫时,低中质量浓度的ABA能通过活性氧清除系统消除其受到的一定活性氧伤害,同时提高杨树可溶性蛋白等渗透调节物质含量,增强了杨树对干旱胁迫的抵抗能力,保证了地上部分,特别是株高的生长。关于外源ABA对杨树气孔和非酶促活性氧清除系统的影响有待进一步深入研究。
