环境样品氨基甲酸酯类农药的分离和检测技术研究进展①
2020-12-10尹晓明李学林
尹晓明,李学林
环境样品氨基甲酸酯类农药的分离和检测技术研究进展①
尹晓明,李学林*
(南京农业大学资源与环境科学学院,南京 210095)
氨基甲酸酯类农药是一类高效广谱型杀虫剂,近年来在农业生产中被广泛使用,然而由此带来的环境污染和食品健康问题也日益引起关注。无论是样品的前处理方法还是仪器检测方法都有待不断地完善和发展,因此,开发理想的样品前处理方法和更加有效的仪器分析方法成为该领域的研究热点。本文在查阅了近年国内外相关文献 60 篇的基础上,就环境样品氨基甲酸酯类农药的分离提取方法以及不同方法的优缺点作分析,同时对氨基甲酸酯类农药的仪器分析方法及其发展趋势作总结,以期为环境样品氨基甲酸酯类农药的分析技术研究提供有益的参考。
氨基甲酸酯;农药;分析技术
随着农药使用范围和使用量的不断增加,农药残留在土壤中积累,最后通过食物链进入人体,危害人身健康[1]。据统计,农田施用的农药量只有约30% 被农作物利用,其余部分扩散到土壤和大气中,造成严重的农药污染问题[2]。氨基甲酸酯类农药是一类具有广谱生物活性的杀虫剂,它具有分解快、残留期短、生物积累低等特性,通过抑制昆虫神经传导物质乙酰胆碱酯酶的活性达到杀虫目的[3-4]。近年来,该类农药的使用日益普遍,然而人们对它们的化学结构与性质、代谢过程及其代谢产物的种类等还不甚了解,对其在生态环境中的迁移带来的环境和健康问题仍有必要做深入的研究。鉴于此,寻找理想的色谱分析条件和更加有效的仪器分析方法显得尤为重要。本文在查阅了近年国内外文献 60篇的基础上,就环境样品中氨基甲酸酯类农药样品的前处理方法、仪器测定方法以及不同方法的优缺点做一综述,以期为相关领域的研究与技术服务提供有益的参考。
1 样品的分离方法
农药分析的步骤一般包括样品的准备(农药的提取和清洗)、待测物的分离和检测、数据处理等过程。农药的提取方法根据所用分离(提取)物质理化性质的不同一般分为液液萃取和固相萃取两大类。液液萃取是根据有机物在水相和有机相中的分散系数不同而分离的方法,固相萃取是由于填充在固相萃取柱的吸附材料(吸附剂)对不同电荷、不同极性的有机物附着能力的不同而实现分离。以下就环境样品氨基甲酸酯类农药的提取方法以及不同方法的优缺点做归纳和比较。
1.1 液液萃取
1.1.1 液液萃取(liquid-liquid extraction, LLE) 一般来说,LLE方法常用的有机相有二氯甲烷/丙酮、乙腈、乙酸乙酯/环己烷、己烷[5]。Farajzadeh 等[6]用LLE方法分离果汁、井水和河水中的农药,气相色谱-火焰光度检测器(GC-FID)测定结果表明,方法的检测限 LOD 介于 0.34 ~ 5 μg/L,决定系数2介于 0.993 ~ 0.999,相对标准偏差 RSD<7%。LLE 在过去十几年一直作为实验室常规有机分析采用的方法,然而该方法的明显不足在于比较耗时,试剂用量也多,其中有些毒性试剂对人体和环境有潜在的危险。
1.1.2 分散液液微萃取(dispersive liquid-liquid microextraction, DLLME) 为了减少有毒试剂的使用量,传统的LLE 方法正逐渐被DLLME 方法取代。DLLME是一种小型化的LLE方法,是目前分离环境样品有机污染物的一种常见方法,该方法最初由Rezaee等[7]于 2006 年开发,这种方法把微量(μl)的有机溶剂与水相中少量(ml)的分散剂快速注入样品产生高速的湍流和小液滴并形成一种雾状溶液,从而提高了样品水相与萃取相的接触面,缩短了平衡时间,提高了分离效率[8]。Liu 等[9]用DLLME方法分离环境水样,利用高效液相色谱-二级阵列检测器(diode array detector, HPLC-DAD) 测定了其中5 种氨基甲酸酯(表1),浓度范围在5 ~ 1 000 ng/ml,检测限LODs为 0.1 ~ 0.5 ng/ml。Khodadoust 和 Hadjmohammadi[10]报道了一种快速简单测定水样N-甲基氨基甲酸酯类农药(N-methylcarbamates, NMCs)的方法(表1),样品首先通过DLLME方法分离,再用化学计量法(chemometrics)得到各组分的含量,他们利用27-4PB(Plackett–Burman)实验方法研究了吸附剂(氯仿)、分散剂 (乙腈)、pH、离子强度、萃取时间、离心时间和离心力大小对测定结果的影响。试验结果表明:理想的试验条件为126 μl 氯仿+1.5 ml 乙腈萃取1 min,4 000 r/min离心10 min,pH中性,4.7 g/ml (/) NaCl;液相色谱条件为乙腈:水=50:50 (/)流动相,流速1.0 ml/min。方法的线性范围在0.001 ~ 10 μg/ml,LODs为0.000 1~ 0.000 5 μg/ml,相对标准偏差RSDs 介于2.18% ~ 5.06% (= 6)。
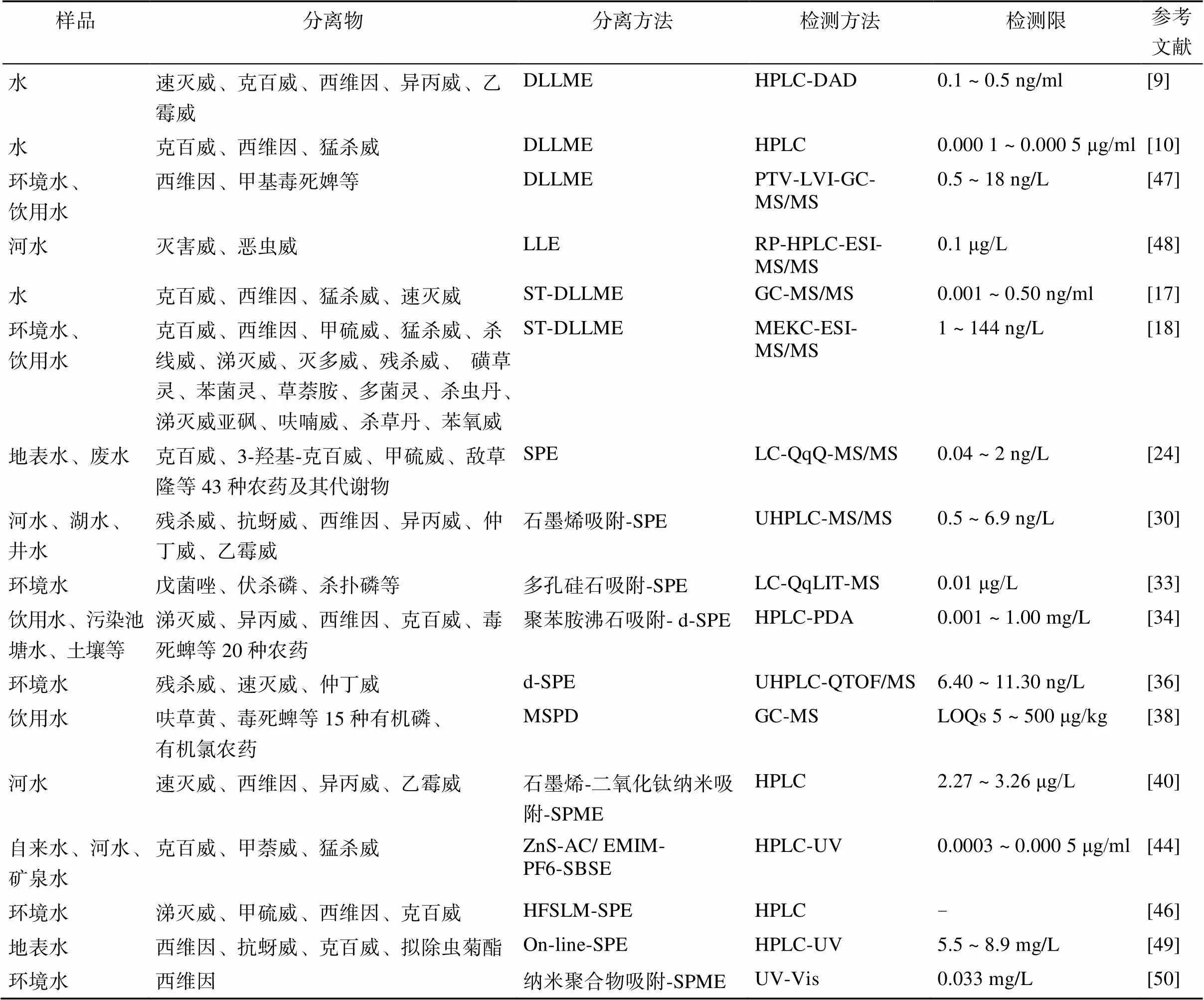
表1 常见环境样品氨基甲酸酯类农药的提取与测定方法
DLLME方法由于样品用量和试剂消耗都较少,因而减小了对环境的负面影响。然而使用DLLME方法首先要确定适宜的萃取剂和分散剂,一般来说萃取剂应不溶于水、与待测物有较高的亲和性并能够形成雾状溶液,还应与仪器的分析方法相匹配。常见的萃取剂有四氯化碳(carbon tetrachloride)[11]、氯仿(chloroform)[12]、氯苯(chlorobenzene)[13]、二氯甲烷(dichloromethane)[14]及四氯乙烯(tetrachloroethylene)[15]等。非极性氯化物作为常用的萃取剂不仅有一定毒性,而且会限制其他许多极性物质的分离。为了减少毒性有机物的使用,离子液体、表面活性剂以及密度小于水的醇类(辛醇、葵醇等)成为一种不错的选择。此外,分散剂的用量也是影响萃取效果的重要因素,一般以分散剂和水相的体积能够形成雾状溶液为适宜,甲醇、丙酮和乙腈都是常用的分散剂[16],农药残留分析推荐使用的分散剂体积在7.8 ~ 2 000 ml。此外,借助超声和涡旋等辅助手段可以提高DLLME方法的萃取效率,减少有毒试剂的使用,但是DLLME方法只适用于液体样品的分离,由于萃取剂种类和特性(多为有毒的氯化物、密度大于水)的限制阻碍了此方法的进一步普及。
为了扩大DLLME方法的使用范围,学者们开始探索使用低密度有机溶剂替代常见的萃取剂。Chen 等[17]开发了一种基于低密度萃取剂的终端分散液液微萃取方法(low-density extraction solvent-based solvent terminated dispersive liquid-liquid microextraction, ST-DLLME),此方法是在水相加入乙腈作为反乳化剂使分散的样品乳状液快速地分为两相,因此免去了离心步骤,他们借助此方法分离了水样中4种氨基甲酸酯(表1),气相色谱-串联质谱(gas chromatography-tandem mass spectrometry, GC-MS/ MS) 的测定结果表明,4种氨基甲酸酯类农药的LODs 都为0.001 ~ 0.50 ng/ml,精密度介于2.3% ~ 6.8% (RSDs,2 ng/ml,= 5),实际水样加标回收率为94.5% ~ 104%,表明ST-DLLME是一种专一性好、简单快速的分离水样中氨基甲酸酯的方法。Moreno-González 等[18]用ST-DLLME方法分离了环境水和饮用水中17 种甲基氨基甲酸酯(表1),利用胶束电动色谱串联质谱法(micellar electrokinetic chromatography tandem mass spectrometry, MEKC- ESI-MS/MS),多级反应模式离子阱质谱为分析器,在优化的实验条件下,待测样品的回收率为83% ~ 101%,RSDs <8%,LODs 介于1 ~ 144 ng/L,是一种高效快速、环境友好型的分析方法。Guo 和 Lee[19]利用软塑料巴氏吸管作为萃取管,把密度小于水的溶剂通过针头注入样品溶液,通过超声形成乳状物,后者通过离心分为两相,上层的有机相与三甲基苯基氢氧化铵(trimethylphenylammonium hydroxide) 化合后经过柱后衍生分析测定,这种低密度超声辅助乳化微萃取方法(lower-density-solvent for ultrasound- assisted emulsification microextraction)对河水样品的6 种氨基甲酸酯类农药的分离测定表明,该方法操作简便、分离效率高,GC-MS 检测的LODs 介于0.01 ~ 0.1 g/L,线性范围为0.05 ~ 50 g/L 及 0.5 ~ 100 g/L,RSDs < 9.2%(= 5)。
1.1.3 其他液液微萃取方法 随着技术的进步,利用可再生的、无毒绿色的溶剂分离环境样品农药残留应该是今后努力的方向。离子液体(ionic liquids, ILs)是一类存在于液相中的低熔点盐,它具有不易燃不挥发性和高热稳定性的特点,在有机溶剂中有一定的溶解度,对多种有机、无机化合物都有很高的分离效果,还可以在稀释后直接注入反相液相色谱,离子液体的这些特点使它成为DLLME方法常用的萃取剂。[C8MIM] [PF6]、[C6MIM][PF6]是比较常用的两种离子液体[20],Parrilla Vázquez 等[21]以[C8MIM] [PF6]为萃取剂、乙腈为分散剂分析了萃取剂、分散剂用量、冰浴时间、超声时间、pH 和离子强度等因素对废水中药物残留测定结果的影响,在优化的试验条件下高效液相色谱离子阱质谱(HPLC-QqLIT-MS)测定值 RSDs为 1.1% ~ 11.3%,LODs、LOQs 分别为0.2 ~ 60 ng/L和1.0 ~ 142 ng/L,回收率88% ~ 111%。聚合离子液体(polymerized ionic liquids, PILs)包埋的多孔碳纳米管可以进一步提高纳米材料的导电性和稳定性,Wu 等[22]把聚苯乙烯磺酸-聚合离子液体修饰的多孔碳纳米管溶液[A poly(3,4-ethylenedioxythiophene) -ionic liquid polymer functionalized multiwalled carbon nanotubes(PEDOT-PIL/MWCNTs) 滴入Nafion 溶液形成Nafion 外衣,这种外衣可以直接用于固相微萃取,具有优良的耐受性和稳定性(可使用150 次以上)。GC-FID(气相色谱-火焰-离子化检测器)测定苹果和莴苣中4 种氨基甲酸酯的LODs 为15.2 ~ 27.2 ng/L,RSD<8.2% (= 5),回收率87.5% ~ 106.5%。
1.2 固相萃取
1.2.1 固相萃取(solid-phase extraction, SPE) 固相萃取由于操作方便、灵活性大,是分离环境样品有机污染物的经典方法,水样一般先通过固体柱被吸附,然后用有机溶剂洗脱后分离。SPE 方法常用的吸附材料有C18、硅石、石墨烯/碳黑、活性炭、纳米材料、混合/阳离子交换剂、混合/阴离子交换剂等。吸附剂的选择应根据待测物的性质确定,一般要有较高的回收率和浓缩系数(浓缩系数一般在 20 ~ 1 000)[23]。Masiá 等[24]使用SPE方法从地表水和废水中分离了43 种农药及其代谢物(表1),液相色谱-四级杆串联质谱(liquid chromatography triple quadrupole tandem mass spectrometry, LC-QqQ-MS/MS) 测定的LODs 在 0.04 ~ 2 ng/L,进一步利用液相色谱-混合四级杆飞行时间质谱(liquid chromatography-hybrid quadrupole time-of-flight mass spectrometr, LC-QTOF-MS) 低、高能量碰撞反应获得组分的全质谱图,确定了1 100 多种有机污染物的代谢物。他们的试验表明,SPE 方法操作简单、分离效果好,可用于不同极性多种有机物的LC-QqQ-MS/ MS 或LC-QTOF-MS 测定。
石墨烯是一种新型碳纳米材料,这种由碳原子构成的二维蜂窝状结构具有很大的比表面积,理论上可达2 630 m2/g[25],平面结构的两侧都可以吸收分子[26-27],内部结构含丰富的π-π 电子堆积[28-29],对有机污染物、重金属、药物等具有良好的吸附作用,是应用相当广泛的吸附和分离材料。Shi 等[30]报道了利用一种新型的高分辨率多层多孔石墨烯为SPE 方法的吸附剂,并利用超高液相色谱-串联质谱(ultra high performance liquid chromatography-tandem mass spectrometry, UHPLC-MS/MS) 测定了地表水6 种氨基甲酸酯类农药残留(表1),决定系数2在0.999 ~ 0.999 8,LODs 为 0.5 ~ 6.9 ng/L,RSDs< 5.54% (= 5),对标准样品测定的结果证明这种石墨烯包埋的萃取柱可以重复使用100 次以上,对待测物的浓缩系数为34.2 ~ 51.7。
除石墨烯外,使用多孔硅石作为吸附剂成为近几年的一种趋势,其中最常见的是小孔六角形MCM- 41和立方体MCM-48,大孔六角形SBA-15 和立方体SBA-16,这些材料因为规则的多边形孔以及非常薄的壁(1 ~ 1.5 nm) 和较高的比表面积(1 000 m2/g 以上)而具有相对特殊的化学和热稳定性,有利于有机物的吸附和催化[31]。Kharbouche等[32]以MCM-41 为吸附剂,对环境水样中有机磷、氨基甲酸酯类等13 种极性不同的农药进行预浓缩,UPLC-MS/MS测定结果表明,方法的检出限为0.01 μg/L,13 种农药的回收率为70.1% ~ 113.5%,相对标准偏差RSDs 为8.3% ~ 15.7%。Gil García 等[33]以MCM-41为吸附剂预处理(浓缩)环境水样(河水、大坝水),利用微流液相色谱-四级杆在线离子阱质谱(microflow liquid chromatography-quadrupole linear ion trap mass spectrometer, MLC-QqLIT-MS) 研究了不同pH、离子强度和吸附剂用量对8 种不同极性的农药测定的影响(表1),结果表明:8 种农药的LODs、LOQs 分别在 0.01、0.05 μg/L 以下,准确度为65% ~ 126% (RSD≤14%),同时利用扩散核磁共振方法(diffusion NMR methods )13C CP/MAS NMR 分析了不同极性的农药残留与MCM-41 之间的选择互作。
聚苯胺修饰的沸石(PANI-modified zeolite NaY) 是另一种新型吸附剂,用于分散固相萃取(dispersive solid-phase extraction, d-SPE)分离有机磷、氨基甲酸酯等残留,其吸附能力达833 mg/kg,对20种农药的浓缩系数可达42[34]。Arnnok 等[34]以这种材料作为d-SPE方法的吸附剂,利用HPLC-PDA 分析了不同环境样品中的含4种氨基甲酸酯在内的5类不同性质的农药残留(表1),结果表明:LODs、LOQs 分别为0.001 ~ 1.00 mg/L和0.005 ~ 2.50 mg/L,回收率64% ~ 128%,RSDs<12%,污染水中的农药总量为 0.046 ~ 0.092 mg/L。
活性炭吸附的纳米材料 (NiZnS-AC)也可以作为一种新型吸附剂。Khodadoust 等[35]使用分散纳米固体-超声辅助微萃取方法(dispersive nano-solid material-ultrasound assisted micro-extraction,DN- SUAME) 分离水中恶虫威 (bendiocarb)、猛杀威(promecarb)。他们利用(Plackett-Burman, PB) 试验设计,分析了吸附剂用量、pH、离子强度、涡旋和超声时间和解吸体积对HPLC 测定结果的影响,在优化的试验条件下,方法的线性范围在0.003 3 ~ 10 µg/ml,LODs 为0.001 0 ~ 0.001 5 µg/ml,RSDs < 5.5% (= 3),方法可以用于测定环境水样恶虫威和猛杀威。
1.2.2 其他固相萃取法 由于不同吸附剂的吸附能力有限,寻找更加环保的、高效吸附性的材料与方法仍然值得学者们探索。以下介绍几种在SPE基础之上发展起来的吸附效率更高的环境样品分离方法。
1)分散固相萃取(dispersive solid phase extraction, d-SPE)。由前文可知,SPE方法是分离环境有机污染物常用的方法,然而该方法存在吸附能力有限、待测物会发生错误置换等局限。d-SPE是一种简化的SPE方法,也是目前使用较多的分离环境水样有机污染物的方法,把吸附剂分散在样品溶液/悬浮液中,平衡后离心、清洗回收待测物,这种方法有效增加了吸附剂与分离物的活性接触面,提高了分离效率。蔡玺晨等[36]使用d-SPE方法,利用超高效液相色谱-四极杆串联飞行时间质谱(UHPLC- QTOF/MS)法测定水环境中3种氨基甲酸酯类农药(表1),试验对萃取剂种类、萃取时间、洗脱剂种类以及水样的pH等进行了条件优化,在最佳的萃取条件下3种氨基甲酸酯农药LODs介于6.40 ~ 11.30 ng/L,RSD为3.5% ~ 10.4%,加标回收率为77% ~ 105%,可以用于水中氨基甲酸酯的测定。
2)磁力固相萃取(magnetic solid-phase extraction, M-SPE)。M-SPE方法以高磁力和吸附性的材料作为吸附剂以免去离心的步骤,使用较普遍的磁力吸附剂有外包有硅石的两性有机多分子聚合体、离子液体Fe3O4磁力纳米颗粒、单层或多层碳纳米管。此外,石墨烯以其独特的分子吸收性能和材料本身的高纯度性能成为一种比较受欢迎的新型吸附材料,石墨烯与磁性材料结合使用可以显著提高环境水样氨基甲酸酯分离的效果和浓缩效率,然而这种复合材料性能不够稳定,难以重复使用[23]。
3)基质固相分散萃取(matrix solid-phase dispersion, MSPD)。MSPD最初由Barker 等[37]于1989年创立,该方法将萃取和清洗简化为一个步骤,比较适用于固体样品的前处理,但是要注意避免操作过程中的误差如多样本的变异误差,分散介质的种类与用量、清洗步骤与馏分的组成变化带来的误差等。Soares 等[38]利用涡旋辅助基质固相萃取方法分离了饮用水有机磷、有机氯、氨基甲酸酯等15种农药残留(表1),GC-MS测定的回收率为70% ~ 120%,RSDs<20%,方法的LOQs介于5 ~ 500 μg/kg,相关系数0.997。该方法所用吸附剂的量较少 (5 ml),样品用量也较少(1.5 g),是一种操作简单、消耗少的环保方法。但是,寻找低成本、污染小的萃取方法仍然是学者们今后要关注的重点之一。
4)固相微萃取(solid phase microextraction, SPME)。该方法由Arthur和Pawliszyn[39]于1990年创立,这是一种不使用萃取剂的快速预处理样品的方法,它根据样品基质中待测物物质在固相中的分配系数不同达到分离。固相表层纤维的组成及特性对于分离的专一性和灵敏性影响较大。金属纳米材料(纳米管)具有比表面积大、吸附性能好、化学和热稳定性好、耐腐蚀、毒性较低等优点,是固相萃取的优良吸附剂。Zhou和Fang[40]用石墨烯-二氧化钛纳米阵列管作为固相微萃取的吸附剂分析了不同河水样品4种氨基甲酸酯(表1),分析了影响样品浓缩系数的因素,如样品pH、馏分组成、盐析出效率、吸附与解吸时间等,在优化的试验条件下,测定的几种农药的LODs为2.27 ~ 3.26 μg/L,回收率83.9% ~ 108.8%,是一种常规测定实际水样氨基甲酸酯含量的简便快捷方法。然而金属纳米材料成本较高,碳纳米相对便宜而且电导性好、富含π电子、机械强度大[41-43],是纳米吸附材料的良好替代品。Talebianpoor 等[44]以硫化锌-纳米-活性炭 (ZnS-AC) 以及 1-乙基-3-甲基咪唑六氟磷酸(1-ethyl-3-methylimidazolium hexafluorophosphate, EMIM-PF6) 离子流溶胶吸附剂,利用凝胶搅拌棒方法(stir bar sorptive extraction, SBSE) 分离了环境水样(自来水、河水、矿泉水)中3种氨基甲酸酯(表1),全因子设计分析结果表明,最佳溶剂质量体积比2.75% (/) NaCl、萃取时间23 min、解吸溶剂为300 μl甲醇、pH中性、搅拌速度500 r/min,HPLC-UV检测范围0.002 ~ 30 μg/ml,LODs 为0.000 3 ~ 0.000 5 μg/ml,RSDs (= 6) 介于 3.3% ~ 4.5%。
5) 空心纤维液体膜-固相萃取(hollow fibre supported liquid membrane-solid phase extraction, HFSLM-SPE)。HFSLM-SPE起初是用于分离生物样品(如药物)常用的空心纤维液相微萃取方法(hollow fiber liquid-phase microextraction),该方法的基本原理是被分离物通过扩散穿过“镀”有有机溶剂的液体膜上的疏水孔而实现分离,它具有消耗少、样品清洁度高、分离效率和浓缩系数高等优点[45],然而将此方法用于环境样品氨基甲酸酯类农药的分离还不多见。Msagati 和Mamba[46]用HFSLM-SPE分离了环境水样4种氨基甲酸酯(表1),HPLC分析采用C18柱,乙腈+水为流动相,紫外/二极管阵列为检测器,离子阱四级杆质谱(ion trap quadrupole mass spectrometer)分析采用正离子模式和全质谱扫描方式。结果表明,SPE方法的回收率为8% ~ 98%,在优化的萃取条件下HFSLM-SPE回收率达90% 以上,该方法具有较高的浓缩系数,可以用于环境样品N-甲基氨基甲酸酯的常规分离。
总之,不同类型的环境样品由于其物理化学性质的不同所采取的分离方法不同,使用的仪器测定方法也各异。随着科学和技术的进步,仪器分析这门学科也在不断地更新和发展。
2 仪器分析方法
氨基甲酸酯类农药的检测方法常见的有色谱方法如气相色谱法 (gas liquid chromatography, GC),高效液相色谱法(high performance liquid chromatography, HPLC) 和质谱(MS) 方法,质谱具有更高的灵敏度和分辨率,常和GC、HPLC联用。此外还有电化学敏感膜方法(electrochemical sensors)、酶联免疫法(enzyme-linked immune absorbant assays, ELISA)、毛细管电泳法(capillary electrophoresis, EC) 等。这些方法在低检测限范围内具有良好的灵敏度和选择性,但是对仪器操作者的熟练程度有一定的要求。
2.1 气相色谱-质谱法(GC-MS)
GC适用于测定非极性、易挥发性和易蒸发的化合物,它根据待测物挥发性质的不同而实现分离。GC常用的检测器有电子捕获检测器(electron capture detector, ECD),火焰光度检测器(flame photometric detector, FPD), 氮磷检测器(nitrogen phosphorus detector, NPD)、火焰离子化检测器(flame ionization detector, FID),质谱以及串联质谱 (mass spectrometric and tandem, MS) 检测器。NPD 主要用于检测含氮、磷的农药残留,FID 适用于检测多种类型的农药残留,MS 具有更高的灵敏度和抗干扰性,是有机分析最常用的检测器。Guo 和 Lee[19]以塑料软针筒作萃取设备,灌入微量(50 μl)密度小于水的有机溶剂,借助超声处理形成分散相,通过离心分开水相、有机相,有机萃取相与hydroxide 结合后利用GC-MS进行柱衍生和分析。其结果表明,这种低密度溶剂超声辅助微萃取方法分离效率高、重复性好,LODs介于 0.01 ~ 0.1 μg/L,线性范围为 0.05 ~ 50 μg/L 及0.5 ~ 100 μg/L,RSD< 9.2%。
2.2 高效液相色谱-质谱法(HPLC-MS)
HPLC 适用于分析高极性、非挥发性和热稳定性好的有机化合物,HPLC 常见的检测器有紫外(UV)检测器、荧光(fluorescence) 检测器、二极管阵列(diode-array, DAD) 检测器和质谱(Mass) 检测器,其中利用柱后衍生荧光检测器可以显著提高HPLC 的分辨率,是氨基甲酸酯测定的一种较为普遍的方法[51]。Pulgarı´n等[52]报道了一种简单快速测定土壤样品氨基甲酸酯的方法:样品先经98% 甲醇处理,HPLC 收集的馏分与碱性Co2+EDTA 混合后在紫外灯照射下诱导氨基甲酸酯光解形成光诱导的化学荧光产物(PICL),产物的荧光信号由荧光检测器捕获,其含量随时间的变化可以由色谱峰面积计算得到。在优化的实验条件下,HPLC-PICL 峰面积与待测物含量呈很好的相关性,几种农药的LODs 分别为:硫双威 0.05 mg/L、虫恶威0.09 mg/L、西维因0.17 mg/L,对标准土壤的回收率为87% ~ 120%。不断开发高通量、高灵敏度的色谱方法(比如新型固定相和色谱柱的研发)以缩短分析时间、提高检测的灵敏度仍是环境样品分析的研究热点。Fernández- Ramos 等[49]开发了一种新型高效液相色谱柱即大体积样品注射-熔丝保护内核柱,他们通过在线固相萃取、HPLC-UV 测定地表水4 种氨基甲酸酯的LOTs 为5.5 ~ 8.9 mg/L(表1),LOQs 介于18.4 ~ 29.7 mg/L,日内、日间的测定变异小于15%,该方法可以成功地用于地表水有机污染物的测定。Carro 等[47]用DLLME方法前处理水样,利用程序升温蒸发-大体积注射气相色谱-串联质谱(DLLME-PTV-LVI- GC- MS/MS)方法测定了水中西维因(carbaryl), 甲基毒死婢 (chlorpyrifos-methyl) 等十几种农药的含量。其结果表明:LOQs 范围基本都在0.5 ~ 18 ng/L,RSDs 介于0.8% ~ 14.6%,精度(以分离效率表示)为70% ~ 130%,待测海水、河水、污泥水中的农药总浓度为 2.7 ~ 440 ng/L。
超高液相色谱(ultra-high performance liquid chromatography, UHPLC) 以其较高的流动相压力(高达1 000 bar)和微小的色谱柱粒径(1.7 ~ 1.8 μm)保证了色谱柱的最佳热力学性能,使待测物的峰形在相对狭窄紧凑的范围内,有效提高了色谱分离效率、灵敏度和分辨率[23]。Shi 等[30]以石墨烯作为SPE 方法的吸附剂,用超高液相色谱-串联质谱(UHPLC- MS-MS) 测定了不同环境水样(河水、湖水、井水)中6 种氨基甲酸酯:抗蚜威(pirimicarb)、残杀威(baygon)、西维因(carbaryl)、异丙威(isoprocarb)、仲丁威(baycarb)、乙霉威(diethofencarb),测定的6 种农药的LODs 介于 0.5 ~ 6.9 ng/L,RDD<5.54%。
HPLC 与MS 联用是有机污染物分析的重要方法,其中ESI-HPLC-MS(电喷雾-高效液相色谱-串联质谱)是环境样品有机分析的重要工具,ESI 的优势是在标准环境温度下样品在液相中直接离子化,减小了热不稳性化合物的降解,因而减少了干扰离子的存在,提高了灵敏度,当ESI与SPE方法并用时仪器检测限可低至ng/L[51]。Boujelbane 等[48]用反向高效液相色谱-电喷雾离子化串联质谱(reversed-phase high-performance liquid chromatography-electrospray ionisation mass spectrometry, RP-HPLC-ESI-MS/MS) 测定了河水样品中的两种氨基甲酸酯:灭害威(aminocarb) 和恶虫威(bendiocarb),样品先由液相萃取分离,C18反向色谱柱梯度洗脱(回收率在56% ~ 102%,RSD≤10%),样品在100 倍预浓缩之后通过ESI-MS 定量(多级反应模式multiple reaction monitoring mode, MRM),两种氨基甲酸酯的LODs 为0.1 μg/L,是一种实用高效的分析河水中这两种农药含量的快捷方法。
2.3 其他方法
2.3.1 光谱法 Bazrafshan 等[50]报道了利用合成的纳米级西维因分子印迹聚合物作为超声辅助固相微萃取方法的吸附剂分离水中的西维因,紫外-可见分光光度法测定的结果表明,方法线性范围在0.1 ~ 1.2 mg/L,浓缩系数25。LOD、LOQ 分别为0.033、0.11 mg/L,RSD<4.3%,重复性好,可以用于环境水样西维因含量的快速测定。
2.3.2 酶联免疫方法 (enzyme-linked immunosorbent assay, ELISA) 免疫方法最初在医学上应用于血液胰岛素的测定,由于该方法操作简单、不需要昂贵的仪器、具有良好的灵敏度和分辨率,使得它在环境有机污染物的分析方面受到一定的关注。该方法的基本原理是测量基于固相(支撑面)的抗原-抗体在结合位点的反应,通过结合位点荧光标记信号的强弱估算抗体在抗原抗体复合体所占的比例,从而计算介质中待测物的含量[53]。Yang 等[54]利用ELISA方法分析了不同基质样品中氨基甲酸酯,他们通过合成克百威(2,3-二氢- 2,2-二甲基苯并呋喃- 7-基甲基氨基甲酸酯)和呋喃酚(2,3-二氢- 2,2-二甲基- 7-羟基苯并呋喃)抗体,构建一种共价结合ELISA 直接竞争方法测定水、土壤和莴苣中的克百威,测定的回收率在 100.1% ~ 108.3%。近几年出现的高通量酶联免疫方法的最大优势在于简便的样品处理过程[55],适合于田间作物大样本的快速农残测定。
2.3.3 电化学传感器方法(electrochemical sensors) 它是一种利用某种酶促或电化学反应通过电化学传感器从共有组分选择性地识别目标分离物的检测方法。Caetano 和 Machado[56]第一次使用电流式酶生物传感器测定了土豆中氨基甲酸酯(如甲萘威)的含量,该方法的检测限LODs 为2.0 × 10−6mol/L。学者们研究发现,可以用不同类型的纳米材料修饰电化学传感器(如电极)来测定不同基质中的农药残留。微悬臂免疫传感器(microcantilever-based immunosensor) 是新一代用于生物测定的电化学技术,Dai 等[57]用克百威的单克隆抗体作为接受分子,镀金的微悬臂由交联的L-半胱氨酸/戊二醛(L-cysteine /glutaraldehyde)进行化学修饰,克百威的单克隆抗体被固定在微悬臂一侧形成免疫接收器,根据抗原抗体反应定量测定克百威含量。他们的实验结果表明,克百威线性范围介于 1.0 × 10−7~ 1.0 × 10−3g/L (2= 0.998),LOD 为 0.1 ng/ml,是一种稳定性好、灵敏度和分辨率高、适合于土壤样品克百威含量测定的方法。
Sinha 等[58]报道了由单层MoS2聚合的3D多层纳米管作为传感器,传感器在人工操作条件下被“镀”在玻璃碳电极的表面,用电极快速专一性地测定河水中常见的氨基甲酸酯乙霉威 的含量,这种超薄纳米材料多孔而且比表面积大、附着力强,避免了测定过程中传感器的波动,更重要的是对乙霉威在电极表面的氧化有很高的敏感性。通过方波伏安法(SWV)计算的乙霉威LOD、LOQ 分别为 0.32 ng/μl 和1.09 ng/μl,得到的浓度范围为 1 ~ 55 ng/μl,微分脉冲伏安法(differential pulse voltammetry, DPV) 得到的浓度范围在1 ~ 35 ng/μl,回收率为 94.23% ~ 105.46%。
2.4 质谱分析法
近年来质谱技术在环境有机分析领域有了很大的发展,质谱分离的基本原理是根据裂解碎片的质量/电荷(/)的不同实现分离。相对于其他类型的检测器,质谱具有更高的分辨率,但是也有学者人为地把质谱分为低分辨率质谱和高分辨率质谱。低分辨率质谱(low resolution MS, LR-MS) 常用作多种有机污染物的高通量分析和扫描,其中三重四级杆质谱(triple quadrupole, QqQ) 以其价格优势和独特的定量分析特性仍然占有较大的市场。
高分辨率质谱(high resolution MS, HR-MS) 的出现可以追溯到1999年,其优势是以更高的分辨率全谱扫描一次检测上千种未知化合物,还能有效减小拟同重离子(quasi-isobaric interfering ions) 对待测离子的干扰,具有更加强大的分辨率和线性范围[23]。离子阱质量分析器(qrbitrap mass spectrometer) 是一种可以和QqTOF 媲美的高分辨率质谱,同样由于强大的全谱扫描方式来确定未知化合物,最初应用于蛋白组学和代谢组学的研究,近几年在环境分析领域的应用越来越引起学者们的关注。Wode 等[59]利用UHPLC-Orbitrap-MS 同时测定了水中的72 种有机污染物,他们使用[M+H]+ 及 [M-H]-为分离质量,13C-/37Cl-同位素为确认质量,有效避免了假阳性离子干扰,提高了分辨率。四重线性离子阱(quadrupole- linear ion trap, QqQLIT) 是一种组合质谱,它不仅以一轮LC-MS/MS 完成离子阱扫,而且可以和多种MS仪器平台联用,使得该技术在环境有机分析中的应用日益广泛,然而QqQLIT的一个局限是分析时间较长,单次进样可获得的离子对有限[23]。Reemtsma 等[60]利用UHPLC-QqQLIT方法,只对样品进行过滤后大体积进样检测了地表水、地下水和饮用水150 多种农药代谢物,他们采用每种待测物都进行正离子多级反应模式(positive ESI-MRM) 和负离子多级反应模式(negative ESI-MRM) 的方法不仅缩短了样品预处理时间,而且提高了分析效率。TOF、QqTOF、Orbitrap、LITOrbitrap 都是具有强大的分辨能力的质谱,它们可以进行前靶向分析、后靶向分析和非靶向分析,值得注意的是后靶向分析(post-target analysis) 可以不使用标准品对环境中所有潜在的有机污染物及其转化产物进行分析,待测物的精准质/荷 (/)可以在根据推算的分子结构式由高分辨率的全谱扫描确定[23]。近年来,QqTOF 比TOF 应用范围更广,原因是QqTOF 可以通过产物离子扫描实验来确定待测物的分子结构信息。
总之,随着环境有机污染物潜在风险的日益凸显,从样品分离技术的日臻完善到色谱、质谱分析方法的不断升级,开发可以快速测定痕量有机污染物的多种方法仍然十分重要。近年来,高通量、高分辨率的色谱技术如二维液相色谱(two-dimensional LC, 2D-LC) 及其与离子移动四级杆飞行质谱(IM-QTOF)的联用相继问世,2D-LC-IM-QTOF 可以提供四维分离平台,研究者根据其质量和碰撞场准确分离鉴定废水中53 种污染物[21]。然而,有机污染物在环境中的迁移与代谢途径我们仍知之甚少,相关的研究还需要长期不懈的研究与探索。
[1] 陈中云, 闵航, 张夫道, 等. 农药污染对水稻田土壤硫酸盐还原菌种群数量及其活性影响的研究[J]. 土壤学报, 2004, 41(1): 97–102.
[2] 高寒, 陈娟, 王沛芳, 等. 农药污染土壤的生物强化修复技术研究进展[J]. 土壤, 2019, 51(3): 425–433.
[3] Wang X L, Meng X F, Wu Q H, et al. Solid phase extraction of carbamate pesticides with porous organic polymer as adsorbent followed by high performance liquid chromatography-diode array detection[J]. Journal of Chromatography A, 2019, 1600:9–16.
[4] Ghoraba Z, Aibaghi B, Soleymanpour A. Ultrasound-assisted dispersive liquid-liquid microextraction followed by ion mobility spectrometry for the simultaneous determination of bendiocarb and azinphos-ethyl in water, soil, food and beverage samples[J]. Ecotoxicology and Environmental Safety, 2018, 165: 459–466.
[5] Samsidar A, Siddiquee S, Shaarani S M. A review of extraction, analytical and advanced methods for determination of pesticides in environment and foodstuffs[J]. Trends in Food Science & Technology, 2018, 71: 188–201.
[6] Farajzadeh M A, Feriduni B, Afshar Mogaddam M R. Development of counter current salting-out homogenous liquid-liquid extraction for isolation and preconcentration of some pesticides from aqueous samples[J]. Analytica Chimica Acta, 2015, 885: 122–131.
[7] Rezaee M, Assadi Y, Milani Hosseini M R, et al. Determination of organic compounds in water using dispersive liquid-liquid microextraction[J]. Journal of Chromatography A, 2006, 1116(1/2): 1–9.
[8] Rezaee M, Yamini Y, Faraji M. Evolution of dispersive liquid-liquid microextraction method[J]. Journal of Chromatography A, 2010, 1217(16): 2342–2357.
[9] Liu Z M, Zang X H, Liu W H, et al. Novel method for the determination of five carbamate pesticides in water samples by dispersive liquid-liquid microextraction combined with high performance liquid chromatography[J]. Chinese Chemical Letters, 2009, 20(2): 213–216.
[10] Khodadoust S, Hadjmohammadi M. Determination of N-methylcarbamate insecticides in water samples using dispersive liquid-liquid microextraction and HPLC with the aid of experimental design and desirability function[J]. Analytica Chimica Acta, 2011, 699(1): 113–119.
[11] Yazdi A S, Razavi N, Yazdinejad S R. Separation and determination of amitriptyline and nortriptyline by dispersive liquid-liquid microextraction combined with gas chromatography flame ionization detection[J]. Talanta, 2008, 75(5): 1293–1299.
[12] Wu Q H, Li Y P, Wang C, et al. Dispersive liquid-liquid microextraction combined with high performance liquid chromatography-fluorescence detection for the determination of carbendazim and thiabendazole in environmental samples[J]. Analytica Chimica Acta, 2009, 638(2): 139–145.
[13] Berijani S, Assadi Y, Anbia M, et al. Dispersive liquid-liquid microextraction combined with gas chromatography-flame photometric detection: Very simple, rapid and sensitive method for the determination of organophosphorus pesticides in water[J]. Journal of Chromatography A, 2006, 1123(1): 1–9.
[14] Chou T Y, Lin S L, Fuh M R. Determination of phenylurea herbicides in aqueous samples using partitioned dispersive liquid-liquid microextraction[J]. Talanta, 2009, 80(2): 493– 498.
[15] Melwanki M B, Fuh M R. Dispersive liquid-liquid microextraction combined with semi-automated in-syringe back extraction as a new approach for the sample preparation of ionizable organic compounds prior to liquid chromatography[J]. Journal of Chromatography A, 2008, 1198–1199: 1–6.
[16] Primel E G, Caldas S S, Marube L C, et al. An overview of advances in dispersive liquid-liquid microextraction for the extraction of pesticides and emerging contaminants from environmental samples[J]. Trends in Environmental Analytical Chemistry, 2017, 14: 1–18.
[17] Chen H, Chen R W, Li S Q. Low-density extraction solvent-based solvent terminated dispersive liquid-liquid microextraction combined with gas chromatography-tandem mass spectrometry for the determination of carbamate pesticides in water samples[J]. Journal of Chromatography A, 2010, 1217(8): 1244–1248.
[18] Moreno-González D, Gámiz-Gracia L, Bosque-Sendra J M, et al. Dispersive liquid-liquid microextraction using a low density extraction solvent for the determination of 17 N-methylcarbamates by micellar electrokinetic chromatography-electrospray-mass spectrometry employing a volatile surfactant[J]. Journal of Chromatography A, 2012, 1247: 26–34.
[19] Guo L, Lee H K. Low-density solvent based ultrasound- assisted emulsification microextraction and on-column derivatization combined with gas chromatography-mass spectrometry for the determination of carbamate pesticides in environmental water samples[J]. Journal of Chromatography A, 2012, 1235: 1–9.
[20] Suárez R, Horstkotte B, Cerdà V. In-syringe magnetic stirring-assisted dispersive liquid-liquid microextraction for automation and downscaling of methylene blue active substances assay[J]. Talanta, 2014, 130: 555–560.
[21] Parrilla Vázquez M M, Parrilla Vázquez P, Martínez Galera M, et al. Ultrasound-assisted ionic liquid dispersive liquid-liquid microextraction coupled with liquid chromatography- quadrupole-linear ion trap-mass spectrometry for simultaneous analysis of pharmaceuticals in wastewaters[J]. Journal of Chromatography A, 2013, 1291: 19–26.
[22] Wu M, Wang L Y, Zeng B Z, et al. Ionic liquid polymer functionalized carbon nanotubes-doped poly(3, 4-ethylenedioxythiophene) for highly-efficient solid-phase micro extraction of carbamate pesticides[J]. Journal of Chromatography A, 2016, 1444: 42–49.
[23] Pérez-Fernández V, Mainero Rocca L, Tomai P, et al. Recent advancements and future trends in environmental analysis: Sample preparation, liquid chromatography and mass spectrometry[J]. Analytica Chimica Acta, 2017, 983: 9–41.
[24] Masiá A, Ibáñez M, Blasco C, et al. Combined use of liquid chromatography triple quadrupole mass spectrometry and liquid chromatography quadrupole time-of-flight mass spectrometry in systematic screening of pesticides and other contaminants in water samples[J]. Analytica Chimica Acta, 2013, 761: 117–127.
[25] Stoller M D, Park S, Zhu Y W, et al. Graphene-based ultracapacitors[J]. Nano Letters, 2008, 8(10): 3498–3502.
[26] Liu Q, Shi J B, Jiang G B. Application of graphene in analytical sample preparation[J]. TrAC Trends in Analytical Chemistry, 2012, 37: 1–11.
[27] Ye N S, Shi P Z, Wang Q, et al. Graphene as solid-phase extraction adsorbent for CZE determination of sulfonamide residues in meat samples[J]. Chromatographia, 2013, 76(9/10): 553–557.
[28] McAllister M J, Li J, Adamson D H, et al. Single sheet functionalized graphene by oxidation and thermal expansion of graphite[J]. Chemistry of Materials, 2007, 19(18): 4396–4404.
[29] Su Q, Pang S, Alijani V, et al. Composites of graphene with large aromatic molecules[J]. Advanced Materials, 2009, 21(31): 3191–3195.
[30] Shi Z H, Hu J D, Li Q, et al. Graphene based solid phase extraction combined with ultra high performance liquid chromatography-tandem mass spectrometry for carbamate pesticides analysis in environmental water samples[J]. Journal of Chromatography A, 2014, 1355: 219–227.
[31] Walcarius A, Mercier L. Mesoporous organosilica adsorbents: nanoengineered materials for removal of organic and inorganic pollutants[J]. Journal of Materials Chemistry, 2010, 20(22): 4478–4511.
[32] Kharbouche L, Gil García M D, Lozano A, et al. Solid phase extraction of pesticides from environmental waters using an MSU-1 mesoporous material and determination by UPLC-MS/ MS[J]. Talanta, 2019, 199: 612–619.
[33] Gil García M D, Dahane S, Arrabal-Campos F M, et al. MCM-41 as novel solid phase sorbent for the pre-concentration of pesticides in environmental waters and determination by microflow liquid chromatography-quadrupole linear ion trap mass spectrometry[J]. Microchemical Journal, 2017, 134: 181–190.
[34] Arnnok P, Patdhanagul N, Burakham R. Dispersive solid-phase extraction using polyaniline-modified zeolite NaY as a new sorbent for multiresidue analysis of pesticides in food and environmental samples[J]. Talanta, 2017, 164: 651–661.
[35] Khodadoust S, Ghaedi M, Hadjmohammadi M R. Dispersive nano solid material-ultrasound assisted microextraction as a novel method for extraction and determination of bendiocarb and promecarb: Response surface methodology[J]. Talanta, 2013, 116: 637–646.
[36] 蔡玺晨, 张占恩, 张磊. DSPE-UPLC-QTOF/MS法测定水中氨基甲酸酯类农药[J]. 化学试剂, 2015, 37(5): 440–442, 477.
[37] Barker S A, Long A R, Short C R. Isolation of drug residues from tissues by solid phase dispersion[J]. Journal of Chromatography A, 1989, 475(2): 353–361.
[38] Soares K L, Cerqueira M B R, Caldas S S, et al. Evaluation of alternative environmentally friendly matrix solid phase dispersion solid supports for the simultaneous extraction of 15 pesticides of different chemical classes from drinking water treatment sludge[J]. Chemosphere, 2017, 182: 547–554.
[39] Arthur C L, Pawliszyn J. Solid phase microextraction with thermal desorption using fused silica optical fibers[J]. Analytical Chemistry, 1990, 62(19): 2145–2148.
[40] Zhou Q X, Fang Z. Graphene-modified TiO2nanotube arrays as an adsorbent in micro-solid phase extraction for determination of carbamate pesticides in water samples[J]. Analytica Chimica Acta, 2015, 869: 43–49.
[41] Baughman R H, Zakhidov A A, de Heer W A. Carbon nanotubes——the route toward applications[J]. Science, 2002, 297(5582): 787–792.
[42] Ajayan P M, Zhou O Z. Applications of carbon nanotubes[M]// Topics in Applied Physics. Berlin, Heidelberg: Springer Berlin Heidelberg, 2001: 391–425.
[43] Qu L T, Dai L M. Substrate-enhanced electroless deposition of metal nanoparticles on carbon nanotubes[J]. Journal of the American Chemical Society, 2005, 127(31): 10806–10807.
[44] Talebianpoor M S, Khodadoust S, Mousavi A, et al. Preconcentration of carbamate insecticides in water samples by using modified stir bar with ZnS nanoparticles loaded on activated carbon and their HPLC determination: Response surface methodology[J]. Microchemical Journal, 2017, 130: 64–70.
[45] Venson R, Korb A S, Cooper G. A review of the application of hollow-fiber liquid-phase microextraction in bioanalytical methods - A systematic approach with focus on forensic toxicology[J]. Journal of Chromatography B, 2019, 1108: 32–53.
[46] Msagati T A M, Mamba B B. Monitoring of N-methyl carbamate pesticide residues in water using hollow fibre supported liquid membrane and solid phase extraction[J]. Physics and Chemistry of the Earth, Parts A/B/C, 2012, 50–52: 149–156.
[47] Carro A M, Fernández S, Racamonde I, et al. Dispersive liquid-liquid microextraction coupled with programmed temperature vaporization-large volume injection-gas chromatography-tandem mass spectrometry for multiclass pesticides in water[J]. Journal of Chromatography A, 2012, 1253: 134–143.
[48] Boujelbane F, Oueslati F, Hamida N B. A rapid determination and extraction of three carbamate insecticides using LC-ESI-MS/MS: Application to their identification in a real river water sample[J]. Desalination, 2010, 250(1): 473–478.
[49] Fernández-Ramos C, Šatínský D, Solich P. New method for the determination of carbamate and pyrethroid insecticides in water samples using on-line SPE fused core column chromatography[J]. Talanta, 2014, 129: 579–585.
[50] Bazrafshan A A, Ghaedi M, Rafiee Z, et al. Nano-sized molecularly imprinted polymer for selective ultrasound- assisted microextraction of pesticide Carbaryl from water samples: Spectrophotometric determination[J]. Journal of Colloid and Interface Science, 2017, 498: 313–322.
[51] Nogueira J M F, Sandra T, Sandra P. Multiresidue screening of neutral pesticides in water samples by high performance liquid chromatography-electrospray mass spectrometry[J]. Analytica Chimica Acta, 2004, 505(2): 209–215.
[52] Murillo Pulgarín J A, García Bermejo L F, Carrasquero Durán A. Determination of carbamates in soils by liquid chromatography coupled with on-line postcolumn UV irradiation and chemiluminescence detection[J]. Arabian Journal of Chemistry, 2020, 13(1): 2778–2784.
[53] Hennion M C, Barcelo D. Strengths and limitations of immunoassays for effective and efficient use for pesticide analysis in water samples: a review[J]. Analytica Chimica Acta, 1998, 362(1): 3–34.
[54] Yang J Y, Wang H, Jiang Y M, et al. Development of an enzyme-linked immuno-sorbent assay (ELISA) method for carbofuran residues[J]. Molecules (Basel, Switzerland), 2008, 13(4): 871–881.
[55] Watanabe E. The present state and perspective on simple and rapid immunochemical detection for pesticide residues in crops[J]. Jarq-japan Agricultural Research Quarterly, 2011, 45(4): 359–370.
[56] Caetano J, Machado S A S. Determination of carbaryl in tomato “in natura” using an amperometric biosensor based on the inhibition of acetylcholinesterase activity[J]. Sensors and Actuators B: Chemical, 2008, 129(1): 40–46.
[57] Dai Y P, Wang T, Hu X Y, et al. Highly sensitive microcantilever-based immunosensor for the detection of carbofuran in soil and vegetable samples[J]. Food Chemistry, 2017, 229: 432–438.
[58] Sinha A, Huang Y J, Zhao H M. Preparation of 3D assembly of mono layered molybdenum disulfide nanotubules for rapid screening of carbamate pesticide diethofencarb[J]. Talanta, 2019, 204: 455–464.
[59] Wode F, Reilich C, van Baar P, et al. Multiresidue analytical method for the simultaneous determination of 72 micropollutants in aqueous samples with ultra high performance liquid chromatography-high resolution mass spectrometry[J]. Journal of Chromatography A, 2012, 1270: 118–126.
[60] Reemtsma T, Alder L, Banasiak U. A multimethod for the determination of 150 pesticide metabolites in surface water and groundwater using direct injection liquid chromatography- mass spectrometry[J]. Journal of Chromatography A, 2013, 1271(1): 95–104.
Advances on Extraction and Determination of Carbamate Pesticide in Environmental Samples
YIN Xiaoming, LI Xuelin*
(College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China)
Carbamate is a kind of high efficiency and wide spectrum pesticides widely used in the agricultural production. However, the environmental pollution and food safety issues resulted from the large amount application of this pesticides have attracted more and more public concerns. Therefore, the development of ideal sample pretreatment methods and more effective instrumental analysis methods has become a research hotspot in this field. Based on 60 relevant literatures at home and abroad, this paper analyzed the separation and extraction methods of carbamate pesticides in environmental samples as well as the advantages and disadvantages of different methods, and summarized the instrumental analysis methods and development trends of carbamate pesticides in order to provide valuable references for the analysis of carbamate pesticides in the environment.
Carbamate; Pesticide; Analysis technique
X53
A
10.13758/j.cnki.tr.2020.05.005
尹晓明, 李学林. 环境样品氨基甲酸酯类农药的分离和检测技术研究进展. 土壤, 2020, 52(5): 901–910.
南京农业大学中央高校基本科研业务费科技平台实验技术项目(SYSB201810)资助。
尹晓明(1970—),女,安徽阜阳人,博士,副教授,主要从事环境生物学、实验教学工作研究。E-mail: yxm@njau.edu.cn
