核酸层析法转基因快速检测体系的建立及应用
2020-12-09任雯杨海侠陈立柱李雨峰刘亚
任雯,杨海侠,陈立柱,李雨峰,刘亚*
1.北京市农林科学院玉米研究中心, 玉米DNA指纹及分子育种北京市重点实验室, 北京 100097; 2.宝瑞源生物技术(北京)有限公司, 北京 102433
自1996年商业化转基因作物面世以来,全球农业转基因技术的应用迅猛发展,转基因作物的种植面积逐年快速扩大,批准国家迅速增加[1]。2018年全球转基因作物种植面积已达1.917亿hm2[2],是1996年的113倍,占全球15亿hm2耕地面积的13%左右,全球商业化应用转基因的国家或地区已增加到70个[3]。其中,我国凭借290万hm2的转基因作物种植面积位列全球第7位。我国对转基因技术的发展也持续高度重视与支持,发展农业转基因技术是我国的国家战略要求,而转基因检测作为转基因研究体系中重要一环,重要性日益凸显,因此,开展转基因快速、高效分子检测方法的研发具有重要的生产实践及科研意义。
一般转基因作物的检测分为核酸水平检测和蛋白质水平检测,常用检测方法有PCR、Southern杂交、Northern杂交、Western杂交等,其中,PCR技术是核酸水平检测外源基因的主要手段[4-5]。核酸检测的分子生物学方法一般包括3个步骤:核酸提取、核酸扩增和核酸检测。目前,普通PCR检测方法是我国转基因植物检测的核心技术,但该方法对实验条件要求较高,需要配备划分不同功能区域的大面积实验空间、大量专业实验仪器,且需完成核酸提取、PCR扩增以及电泳等实验流程才可进行检测结果判读[6]。为提高基于PCR检测方法的效率,研究人员从加速或省略核酸提取步骤、提高PCR反应效率及提高结果检测效率等环节优化检测流程,如赵冰兵等[7]使用一种直接PCR的方法进行转基因检测,通过省略核酸提取步骤从而对检测步骤进行简化;而武海斌等[8]建立的一种基于基因芯片的多重PCR检测方法以及金芜军等[9]用复合PCR方法对6种转基因玉米中的外源DNA片段和玉米内参照基因(Zein)进行特异性检测,均基于多重PCR方法提升了检测效率;此外,刘亚等[10]对3种不同核酸分析系统的效率进行了比较并对其不同适用范围和优缺点进行了总结分析,提出了对PCR结果判读流程的优化方案。
蛋白质水平检测方面,目前常用的是基于胶体金技术的蛋白试纸条方法。胶体金免疫层析技术(colloidal gold immunochromatography assay,GICA)是将胶体金标记技术、免疫检测技术和层析技术相结合,是19世纪80年代继三大标记技术(荧光素、放射性同位素和酶)后发展起来的固相标记免疫测定技术[11]。最初该方法仅用于免疫电镜技术,现在已经发展到应用于光镜染色、免疫印迹以及免疫层析技术等领域[12]。这类试纸条检测的特点是更加便捷,但存在适用范围窄的缺陷,目前主要适用于转基因植物的大田和原材料的快速初筛。
核酸层析技术是基于胶体金技术发展而来的一种新的检测方法,通过结合常规PCR与核酸胶体金层析技术,针对标记基因的核苷酸序列设计特异性引物,并对引物序列进行地高辛和生物素标记,然后对试样DNA进行PCR扩增,再对扩增产物进行胶体金检测,最后根据胶体金检测是否显色,判断样品中是否含有待测成分[13]。本研究采用一步法获取玉米、大豆、水稻等样本的核酸作为检测模板,分别使用内参基因、转基因元件、转入外源基因及事件特异性检测引物进行PCR扩增,再使用核酸层析法试纸鉴定检测结果,旨在研发一种新的基于核酸检测又可利用试纸条一步查验结果的转基因检测新方法。
1 材料与方法
1.1 试验材料
所用实验样本均由本实验室保存,具体材料及品种名称为:非转基因玉米样品:京科968(用于进行内参基因ZSSⅡB、Zein的检测,并作为各类转基因元件、外源基因及事件特异性检测及大豆、水稻内参基因检测的阴性对照);转基因玉米样品:Bt11(作为内参基因ZSSⅡB、Zein、启动子CaMV35S、终止子NOS、抗虫基因Cry1Ab/1Ac、抗除草剂基因Pat及转基因事件Bt11检测的阳性对照);Mir604(作为选择标记基因Pmi及转基因事件Mir604检测的阳性对照);Bt176(作为抗除草剂基因Bar检测的阳性对照);NK603(作为抗除草剂基因CP4-EPSPS检测的阳性对照);Mon863(用以作为选择标记基因NPTⅡ检测的阳性对照);大豆样品:选用黑河12,用于进行大豆内参基因SPS的检测;水稻样品:选用日本晴,用于进行内参基因Lectin的检测。
1.2 主要试剂及仪器设备
DNA提取试剂盒购自北京康为世纪生物科技有限公司;TaqDNA聚合酶、dNTP混合液购自北京全式金生物技术有限公司;胶体金检测试纸条由宝瑞源生物技术(北京)有限公司生产;引物由北京擎科生物技术有限公司合成。
PCR仪选用C1000 Touch PCR系统(美国Bio-Rad公司);分光光度计选用Nanodrop 1000分光光度计(美国Thermo Fisher公司)。
1.3 标记基因及选用引物
本研究选择了内参基因、转基因元件、转入外源基因及事件特异性检测这4类检测项目进行实验分析。内参基因用以区分作物种类并判别检出结果的有效性;对常用的抗虫、抗除草剂及选择标记基因等进行检测,以证实本方法同时具备与蛋白水平检测相同的检出效果。此外,还选择了转基因元件及事件特异性检测这2类仅用PCR等核酸检测才可检出的检验项目,用以判定本方法在核酸检测中的特异性和有效性。对引物进行整理、筛选和优化,最终确定其中一套引物用于检测(表1),引物序列均出自农业农村部转基因检测的相关文件[14-18]。

表1 转基因检测引物Table 1 Primers for genetically modified maize
1.4 样本处理
将转基因种子、植物叶片、茎秆过根系等材料,液氮冷冻研磨成粉状,每种样品取30 mg加500 μL ddH2O,使用移液枪多次吹吸混匀,静置5 min备用。
1.5 一管法DNA提取
取5 μL核酸释放剂(100 mmol·L-1氯化钾;0.5 mmol·L-1pH 8.0 Tris-HCl;1%曲拉通100;1% SDS;5 mg·mL-1蛋白酶K),加入PCR反应管中;取1.4制得的待测样本5 μL加入对应的PCR反应管中,并用移液器在管底吹打混匀10次;每管加30 μL无菌石蜡油备用。将制备好的包含待测样品及石蜡油的PCR反应管放置在PCR仪中进行裂解反应,反应程序为:95 ℃ 10 min,4 ℃ 5 min。
1.6 PCR方法
向1.5所获得的裂解样品的PCR反应管中依次加入:10×PCR Buffer 5 μL,du dNTP混合液1 μL,10 μmol·L-1上、下游引物各0.3 μL,TaqDNA聚合酶1 μL,ddH2O 27.4 μL,并混匀。其中,10×PCR buffer含有0.1% DMSO、3%~5% BSA、100 mmol·L-1KCl、1 mmol·L-1MgCl2、50 mmol·L-1pH 8.0 Tris-HCl。将PCR管放到离心机上,于500~1 000 g离心10 s,然后取出PCR管,放入PCR仪中,PCR反应程序为:50 ℃ 2 min;95 ℃ 5 min;95 ℃变性15 s,60 ℃退火延伸45 s,共40个循环。
1.7 PCR产物胶体金检测
取35 μL 1.6中的PCR反应产物加入胶体金检测卡(胶体金核酸层析试纸条包含样品垫、金标结合垫、硝酸纤维素膜、胶体金检测线、质控线和吸水垫,具体见图1A),等5~10 min观察显色状况(期间根据胶体金卡层析情况,可以加入少量超纯水加快层析),根据显色卡读取各样品显色级别。一般设置0~10档, 0为全阴性,10为强阳性,中间梯度递增;10+表示T线颜色深于标准色卡最强的10档。当胶体金检测T线和C线出现肉眼可见显色,表明样品含有转基因成分,结果表述为“样品检检出转基因成分(或目的基因成分),检测结果为阳性”(图1B);而胶体金检测T线未出现肉眼可见显色,C线出现肉眼可见显色,表明样品不含有转基因成分,结果表述为“样品检未检出转基因成分(或目的基因成分),检测结果为阴性”(图1C)。
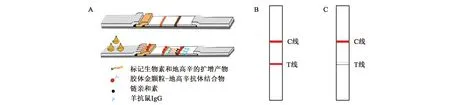
A:胶体金核酸层析试纸条层析设计原理图;B、C:检测结果判定示意图。图1 胶体金核酸层析试纸条层析设计原理及检测结果判定示意图Fig.1 The schematic diagram of colloidal gold nucleic acid chromatography strip and the detection result
2 结果与分析
2.1 内参基因检测
将玉米内参基因ZSSⅡB及Zein、大豆内参基因SPS、水稻内参基因Lectin的扩增产物滴加到胶体金检测卡。将ZSSⅡB基因的PCR扩增产物滴于试纸上,显色L8、L10+,Zein基因检测显色L9、L10+,表示这2个样品为玉米样品,而空白样本(不含待测样品DNA的反应体系)无显色,表示空白样本中不含玉米成分(图2)。同样,检测水稻样本中的SPS基因显色可以达到L10以上,表示该样品为水稻样品,而阴性对照非转基因玉米样品无显色则表示该样品不含水稻成分(图2);大豆样本内参基因同样显色度可达L10以上,表示该样品为大豆样品,阴性对照非转基因玉米样品无显色表示不含大豆成分(图2)。各内参基因检测结果良好,空白样本及阴性对照均无显色。其中ZSSⅡB基因检测玉米样本显色L8、L10+;Zein基因检测玉米样本显色L9、L10+;水稻SPS基因检测水稻样本,显色可以达到L10以上;而大豆内参基因检测大豆样本,显色亦可达L10以上;且在玉米样品中未检出水稻和大豆的内参基因。可见该方法可用于各类作物的内参基因检测,且特异性较好,不仅可用于实验对照结果及样品状态是否达标、核酸提取是否有效等检测结果有效性的判定,并可用于判定检测作物物种。

注:空—空白对照;NC—阴性对照。图2 玉米、水稻、大豆内参基因检测结果Fig.2 Detection results of maize, rice and soybean internal genes
2.2 转基因元件检测
将转基因元件启动子CaMV35S及终止子NOS的扩增产物滴加到胶体金检测卡,以不含待测样品DNA的反应体系为空白对照、非转基因玉米样品(京科968)为阴性对照。由图3可知,CaMV35S及NOS检测阳性样本T线及C线均存在明显条带显色,且显色度均达到L10以上,表明结果检测结果为阳性,即该样品检出转基因成分;而空白对照和阴性对照中T线均未出现肉眼可见显色,而C线出现明显显色,表明检测结果为阴性,即该样品不含有转基因成分。由此可见,转基因元件检测结果良好,证明该方法可成功检出各类转基因元件。
2.3 外源基因及特异性转基因事件检测结果
将抗虫基因Cry1Ab/1Ac、抗除草剂Bar、Pat、CP4-EPSPS及选择标记基因NPTⅡ、Pmi等外源基因的扩增产物滴加到胶体金检测卡,以不含待测样品DNA的反应体系为空白对照、非转基因玉米样品(京科968)为阴性对照。Cry1Ab/1Ac基因、NPTⅡ基因、Pmi基因、Pat基因检测结果中,阳性样本的T线和C线均出现肉眼可见显色,显色均在L10以上,表示成功检出上述基因;而阴性对照及空白样本T线未出现肉眼可见显色,C线出现肉眼可见显色,表示未检出转基因成分(图4)。这几类基因的检测显色对比度较强,显色强度较高,实验效果突出。而Bar基因、CP4-EPSPS基因检测结果中,阳性样本显色在L9以上,阴性对照及空白样本无显色(图4),也达到了可清晰辨识的检测结果要求。以上结果表明本方法可成功检出各类外源基因,结果特异性强、辨识度高。
将特异性转基因事件Mir604、Bt11的扩增产物滴加到胶体金检测卡,以不含待测样品DNA的反应体系为空白对照、非转基因玉米样品(京科968)为阴性对照。Bt11及Mir604这2个转基因事件经由特异性引物检测的结果判读均有L10+的显色度,同时不含对应转基因事件成分的阴性对照及空白对照T线均无显色(图4),可见该方法对事件特异性检测的结果判读清晰准确无误。
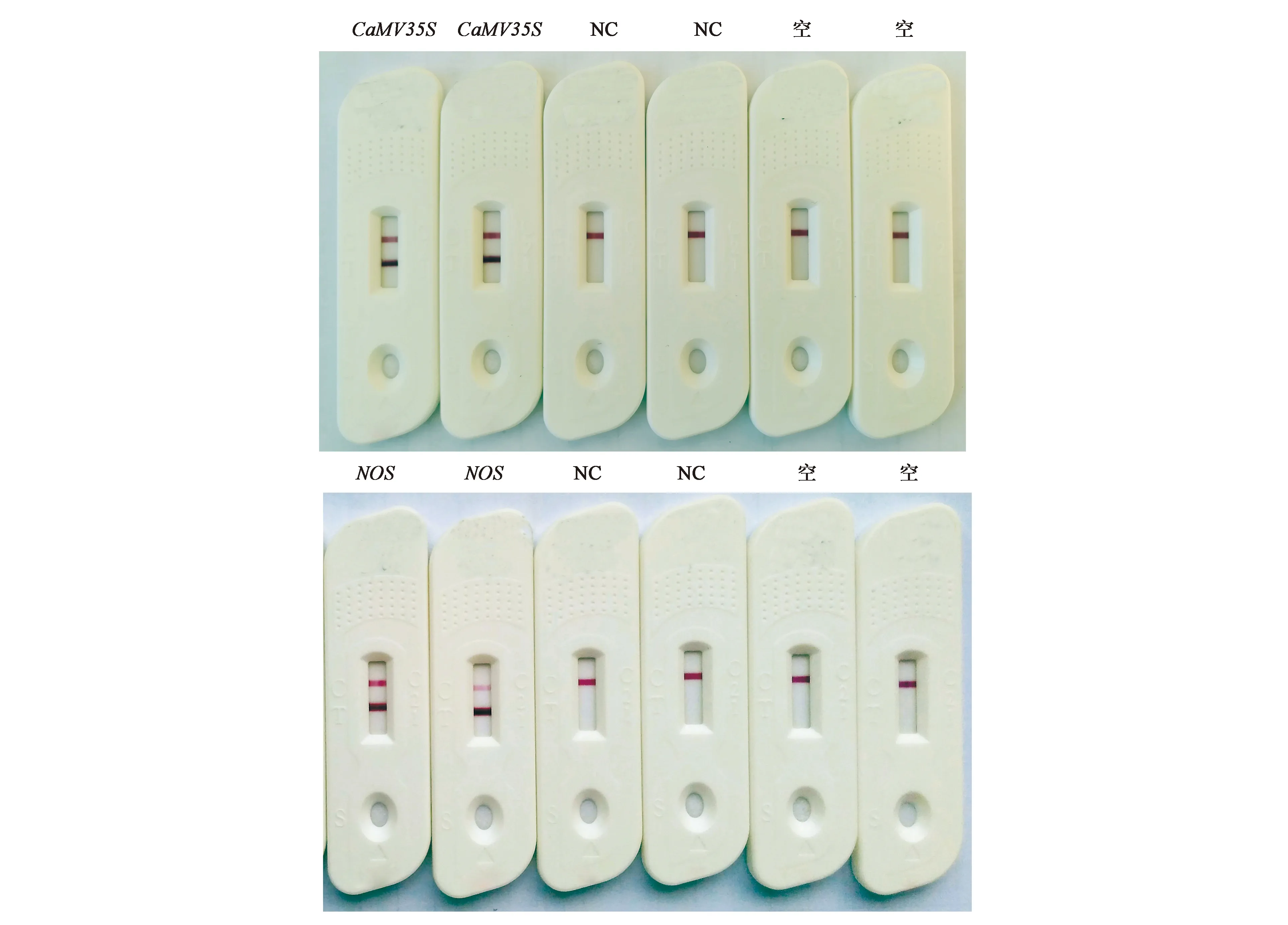
注:NC—阴性对照;空—空白对照。图3 CaMV35S启动子及NOS终止子检测结果Fig.3 Results of CaMV35S promoter and NOS terminator detection
3 讨论
随着全球越来越多的转基因植物商业化生产应用,各国对转基因产品管理与标识制度也随之日益完善,因而对转基因检测工作提出了更高的要求。为适应不断变化的市场和监管需求,发展转基因产品检测技术的关键就在于如何建立更高效、更高通量、更快速、更准确的转基因产品检测方法[19]。常用的蛋白质水平检测基于胶体金蛋白试纸技术,但是由于有些转基因样品蛋白质可能发生表达不完整、蛋白质降解、折叠变构等情况,均有可能造成假阴性结果。且该方法适用范围较窄,如启动子及终止子等转基因元件均无法检测,也无法进行特异性转基因事件判定,目前主要用于转基因植物的大田和原材料的快速初筛[20]。PCR方法是基于核酸水平的检测,但该方法对实验设施和条件要求较高,且比较费时,提取DNA这一步骤所用时间也是制约PCR检测效率和速度的一个主要环节[21]。
本研究提出了一种基于核酸层析法的转基因检测新方法,可特异性的检测出阳性转基因样品中抗虫基因Cry1Ab/1Ac、抗除草剂基因Bar、Pat、CP4-EPSPS及选择标记基因NPTⅡ、Pmi等外源基因,还可检出不同种类作物的内参基因,包括玉米内参基因ZSSⅡB及Zein,水稻内参基因SPS及大豆内参基因Lectin[22-23],且不同种类作物间内参基因检测特异性良好,无交叉反应。此外,一般试纸条检测法无法判读的转基因元件(例如CaMV35S启动子及NOS终止子),及转基因事件检测(Bt11及Mir604)也均获得了L9以上的清晰明显的显色,可明确判定出阳性样品。可见该检测方法无论是在内参基因、转基因元件、外源插入基因乃至转基因事件的检测中,均可准确、特异性的进行结果判读。表明本方法可取代常规PCR检测方法,覆盖常用作物转基因检测项目并进行有效检测结果判定。

注:NC—阴性对照;空—空白对照。图4 外源转入基因及事件特异性检测结果Fig.4 Detection results of exogenous gene transfer and event specificity
本研究将PCR检测与试纸条检测方法的优势进行聚合,通过省略了DNA提取步骤和简化检测读取步骤,大大缩减了PCR检测流程及所耗时间,且检测灵敏度高,能在模板DNA纯度很低的情况下进行PCR扩增,减少培养介质和生物学物质的影响。该方法检测时间仅需8~10 min;结果肉眼可见且判定标准统一,仅需一台便携PCR仪和相关试剂即可完成田间检测或流动检测,也极大简化了核酸水平检测的实验环境与实验环节的需求。但同时又可检出此前蛋白试纸等快速检测法无法覆盖的转基因元件检测及事件特异性检测,可检出非表达的转入基因、启动子及终止子元件等。此外由于该技术实现了快速可视化的PCR结果读取,避开凝胶电泳中EB等污染物,对操作者和试验环境都是安全无害的。因而该方法具有操作简便、灵敏度高、检测时间短、安全性高等显著优势,在转基因玉米、水稻、大豆等作物中均具有较大应用前景,在转基因新品种的培育中存在更大的应用前景和空间。
此外,该方法也可同时检测双基因样品。若在同一反应体系中进行多重PCR,则可在引物设计时使用不同的探针(如TAMRA等),并在试纸增加上包被相应检测T线,从而实现双基因检测,以延展使用范围。但在实验过程中,也发现该方法还存在一些局限性。在一些使用常规PCR也无法检验的材料盲区,如对储存条件不佳的种子或老叶片进行实验时,由于实验材料中的核酸已被破坏,因而即便是使用该方法也无法获得更好的检测结果。且该方法对于一些未存在检测标准的新基因和新转基因事件的检测[24],需重新设计引物并在专业实验室中进行多次常规PCR实验以调整并确认引物的有效性后方可使用层析法查验结果,因而在直接用于批量化检测前仍需一些预实验以调整实验条件达到满意的实验效果。此外,在本研究中,由于大豆及水稻转基因材料收集不足,未进行更多物种的更多转基因材料的实验以验证该方法的广适性。由于该方法在转基因检测领域尚属首次使用,为使其在转基因作物检测中获得更广泛的应用,后续仍需对该方法进行不断的补充、改进和完善。
