内镜黏膜下剥离术和外科手术治疗胃早癌的疗效对比研究
2020-12-08赵艳生朱金波李旭忠
赵艳生,朱金波,李旭忠
(濮阳市油田总医院,河南 濮阳 457100)
胃癌是一种较常见的恶性肿瘤,胃早癌即癌细胞浸润仅局限于胃壁黏膜和黏膜下层,与进展期胃癌相比,胃早癌患者的预后较为理想,所以及早发现和诊治胃早癌,能够极大地提升患者的五年生存率[1]。根治性外科手术是临床治疗胃癌的常用方法,外科手术虽然能较彻底地清除患者病灶,减少疾病复发,但是造成的创伤较大,且术中和术后并发症较多,不利于术后康复和生活质量的提高。随着内镜技术的不断进步,胃早癌患者的检出率也明显提高,如何有效提高胃早癌患者的治疗效果及安全性成为当前关注的重点[2]。为了解内镜黏膜下剥离术在胃早癌患者中的应用价值,本研究分析了不同手术方法治疗胃早癌的效果,报告如下。
1 资料与方法
1.1 一般资料
选择2017年1月—2019年1月经消化内镜等检查确诊的胃早癌患者100 例,根据手术方法不同分为两组,每组50 例。对照组给予外科手术治疗,观察组应用内镜黏膜下剥离术(ESD)治疗。观察组中男35 例,女15 例,年龄(57.2±4.6) 岁;高分化腺癌28 例,中分化腺癌14 例,低分化腺癌6 例,印戒细胞癌2 例。对照组中男33 例,女17 例,年龄(57.3±4.8) 岁;高分化腺癌27 例,中分化腺癌13 例,低分化腺癌7 例,印戒细胞癌3 例。所有患者术前接受内镜窄带成像术(NBI)、放大内镜及超声内镜和(或)CT检查,以评估病变的形态、大小和浸润深度等,明确是否存在壁外淋巴结肿大。两组患者的性别、年龄及病理类型等一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经我院伦理委员会批准,患者均知晓本研究并同意配合。排除严重肝肾功能障碍、心脏疾病、胃外转移和其他恶性肿瘤疾病患者。
1.2 治疗方法
所有患者术前均给予血常规、肝肾功能、心肺功能以及凝血功能等检查,进行全面的术前评估,必要时可对患者的病变转移情况进行评估。术前与患者家属做好沟通,交代手术注意事项及可能存在的风险,争取患者及家属的同意。
术前8 h禁食。观察组采用内镜黏膜下剥离术治疗:给予患者气管插管全身麻醉,于病变外缘0.5 cm的位置逐步进行环周标记,并在标记点外侧实施黏膜下注射,将肌层与黏膜层分开后,抬起病变区域[3]。沿病变标记点切开黏膜,逐层剥离黏膜下层间隙。术中如果出现少量渗血给予热凝即可,一旦出现大量出血,可使用含肾上腺素的生理盐水反复冲洗,确定出血点后使用止血夹止血或热凝止血,避免盲目止血。术中出现穿孔的患者,应对穿孔部位及严重程度进行分析,使用金属夹夹闭后再实施剥离,小范围的穿孔可在内镜下完成处理,对于大范围的穿孔则需要联用腹腔镜处理[4]。术后禁食1~2 d,之后逐渐从流质饮食过渡到半流质和正常饮食,严密监测患者生命体征变化情况,并做好并发症预防。
对照组采用根治性外科手术治疗:做好常规术前处理后,根据患者的身体状况和病变程度,选择合适的手术方式(包括全胃切除术、根治性远端/近端胃大部切除术),严格根据手术具体步骤进行操作,完整切除患者的病变部位,给患者家属展示后送病理科检查。患者术后均禁食和维持胃肠减压3~5 d,严密观察患者病情及腹腔引流情况,给予常规抑酸、营养支持和抗感染等治疗,积极预防并发症发生。
1.3 观察指标
随访6 个月,癌症患者健康状况用生活质量指数量表(QL-Index)进行评价,主要包括患者活动、健康、支持、日常生活和总体情况等维度,得分为0~10 分,得分越高表明患者的健康状况越佳。应用生活质量调查表(QLQ-C30)中的功能量表和整体生活质量量表评定两组患者的生活质量。功能量表由躯体、认知、角色、情绪和社会功能等维度构成,得分越高越好[5]。应用医院焦虑抑郁评分量表(HADS)对患者的心理状况进行评分,分为焦虑和抑郁两个维度,8~10分为临界状态,≤7分为正常,得分≥11分为严重焦虑或抑郁状态。应用匹兹堡睡眠质量调查问卷(PSQI)评定患者的睡眠质量,高于7分表示患者存在睡眠障碍。比较两组患者的3年生存率、复发率和转移情况。治愈性切除(日本胃癌协会)要求切除的病灶同时满足以下条件。第一,病变没有淋巴脉管浸润。第二,病变侧切缘和基底都没有瘤细胞残留。第三,满足日本胃癌协会提出的ESD适应证标准:肿瘤大小不限的无溃疡的分化型黏膜内癌;直径≤30 mm的有溃疡的分化型黏膜内癌;直径≤30 mm,无溃疡形成,无淋巴结及血行转移的黏膜下浸润<0.5 mm的分化型黏膜下癌;无溃疡形成,直径<20 mm的低分化型黏膜内癌。当肿瘤未达到治愈性切除标准时,则加行外科手术治疗。
1.4 统计学方法
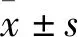
2 结 果
2.1 两组术后并发症比较
观察组术后6个月并发症发生率为8%,显著低于对照组的26%,两组比较差异有统计学意义(χ2=5.740 6,P<0.05)(见表1)。

表1 两组术后并发症比较 例(%)
2.2 两组健康状况比较
术后6 个月观察组患者的QL-Index各维度评分均显著高于对照组,差异有统计学意义(P<0.05)(见表2)。

表2 两组QL-Index评分比较分
2.3 两组术后生活质量比较
观察组术后6个月的整体生活质量评分以及角色、躯体、认知、情绪和社会功能评分均高于对照组,差异有统计学意义(P<0.05)(见表3)。

表3 两组整体生活质量量表与QLQ-C30的功能量表评分比较分
2.4 两组术后心理状况及睡眠质量比较
两组术后6个月HADS焦虑评分比较,差异无统计学意义;但观察组HADS抑郁评分和PSQI评分明显低于对照组,差异有统计学意义(P<0.05)(见表4)。

表4 两组术后6个月HADS与PSQI评分对比分
2.5 两组复发情况及3 年生存率比较
对照组随访期间没有出现复发,观察组随访期间复发2 例,其中1 例行外科手术后痊愈,1 例行ESD治疗后痊愈。观察组与对照组的3 年生存率分别为97.0%与96.0%。两组复发率与3年生存率比较,差异均无统计学意义(P>0.05)。
3 讨 论
胃癌在临床较为常见,是影响人们生活质量和生命安全的常见恶性肿瘤之一,与中晚期胃癌相比,胃早癌的治疗难度更小,预后更好[6]。研究报道[7],早期胃癌实施内镜下根治术治疗的5 年生存率可达90%以上,所以及早发现和诊治胃早癌在提高患者5 年生存率和改善患者预后方面有着重要意义。根治性外科手术虽然能够彻底清除病灶,达到根治疾病的效果,但是不可否认该手术方式会给患者造成较大创伤,增加并发症发生风险,影响患者术后恢复,还会对术后生活质量和睡眠质量等造成不良影响[8]。内镜黏膜下剥离术主要是完整切除胃肠道的浅表肿瘤,从而达到治疗效果,能够有效弥补传统外科手术的不足。该手术方法不仅可以有效治疗黏膜内肿瘤,而且对部分黏膜下肿瘤也具有较好疗效,不会受到肿瘤大小的限制,可一次性完整切除病灶,减少病变残留,从而减少局部病变复发[9]。但是该手术方法也存在一定局限性,内镜黏膜下剥离术治疗无法实施淋巴结清扫,所以这也是影响该手术根治治疗效果的重要因素。只有在患者的淋巴结转移风险基本可以忽略时,或者外科手术造成的创伤过大,无法获得较好疗效时才会采用该手术方法治疗[10]。肿瘤是否会出现淋巴结转移,较大程度上取决于肿瘤的浸润深度,所以通过术前确定浸润深度,评估肿瘤进展程度,能够为临床手术方式的选择提供依据[11]。当前普遍认为无淋巴结和血行转移是内镜黏膜下剥离术的适应证,只要未出现淋巴结和血行转移,不论病灶在哪个位置、大小如何,均可实施内镜黏膜下剥离术[12]。有研究报道[13],胃早癌的淋巴结转移率通常为8%~20%,对于直径较小的黏膜下层癌,其淋巴结转移风险更小。所以,只要术前做好充分的淋巴结转移风险评估,大部分胃早癌患者均适合采用内镜黏膜下剥离术。
临床在实施内镜黏膜下剥离术时,首先应确定病灶范围,对病灶边缘做好标记,然后实施环周切开,给予黏膜下剥离操作,达到安全切除肿瘤的效果。内镜黏膜下剥离术常见并发症包括术中出血和术后继发性出血。导致患者出血的原因较多,有资料显示,病变直径达到4 cm以上的胃癌患者,实施内镜黏膜下剥离术的出血风险会明显增加[14]。充分的术前评估、严格遵循手术适应证是减少患者术中和术后出血的关键。人体健康包括生理、心理和社会三个方面,只有三者均处于良好状态,才能使患者的身心达到最佳状态,获得更高的生活质量。与传统手术方式相比,内镜黏膜下剥离术给患者造成的创伤小、术后恢复快,更容易被患者所接受和认可,因此在临床得到越来越广泛的应用[15]。有研究报道[16],在胃早癌患者中应用内镜黏膜下剥离术具有显著优势,能够在较大程度上改善患者心理状况,加速恢复患者机体功能,提高睡眠质量和生活质量。本研究中,观察组术后并发症发生率为8.0%,明显低于对照组的26.0%,且两组患者术后的QL-Index各维度评分、生活质量评分、抑郁评分以及PSQI评分比较,均具有显著性差异,说明胃早癌患者应用内镜黏膜下剥离术治疗的效果显著,可有效减轻患者手术创伤,减少并发症发生,改善患者身体状况,减轻患者不良情绪,提高患者生活质量和睡眠质量。
