髓系来源抑制细胞在舌鳞状细胞癌中的作用
2020-12-08钟文德邓小燕陈广盛
钟文德 邓小燕 陈广盛
1广州医科大学附属第二医院(广州510260);2广州医科大学金域学院(广州510260)
在我国,舌癌患者以男性居多,大部分为舌鳞状细胞癌(tongue squamous cell carcinoma,TSCC)[1]。TSCC是口腔恶性肿瘤中最具侵袭性的一种,占口腔癌的41%。尽管在多模式诊断和治疗技术上有了相当大的进步,TSCC仍然是头颈部最致命的癌症类型之一[2]。肿瘤细胞可通过多种途径来抑制抗肿瘤免疫应答,诱导免疫耐受,而针对髓系来源抑制细胞(myeloid-derived suppressor cells,MDSC)的免疫治疗可能是对TSCC行之有效的新治疗策略。MDSC是指在病理情况下,髓系细胞发育受阻而聚集的一群具有免疫抑制功能的异质性细胞,是肿瘤诱导免疫耐受的重要参与者[3-5]。既往研究[6]显示舌癌患者外周血中MDSC细胞比例与临床分期和病理分级正相关,提示MDSC可能是促使舌癌患者病情恶化的重要原因,然而目前具体机制尚不明确。因此,进一步探究MDSC在舌癌免疫学发病机制中的作用,对舌癌免疫治疗的应用和推广有重要意义。
1 材料与方法
1.1 标本收集选取2017年1月至2019年12月广州医科大学附属第二医院收治的舌癌(tonguecancer,TSCC)患者。纳入标准:(1)年龄25 ~75岁;(2)均经病理学确诊为舌癌。排除标准:合并其它系统严重疾病的患者。依据纳入和排除标准,共纳入40例舌癌患者,其中男28例(70%),女12例(30%);临床生长方式分为溃疡型20例(50%),外生型11例(27.5%)以及浸润型9例(22.5%);临床分期根据TNM分期分为早期(Ⅰ期与Ⅱ期,共18例,占45%)与晚期(Ⅲ期与Ⅳ期,共22例,占55%);根据肿瘤细胞的分化等级,中分化最多20例(50%),其次为低分化15例(37.5%),高分化为5例(12.5%);颈淋巴结转移17例(42.5%),非转移23例(57.5%);有吸烟史、饮酒史的患者为35例(87.5%)。同时选取了年龄段接近的健康对照(healthy control,HC)51例,其中男31例(60.8%),女20例(39.2%),两组间男女比例、年龄差异均无统计学意义(P >0.05)。
1.2 主要试剂流式抗体CD45(APC-Cy7)、CD11b(PE-CF594)、CD33(BV421)、HLA-DR(PE -Cy7)、CD15(FITSCC)、CD4(PE)、CD8(APC)购自Biolegend公司;Trizol、ROS-DCF、S100A8及S100A9抗体购自Invitrogen公司。Western抗体β-actin、iNOS、Arg1、NOX2、S100A9购自Abcam公司。NOHA、LNMMA、NAC、CFSE、Ficoll分离液与胶原酶Ⅳ购自Sigma公司。
1.3 外周血分离PBMC 及MDSC 的流式检测抽取静脉血,用含EDTA抗凝管的采血管收集,加入等体积PBS混匀;用吸管将血稀释液缓慢加入到淋巴细胞分离液Ficoll上层,18 ℃离心25 min;吸取白膜层,加PBS进行离心,裂解红细胞,得到外周血单个核细胞(peripheral blood mononuclear cell,PBMC)。取约5 × 106细胞进行流式染色,按照抗体说明书进行抗体孵育,进行流式上机检测,收集数据后使用Flowjo软件进行分析。
1.4 T 细胞增殖实验流式分选CD3+的T细胞与MDSC(HLA-DR-CD11b+CD33+)[7],将CD3+T细胞重悬于预热的PBS+0.1%BSA中,加入CFSE(终浓度为2.5 μmol/L);37 ℃孵育15 min后,终止染色;将T细胞与MDSC以不同的比例(1∶0、1∶8、1∶4、1∶2)进行共培养。并同时加入精氨酸酶抑制剂NOHA(100 μmol/L)、iNOS抑制剂L-NMMA(100 μmol/L)、ROS抑制剂NAC(1 mmol/L)处理,3 d后收集细胞进行CD4+和CD8+ T细胞进行染色,进行流式检测其增殖情况。
1.5 舌癌组织中单个核细胞的分离及流式检测将肿瘤及癌旁组织剪碎,充分研磨后过滤到离心管中,加入1 mg/mL的胶原酶Ⅳ进行消化,消化条件为37 ℃,210 r/min,消化30 min,随后4 ℃450×g离心5 min去上清,红细胞裂解液加至2 mL裂解约2 ~3 min,PBS冲洗并重悬至单细胞悬液,取约5×105细胞进行流式抗体标记以及流式检测。
1.6 qRT-PCR 与Western blot 检测收集分选的MDSC样品,参照Invitrogen公司的Trizol试剂使用说明书进行操作(qRT-PCR)。检测基因序列见表1。Western蛋白印迹法实验使用分选的MDSC细胞进行,按照相应的说明书进行抗体的孵育以及条带检测。

表1 MDSC 分选qRT-PCR 引物Tab.1 Primers for MDSC separation
1.7 统计学方法采用GraphPad Prism version 7.0a统计软件进行统计分析,统计结果以均数±标准差表示,使用非配对的t检验和ANOVA分析进行结果统计分析,P <0.05为差异有统计学意义。
2 结果
2.1 TSCC患者外周血MDSCs水平增高与HC相较,TSCC患者外周血PBMC中MDSC水平出现显著上升,比例如下:HC组(2.328±0.333 1),早期组(Early,8.29±1.791),晚期组(Late,13.56±1.456)。与HC组相比,早期组显著升高,差异具有统计学意义(P <0.001);与早期组相比,晚期组出现增加,差异具有统计学意义(P=0.022 8,图1A、B)。该群细胞表达CD15,主要表现为多形核MDSC(PMNMDS)。S100A8与S100A9已被证实为调控MDSC发育与功能的重要因子,本研究使用流式分析发现S100A8与S100A9在舌癌患者MDSC中表达水平呈现增加(图1C)。
2.2 TSCC患者外周血MDSCs抑制T细胞增值肿瘤中的MDSC具有很强的免疫抑制作用[8]。为了验证TSCC中MDSC的功能,笔者进行了T细胞增殖实验。将分选出来的CD3+ T细胞与MDSC细胞从PBMC中分选出来进行共培养。T细胞增殖实验结果显示,正常人体内的MDSC无明显抑制功能,而TSCC患者中MDSC具有较强的免疫抑制作用(T:MDSC比例为1∶4及1∶2时),提示TSCC外周血中的MDSC细胞具有较强的抑制T细胞应答的能力(图2A、B)。
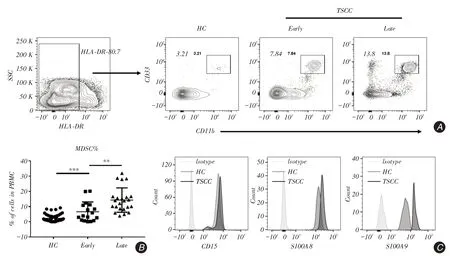
图1 流式细胞术检测舌癌患者外周血PBMC 中MDSC 的水平Fig.1 Detection of MDSC in TSCC patients′peripheral blood by Flow cytometry

图2 T 细胞增殖实验结果Fig.2 The result of T cell proliferation assay
2.3 TSCC 患者MDSC 通过增加ROS 水平抑制T细胞增值在共培养的实验组中加入了不同的通路抑制剂,发现加入ROS抑制剂后T细胞抑制功能得到了恢复,而使用其他抑制剂处理后无明显改变(图3A)。流式分选健康对照及TSCC患者PBMC中的MDSC细胞,进行mRNA水平的检测,发现与ROS相关的转录因子NOX2在舌癌组中表达增高(P = 0.004 5),S100A9作为阳性对照基因(图3B)。Western blot检测结果显示,在蛋白质水平NOX2表达也显著增高,与mRNA水平的结果相一致(图3C)。同时,利用流式细胞术对MDSC中的ROS进行检测,发现与健康对照相比,舌癌患者MDSC细胞中ROS含量显著增加[HC为(47.4±5.492),TSCC为(73.67±4.388),P=0.020 2,图3D、E]。
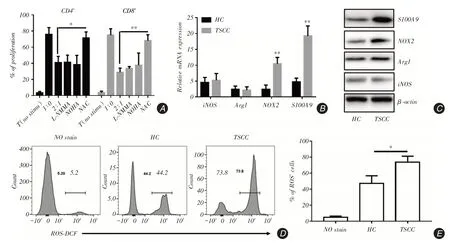
图3 舌癌患者中MDSC 主要依赖于ROS 途径来实施T 细胞抑制功能Fig.3 T cell inhibited by MDSC mainly relies on ROS pathway in TSCC patients
2.4 TSCC 患者肿瘤组织中MDSC 表型分析肿瘤及癌旁组织中消化分离得到细胞后,进行流式检测。发现舌癌患者肿瘤组织以及相应的癌旁组织免疫细胞分离结果显示与癌旁组织相比,肿瘤中存在较高水平的MDSC,且表型与外周血中基本一致,说明在肿瘤微环境中MDSC可能发挥着重要的抑制功能。
3 讨论
舌癌作为口腔颌面部的恶性肿瘤之一,其发病严重影响患者的生活,且该病具有发病年轻化的趋势。基于肿瘤免疫的迅速发展,免疫治疗是舌癌潜在的有效治疗方法。研究[9]表明人体MDSC表达CD11b和CD33,缺乏成熟髓系细胞表面分子HLA-DR,其水平与多种肿瘤发生发展密切相关,肿瘤中的MDSC通常具有很强的免疫抑制作用,靶向MDSC已成为肿瘤免疫治疗的新策略。在口腔鳞癌以及食管鳞癌患者外周血中,存在较高水平的MDSC比例,这一现象在小鼠模型中也得到了验证[10-11]。目前认为S100A8和S100A9蛋白是MDSC的特征性蛋白,是促进MDSC扩增和活化的主要分子[12]。
人类MDSC表型在不同的肿瘤中有不同的表现。人类MDSC亚型主要是由表达不同的表面标记物CD14和CD15来区分[13]。这两个亚群的区别主要在于它们的功能,组织分布和调节机制不同[14-15]。有趣的是在绝大多数肿瘤模型中,肿瘤诱导的PMN-MDSC细胞占总MDSC的70%~80%[16]。PMNMDSC通过高表达ROS,从而抑制T细胞的增殖,而M-MDSC通过高表达NO抑制T细胞的增殖。本研究发现在舌癌患者的外周血和肿瘤组织中,MDSC细胞表达水平出现显著增高,且随着病情进展呈现出上升趋势。该群细胞主要表达CD15以及MDSC的特征性蛋白S100A8及S100A9,说明该群细胞主要为粒细胞型MDSC。与正常人外周血的MDSC比较,舌癌患者中MDSC具有较强的抑制T细胞应答的能力,提示在舌癌相关的肿瘤微环境中MDSC可能发挥着重要的免疫抑制功能,从而在促进肿瘤细胞的免疫逃逸中起重要作用。因此,舌癌患者中MDSC细胞不仅表现为比例的增加,还表现为功能活性的增强。因为MDSCs拥有广谱的免疫抑制活性,在得到可靠结论之前,它们对其他类型的免疫细胞的影响仍然需要被证实。
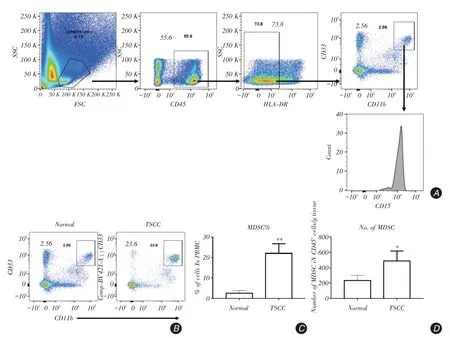
图4 流式检测舌癌肿瘤组织中MDSC 的水平Fig.4 Detection of MDSC in TSCC tissues by flow cytometry
基于以上结果,笔者进一步对参与其中的分子机制进行研究,通过加入不同的通路抑制剂与舌癌患者的MDSC与T细胞共培养,发现ROS的抑制剂可以阻断该群MDSC对T细胞增值抑制的能力,提示舌癌患者中的MDSC可能主要依赖于ROS途径来发挥T细胞抑制功能。MDSC通常通过高表达精氨酸酶1(ARG1)和诱导型一氧化氮合酶(iNOS)来发挥T细胞抑制功能,另外,在肿瘤中,MDSC中NADPH氧化酶(NOX2)表达上调,产生活性氧(reactive oxygen species,ROS);ROS可抑制T细胞受体(TSCCR)中CD3ζ的表达,进而抑制肿瘤抗原特异的T细胞反应[17-18]。以上研究成果为本次实验结果提供了有力的理论基础。以往研究证实多种炎症相关因子(如GM-CSF,IL-6,IFN-γ等)促进了MDSC的扩增和活化[19]。在分子层面,目前认为STAT-3、C/EBPβ、IRF8、Cox-2及S100A9等参与MDSC扩 增[20-21],而STAT-1[22]、NF-κB[23]、STAT-6[24]等则主要调控MDSC活化。其中,钙结合蛋白S100A9是调控MDSC扩增的重要分子,缺失S100A9可促进髓系细胞向下游分化,反正过表达S100A9则促进MDSC的扩增[25]。
综上所述,本研究结果显示舌癌患者的MDSC细胞中S100A9的表达水平明显增高,提示舌癌促进了MDSC的扩增与活化,并且后续发现这一功能与细胞内产生的活性氧ROS密切相关,这一结果为MDSC在舌癌免疫治疗中的潜在应用价值提供了新的思路,然而MDSC在舌癌发病机制中的具体作用仍有待进一步的探索。
