利用CRISPR/Cas9技术抑制Gp96的表达对小鼠酒精性肝纤维化过程中α-SMA和TGF-β1表达的影响
2020-12-08朱文枫李三强宋晓改张兵兵王玉东代新华袁旭静朱永基
朱文枫,李三强,宋晓改,郭 威,杨 欢,张兵兵,王玉东,代新华,袁旭静,朱永基
河南科技大学医学院肝脏损伤与修复分子医学重点实验室 河南省肝病防治工程技术研究中心,河南 洛阳 471000
近年来,酒精所引起的肝脏疾病越来越受到大众的关注,酒精性肝纤维化是由于长期大量饮酒所导致的肝脏不可逆的慢性病变过程[1],具体机制是由于胶原纤维Ⅰ和胶原纤维Ⅲ在降解与合成两方面失衡所致[2],导致胶原纤维组织反复瘢痕修复的过程,是酒精性肝硬化的前期过程,逐步发展为肝硬化,最终导致肝癌。葡萄糖调节蛋白96(Gp96)是热休克蛋白家族的重要成员[3],又叫HSP90bⅠ。与癌症相关的研究报道,Gp96在其发生、发展中起到重要的调控作用[4],但与肝损伤相关的研究甚少,且靶向抑制Gp96表达后对肝脏的意义未见研究。CRISPR/Cas9[5]技术是一种新型的基因编辑技术,利用Cas9核酸酶指导向导RNA(sgRNA)对外来基因进行定向切除,以抵御外源DNA入侵,具有灵活性强,可同时沉默任意数量靶基因等优点。我们实验室前期研究发现,在肝损伤过程中,Gp96通过调节葡萄糖的氧化还原过程可以使肝损伤程度减弱[6],所以在此基础上探索靶向抑制Gp96对慢性酒精性肝损伤是有必要的。NF-κB通过调控Gp96的表达,也对肝纤维化进程也产生了一定的保护作用。本课题探究在肝纤维化进程中,利用CRISPR/Cas9技术抑制Gp96的表达对平滑肌肌动蛋白(α-SMA)和转化生长因子-β1(TGF-β1)表达所产生的影响,注射NF-κB抑制剂PDTC阻断该信号通路,检测肝纤维化指征因子Gp96与肝星状细胞(HSC-T6)活化程度指标α-SMA和TGF-β1,以探索Gp96所起的保护作用与HSC-T6细胞活化的具体分子机制之间的联系,旨在为酒精性肝纤维化的防治提供新的思路。
1 材料与方法
1.1 材料
1.1.1 实验动物:健康雄性C57BL/6J清洁级小鼠220只,品系为C57BL/6J,由黑龙江实验动物中心提供,动物许可证号:SCXK(辽)2015-0001。
1.1.2 试剂:Lieber-DeCarli正常对照组液体饲料和Lieber-DeCarli酒精液体饲料,由南通特洛菲饲料科技有限公司提供(货号:TP4030A和TP4030C);抗Gp96单克隆一抗(货号:sc393402),抗β-actin单克隆一抗(货号:sc47778),由美国圣克鲁斯Santa Cruz公司提供;HRP辣根过氧化物酶标记的二抗,包括小鼠抗β-actin单克隆抗体(货号:TA-09),山羊抗小鼠(抗Gp96和抗TGF-β1,货号:ZB-2305),山羊抗兔(抗α-SMA货号:ZB-2301)三种类型,由北京中杉金桥生物技术有限公司提供;丙氨酸氨基转移酶(ALT)检测试剂盒(货号:XYA207Mu),由上海信裕生物科技有限公司提供;天狼猩红(胶原纤维)染色试剂盒(货号:S8060)、蛋白预染Marker(11-180KD)(货号:PR1910)、ECL超敏化学发光试剂盒(货号:PE0010),由北京索莱宝生物科技有限公司提供;质粒中提试剂盒(货号:D6915-03),由OMEGA科技有限公司提供;氨苄(货号:A8180-5g),由北京索莱宝生物科技有限公司提供;Tween20(吐温20)(货号:T8820),由北京索莱宝生物科技有限公司提供。
1.1.3 仪器:CX31RBSF光学显微镜,奥林巴斯(中国)有限公司;君意300C电泳仪,北京君意东方电泳设备有限公司;Tanon曝光显影呈相仪,由上海天能Tanon科技有限公司提供;石蜡Leica半自动组织切片机(RM2128),由德国徕卡有限公司提供;酶标仪,由美国BioTek公司提供;微量移液器,由德国Eppendorf公司提供;日立全自动生化分析仪7180。ST250制冰机,北京恒光信息技术有限公司提供。
1.2 实验方法
1.2.1 构建肝纤维化动物模型:选取健康雄性C57BL/6J小鼠220只,随机分为4组。正常对照组(n=10),生理盐水+酒精诱导纤维化组(单纯酒精组,n=70),尾静脉注射质粒Gp96-sgRNA3+酒精诱导肝纤维化组(Gp96-sgRNA3组,n=70),腹腔注射核转录因子-κB(NF-κB)抑制剂吡咯二硫氨基甲酸酯(PDTC)+酒精诱导肝纤维化组(NF-κB抑制剂,n=70)。正常对照组小鼠喂养Lieber-DeCarli对照液体饲料TP4030C达8周(最终第8周n=10)。生理盐水+酒精诱导纤维化组小鼠喂养Lieber-Decarli酒精液体饲料TP4030A达8周,于每周一、周三上午8点对每只小鼠尾静脉注射生理盐水0.2 ml且联合第5周5%CCl40.05 ml灌胃(最终第8周n=9)。Gp96-sgRNA3组小鼠同样喂养Lieber-DeCarli酒精液体饲料TP4030A达8周,于每周一、周三上午8点对每只小鼠进行尾静脉注射Gp96-sgRNA3质粒0.2 ml,于第5周开始,间隔1 h后行5% CCl4灌胃0.05 ml到第8周(最终第8周n=7)。NF-κB抑制剂组小鼠喂养相同Liber-Decarli酒精液体饲料TP4030A达8周,于每周一、周三上午9点对每只小鼠进行腹腔注射NF-κB抑制剂PDTC,剂量为0.15 ml,浓度为1.65 g/L,于第5周开始,间隔1 h后行5% CCl4灌胃0.05 ml,到第8周(最终第8周n=6)。于第8周的周六上午8点眼球取血处死各组小鼠,血清5 000 r/min,10 ℃,离心20 min,测酶活性指标。
1.2.2 血清酶活性指标ALT的检测:使用全自动生化分析仪7180检测血清中ALT的活性。
1.2.3 石蜡切片:取出肝脏,胆囊剪掉,用1×PBS磷酸盐缓冲液将残留血液冲净至肝脏发白,大小叶剪开,将整齐的大叶浸入10 ml EP管中并用10%甲醛浸泡6~8 h后,修剪肝大叶成方型,而后浸泡达24 h且小流水冲24 h,完成梯度逐级过度,使组织透明化。再于70 ℃温箱进行包埋,包埋好的组织块放入4 ℃冰箱24 h后进行病理组织石蜡切片,先2倍速度修片,待呈现出相对完整的组织后,正式切片,厚度设置为4 mm,先30%乙醇展片,再65 ℃水浴将片完全伸展,用提前泡酸洗净烘干备用的玻璃片捞片,在65 ℃条件下烤片1 h,再脱蜡水化。
1.2.4 天狼猩红(胶原纤维)染色:切片滴加试剂A:氧化剂,于湿盒中放置10 min,小流水冲5 min,滴加试剂B:胶原纤维染液,置于湿盒中在37 ℃温箱中孵育1 h,然后小流水冲5 min,再滴加试剂C:苏木素溶液,于湿盒中滴染2 min后,立即用试剂D:酸分化液分化2 s,而后立即蘸入净水中使反应终止,接着用小流水返蓝20 min,试片镜下观察胞核呈清澈蓝色,行逐级脱水,最后封片观察。
1.2.5 肝细胞坏死率得分统计方法:采用ImagePro Plus 6.0软件对每只小鼠至少10 mm2的肝脏切片组织进行测量分析。显微镜100倍视野下观察组织坏死率,0级:未见坏死;1级:1至2处坏死;2级:2处以上坏死;3级:大片坏死区域。
1.2.6 蛋白免疫印迹(Western blotting):用BCA试剂盒测不同组蛋白吸光度值,用标准曲线换算出蛋白浓度,按50 μg总量计算出各组点样量。100 μl蛋白加5×溴酚蓝25 μl混匀后,煮蛋白5 min。配制SDS-PAGE分离胶与浓缩胶(Gp96为8%分离胶,β-actin,α-SMA和TGF-β1为10%分离胶),待胶凝固后拔梳子见清晰条带并将煮好蛋白点样,进行电泳,80 V电压下,浓缩到同一界限,换120 V电压使蛋白跑散,待电泳到底部后进行电转,将分离胶根据目标因子分子量的不同,按蛋白预染Marker(solarbio 11~180 kD)显示出的不同区带切割,放入电转仪上,形成滤纸-NC膜-切割胶的“三明治”结构,冰上湿转2 h。电转结束后洗膜,奶粉封闭1 h,洗膜,一抗(Gp96/α-SMA/TGF-β1/β-actin:PBST=1∶500)孵育1 h,洗膜,二抗(山羊抗小鼠:PBST=1∶500,山羊抗兔:PBST=1∶500,小鼠抗β-actin:PBST=1∶500)孵育1 h,洗膜,用ECL超敏发光液(A液∶B液=1∶1),在Tanon显影呈相仪下曝光,将β-actin作为内参,用Gel-Pro Analyzer 4.0软件进行定量分析,AU代表任意单位。
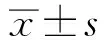
2 结果
2.1 血清ALT含量的变化与正常对照组相比,其他三组的ALT含量显著上升(P<0.01),肝纤维化显著加重;与单纯酒精组相比,Gp96-sgRNA3组和NF-κB抑制剂组ALT含量显著上升(P<0.01),肝纤维显著加重,与Gp96-sgRNA3组相比,NF-κB抑制剂组ALT含量升高(P<0.05,见图1)。
注:与正常对照组相比,**P<0.01。与单纯酒精组相比,##P<0.01。与Gp96-sgRNA3组相比,&P<0.05。每次实验重复3次。
2.2 天狼猩红染色镜下示,与正常对照组相比,其他三组红色胶原纤维含量异常丰富,肝细胞坏死显著增多(P<0.01);而与单纯酒精组相比,Gp96-sgRNA3组和NF-κB抑制剂组红色胶原纤维分布广泛,含量显著增加,肝细胞坏死显著增多(P<0.01),与Gp96-sgRNA3组比较,NF-κB抑制剂组肝纤维含量丰富,肝细胞坏死增多(P<0.05)。

注:与正常对照组相比,**P<0.01。与单纯酒精组相比,#P<0.05, ##P<0.01;与Gp96-sgRNA3组比较,&P<0.05。
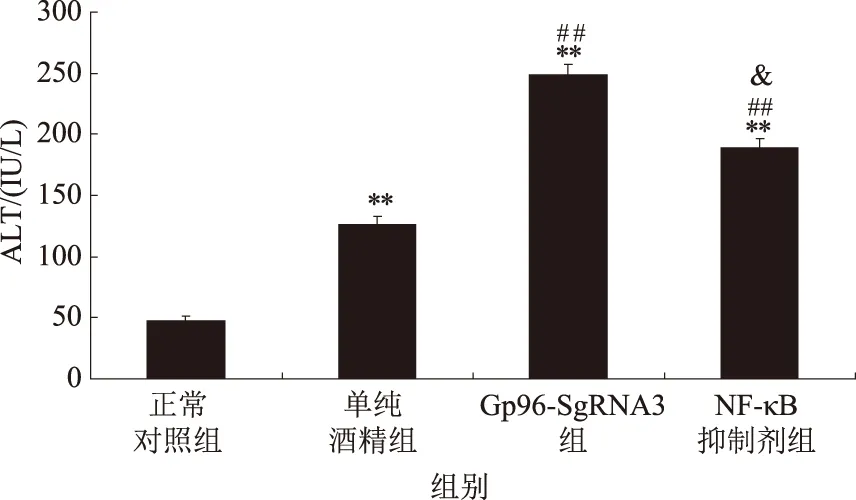
2.3 Western blotting检测不同组小鼠α-SMA和TGF-β1的变化与正常对照组相比,单纯酒精组α-SMA和TGF-β1表达显著升高(P<0.01);Gp96-sgRNA3组α-SMA和TGF-β1表达最为显著(P<0.01);NF-κB抑制剂组α-SMA和TGF-β1表达受抑制(P<0.01),提示Gp96表达受抑制与NF-κB的调控受抑制有关,HSC-T6活化与增殖受抑制,肝脏纤维化程度加剧(β-actin作为内参)(见图3)。
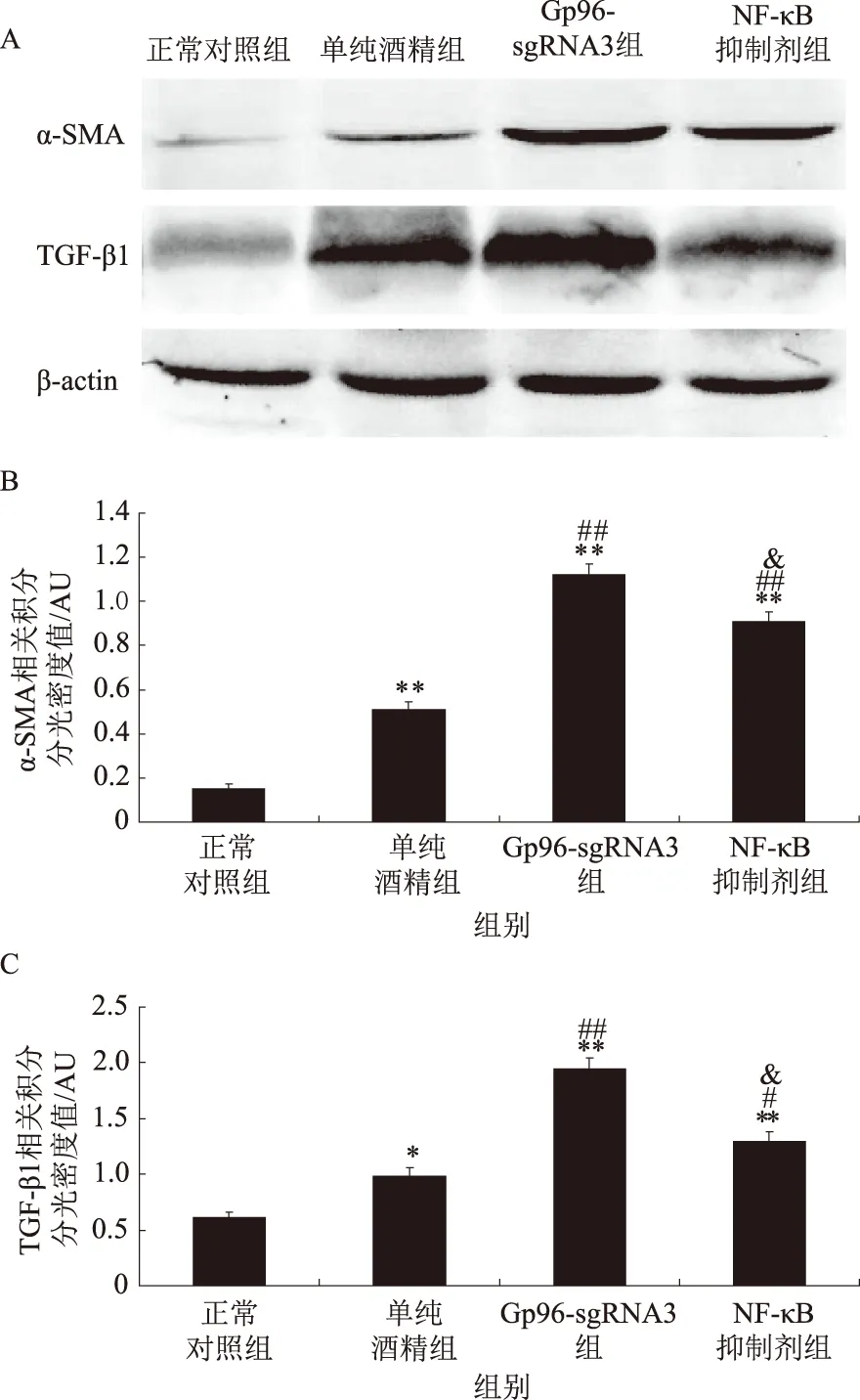
注:用Gel-Pro Analyzer 4.0软件进行定量分析,AU代表任意单位。与正常对照组比较,*P<0.05, **P<0.01; 与单纯酒精组比较,#P<0.05,##P<0.01; 与Gp96-sgRNA3组比较,&P<0.05。
3 讨论
Gp96是热休克蛋白家族重要成员,与肿瘤的侵袭、发生、转移有重要联系,可与抗原肽结合,加工提呈肿瘤抗原,从而稳定内环境;其氧化还原过程也直接与肝脏纤维化发生的具体分子机制密切相关,作为分子伴侣,协同完成细胞代谢及生长发育过程;与细胞内的其他肽类蛋白质结合,参与细胞的损伤修复、热耐受的过程。模拟人类酒精性肝纤维化形成的漫漫过程,我们实验室构建了以酒精液体饲料喂养小鼠8周联合CCl4的灌胃的经典模型,旨在探索酒精性肝纤维化防治的新思路。
我们的结果首次发现,Gp96表达受抑制,酶活指标显著上升,酒精性肝纤维化加重,α-SMA和TGF-β1的表达也显著上升。酶活性指标ALT显示,与正常对照组相比,其余三组ALT含量显著上升,与单纯酒精组相比,Gp96-sgRNA3组和NF-κB抑制剂组ALT的含量上升的更为明显;天狼猩红染色显示,与正常对照组相比,其余三组胶原纤维含量异常丰富,而与单纯酒精组相比,Gp96-sgRNA3组和NF-κB抑制剂组胶原纤维分布更为广泛;免疫蛋白印迹显示,与正常对照组相比,其余三组α-SMA与TGF-β1表达显著,而与单纯酒精组相比,后两组表达更为显著。α-SMA[7]在酒精性肝纤维化过程中,是促进HSC-T6[8]活化的标志物,肝星状细胞的激活[9]促进肝纤维化是以α-SMA的升高作为判定指标的。TGF-β1参与NF-κB信号通路的调控,有促进肝纤维化进程的作用[10]。伴随HSC-T6的增殖,成纤维样活化的细胞会大量表达TGF-β1[11],表达量的升高提示肝脏纤维化程度加剧[12];表明肝脏纤维化更加显著,提示小鼠酒精性肝纤维化进程中,抑制Gp96的表达使α-SMA和TGF-β1的表达上调,提示Gp96可能通过调控α-SMA和TGF-β1来减轻肝纤维化的程度;NF-κB通过调控Gp96的表达进而抑制α-SMA和TGF-β1的表达,抑制HSC-T6的活化,起到减轻肝脏纤维化的作用。
综上所述,小鼠酒精性肝纤维化进程中,抑制Gp96的表达,促进肝脏纤维化,说明Gp96起到保护肝脏的作用,Gp96可能通过调控α-SMA和TGF-β1来减轻肝纤维化程度,NF-κB通过上调Gp96的表达抑制α-SMA和TGF-β1的表达,最终减轻肝纤维化的过程。
