乳粉中果聚糖检测不确定度分析
2020-12-07杨军丽应月
杨军丽 应月

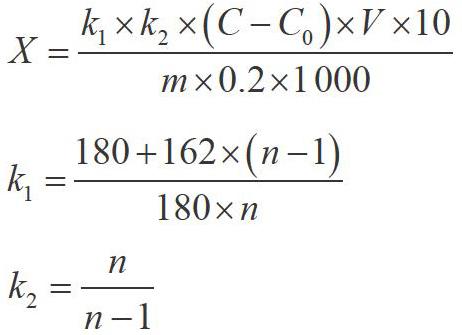
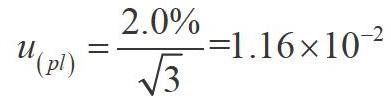
摘 要:根据《食品安全国家标准 食品中果聚糖的测定》(GB 5009.255-2016)测定乳粉中果聚糖,并参照《测量不确定评定与表示》(JJF 1059.1-2012)对乳粉中果聚糖的不确定度进行评定,测试样品中扩展不确定度为0.245 4 g·kg?1(k=2,置信概率95%)。
关键词:果聚糖;不确定度;离子色谱
Abstract:Fructosan in food has been determined according to GB 5009.255-2016, and the corresponding uncertainty analysis has been performed according to JJF 1059.1-2012. The results show that the expanded uncertainty was 0.245 4 g·kg?1 at k=2, confidence probability is 95%.
Key words:Fructosan; Uncertainty; Ion chromatography
中图分类号:TS252.7
果聚糖天然存在于菊苣、菊芋、香蕉、大蒜、洋葱和大麦等多种植物中[1-3],作为一种水溶性膳食纤维广泛应用于婴幼儿食品、乳制品、饮料、焙烤食品等[4-5]。果聚糖在体内的消化过程和代谢途径与普通食用糖不同,并具有多种独特的生理功能[6-7],故对其的检测和研究一直是国内外生产企业和科研院所关注的热点。由于果聚糖的聚合度不同,且存在不同的化学结构,而一些明确结构的成分缺少对照品,故对其定量分析的难度较大[4,7]。在实际检测中,对果聚糖的检测过程提出了很高的要求。对果聚糖检测的不确定度进行测量不仅可以用来合理地评估和表征被测量值的分散性与测量结果,也可用作对检测数据真实性的客观反映和判定测量结果可靠程度的依据。
本工作中,根据《食品安全国家标准 食品中果聚糖的测定》(GB 5009.255-2016)中离子色谱法测定了乳粉中果聚糖的含量,并参考《测量不确定评定与表示》(JJF 1059.1-2012)测量和评定其不确定度,为实验室检测果聚糖的质量控制提供了科学、合理的依据,为精准定量食品中的果聚糖含量提供了理论和数据支持。
1 仪器与材料
1.1 试验仪器
Dinoex ICS 5000+离子色谱仪(安培检测器),赛默飞科技;Sartorius CPA225D 电子天平,德国赛多利斯公司;色谱柱:Dionex CarboPac PA10色谱柱,250 mm×4 mm,赛默飞科技。
测定的环境条件为温度≤30 ℃,相对湿度≤50%。
1.2 材料与试剂
乳粉样品为市售商品。果糖标准物质(BePure,纯度99.5%);玻璃量器,经检定均为A级;水为超纯水;硼氢化钠、乙酸,均为分析纯。
2 试验方法
2.1 样品处理
准确称量试样1~5 g(精确至0.001 g,至少含有果聚糖5 mg),放置于150 mL锥形瓶中,加入约50 mL 80℃±1℃的热水,在80 ℃±1 ℃恒温水浴摇床中以150 r·min-1的速度振摇15 min,然后取出并冷却至室温,将样液转移至100 mL容量瓶中,然后用水分3次冲洗锥形瓶,合并样液并定容,样液经滤纸过滤或者离心后,滤液或上清液备用。可根据配制的标准曲线的线性范围来确定是否需要稀释以及稀释倍数。
取上述备用样液200 μL于10 mL具塞玻璃试管中,估算样液中蔗糖的含量,按照每毫克蔗糖需要300 μL蔗糖酶溶液来加入相应体积的蔗糖酶,旋涡振荡使其充混合后,放置于40 ℃±1 ℃恒温水浴摇床中,并设置150 r·min-1振摇60 min后,加入300 μL硼氢化钠溶液,旋涡振荡混匀,再放置于40 ℃±1 ℃恒温水浴摇床中,150 r·min-1振摇30 min,取出并冷却至室温。加入750 μL乙酸溶液,静置10 min。估算样液中可能的果聚糖含量,按照每毫克果聚糖加入1.2 mL果聚糖酶溶液的量,旋涡振荡混匀,置于40 ℃±1 ℃恒温水浴摇床中,以150 r·min-1振摇30 min后,取出冷却至室温。试样转移至10 mL容量瓶中,并用水重复冲洗玻璃试管3次,将其合并定容后摇匀备用。
活化净化柱,试样溶液依次通过0.22 μm水相滤膜和净化柱,弃去前面3倍柱体积洗脱液,收集后面洗脱液待测。
2.2 色谱条件
检测池温度:30 ℃;流动相:A相为水,B相为200 mmol·L-1 NaOH溶液,C相为150 mmol·L-1 NaOH和500 mmol·L-1 CH3COONa混合溶液,梯度洗脱条件见表1;流动相流速:1.0 mL·min-1;进样体积:25 μL。
2.3 检测方法
配制2 000 mg·L-1果糖标准溶液:准确称取50 mg(精确至0.1 mg)果糖标准物质于50 mL烧杯中,加入大约10 mL热水,使果糖完全溶解,待其冷却至室温后,用水稀释并定容至25 mL容量瓶中,搖匀备用。以保留时间定性、峰面积定量、外标法计算果聚糖含量。
2.4 建立数学模型
测量不确定度数学模型为:
式中,X-供试样品中果聚糖的含量,单位为g·kg-1;
C-试样测定液中果糖的质量浓度,单位为mg·L;
C0-试剂空白测定液中果糖的质量浓度,单位为mg·L-1;
V-供试品定容的总体积,单位为mL;m-供试样品质量,单位为g;10-试样酶解液定容体积,单位为mL;
k1-对果聚糖水解增加的水分子的校正因子;k2-Fn型果聚糖末端果糖基被还原和GFn型果聚糖末端葡萄糖不被检测的校正因子;0.2-用于酶解的样品溶液体积,mL;n为平均聚合度(低聚果糖n=4,多聚果糖n=23,菊粉n=10)。
3 不确定度来源分析
3.1 不确定度的来源
离子色谱法测定食品中果聚糖含量时,测量的不确定度来源主要有以下方面:①标准溶液的引入。②标准溶液的稀释。③配制标准溶液所使用的仪器。④实验室的环境温度变化。⑤样品的称量。⑥样品最终的定容体积。⑦色谱峰面积。⑧测量重复性。
3.2 标准溶液及其配制过程中引入的相对标准不确定度
3.2.1 标准溶液引入的相对不确定度urel(C1)
标准溶液引入的相对不确定度urel(c)由以下3个分量构成:标准物质纯度、标准物质称量及定容。
(1)标准物质纯度的不确定度u(pl)。根据标准物质说明书,果糖标准品的纯度误差为±2.0%,服从均匀分布,k=,其相对不确定度为:
(2)标准物质称量的不确定度u(ml)。测量时称取果糖标准品质量为0.05 g,实验所用赛多利斯天平精度为0.01 mg,按均匀分布计算,k=。忽略称量重复性引入的不确定度,标准品称量的相对不确定度为:
(3)标准物质定容的不确定度u(vl)。测量所用的25 mL单线容量瓶允差为±0.03 mL,按矩形分布计算,其标准不确定度为:
标准溶液引入的不确定度
3.2.2 标准溶液配制过程引入的相对标准不确定度urel(C0)用1.0 mL移液管移取果糖标准储备液1.0 mL,置于洁净25 mL容量瓶中,水定容,混匀,浓度为80.0 mg·L-1。配制标准溶液,果糖的标准色谱图如图1所示。根据《常用玻璃量器检定规程》(JJG 196-2006),使用容量允差计算不确定度并计算标准溶液稀释过程引入的不确定度。
(1)量器引入的相对标准不确定度u1。1.0 mL移液管校准容量允差为±0.007 mL,假设为均匀分布,其标准不确定度为:25 mL容量瓶校准容量允差为±0.030 mL,假设为均匀分布,其标准不确定度为:
(2)环境温度变化引入的不确定度u(T)。实验温度为(20±5)℃,认为呈均匀分布,k=,20 ℃时纯水的体积膨胀系数为0.000 208,故温度引入的不确定度为:
果糖标准溶液配制所引入的相对不确定度为:
3.3 样品制备过程中引入的不确定度
实验检测过程中将样品经充分混匀后称量,因此可认为样品具有较好的均匀性,取样具有足够的代表性,故可以忽略取样所致的不确定。
3.3.1 样品称样量引入的相对不确定度urel(m)
称取1~5 g样品,使用天平的最大允许误差为0.000 1 g,以5 g称样量计算,按均匀分布计算,k=。由称量引入的相对不确定度为:
3.3.2 样品最终定容体积的相对标准不确定度urel(V)
10.0mL 容量瓶容量允差为±0.02 mL,按三角分布,则10.0 mL容量瓶相对不确定度为:
样品最终定容体积的相对不确定度为:
3.4 測量重复性引起的相对标准不确定度urel(y)
按标准方法,取乳粉样品重复测量6次,并计算测量平均值及标准偏差。测量重复性引入的相对标准不确定度为:
所有测量结果、标准偏差、相对不确定度结果见表2。
3.5 合成不确定度
根据以上不确定度评定过程,合成食品中果聚糖测定结果的相对标准不确定度为:
3.6 扩展不确定度Urel(X)
取扩展因子k=2,在95%置信水平下,相对扩展不确定度为:Urel(X)=k×urel(X)=2.48×10-2。
3.7 测量结果
实验数据中,样品中果聚糖含量为9.894 5 g·kg-1,则其扩展不确定度为:U=Urel(X)×9.894 5=0.245 4 g·kg-1。果聚糖的测定结果表示为(9.894 5±0.245 4)g·kg-1。
4 结论
本工作中采用离子色谱法测量了食品中果聚糖含量,综合考虑实验过程及计算结果,认为果聚糖测量不确定度主要来源于标准物质的纯度、标准工作液的配制、试样的定容操作,而样品的称量及仪器进样对重复性影响不大。因此,需要在日常检测工作中注意以下几点:①选用国家认可的标准物质中心生产的、合格有效的标准品。②使用计量合格的移液管和容量瓶来配制系列标准溶液。③要采用合适的样品前处理方法,并遵守操作规范。④检测人员应提高操作水平,保证测定时仪器处于最佳状态,避免可能对测量结果产生较大影响的各种随机干扰因素。总之,在检测过程中须配合多种质控手段,从技术途径上对实验室的质量进行有效控制,以提高检测准确度,从而为食品安全保驾护航。
参考文献:
[1]赵孟良.菊芋块茎果聚糖研究进展[J].分子植物育种,2019,17(2):650-654.
[2]唐建平,王正鹏,张树珍,等.高等植物果聚糖分类和功能的研究进展[J].海南大学学报(自然科学版),2009,27(3):308-312.
[3]成善汉,谢从华,柳俊.高等植物果聚糖研究进展[J].植物学通报,2002(3):280-289.
[4]刘玉峰,徐佳佳,崔亚娟,等.食品中果聚糖的测定方法研究进展[J].食品安全质量检测学报,2019(10):2843-2848.
[5]熊政委.菊糖在食品中的应用的研究进展[J].食品安全导刊,2015(12):95-96.
[6]陈兴都,陈庆安,翟丹云,等.菊粉果聚糖的保健功能及应用价值[J].中国酿造,2018,37(1):21-24.
[7]吴少辉,魏远安,吴嘉仪,等.益生元精准化研究进展[J].食品科学,2018,39(9):333-340.
