Na2CO3/NaHCO3对双酚A在水中溶解性的影响
2020-12-05李文娟朱亮亮
肖 玲,李文娟,朱亮亮*
(安庆师范大学1.资源环境学院,2.生命科学学院,安徽安庆246133)
双酚A(BPA)是一种重要的化工单体,广泛用于塑料、树脂、热敏纸等的生产,据估计,该化合物每年的产量超过380万吨[1]。人们日常接触到的多种物品,包括水管、水盆、电子器件、玩具、香烟过滤嘴,以及食品用包装纸、水杯、罐头内涂层等,均含有BPA,人们很难做到在日常生活中完全避开BPA[2]。
研究表明,BPA是一种内分泌干扰物质,能够和雌激素受体、雄激素受体、核受体、代谢酶等多种蛋白质相互作用[3-6],增加癌症、肥胖、糖尿病等疾病的发生风险[7-9]。BPA可以通过食物、水以及其他途径进入人体[10],已成为一个严重的公共卫生问题。动物实验已经证实,即使很低的BPA暴露水平(每日摄入10µg/kg体重)也会造成不可忽视的健康问题[11]。随着BPA毒性研究的不断深入,人们不断修订每日耐受量。当前,欧盟建议的每日耐受剂量低至4µg/kg体重[12]。
碳酸钠(Na2CO3,俗名苏打、纯碱)和碳酸氢钠(NaHCO3,俗名小苏打)是两个重要的化工产品,在制药、食品加工以及日常洗涤中有广泛应用。例如,碳酸氢钠片可当作非处方药物用于治疗胃酸过多以及炎症部位的清洗,碳酸钠可用于日常餐具、服装的洗涤,二者同时还是食品生产中最为重要的膨松剂和酸度调节剂,因其具有较高的安全性,在有些食品加工环节中是按照生产需要添加,不作限量要求[13]。
人们在日常生活、生产中可能在使用碳酸钠/碳酸氢钠时,也同时使用了含有BPA的器具。BPA会向水或水基食品转移,这是人体摄入BPA的重要途径。通常来讲,BPA因其结构主体的强疏水性,在纯水中的溶解能力较弱,无机盐离子的存在会降低其在水中的溶解性[14],但是其分子结构中存在两个酚羟基,在水中具有一定的电离,碱性物质(如碳酸钠/碳酸氢钠)能够促进酚羟基的电离,从而提高其溶解性能[15]。BPA在碳酸钠/碳酸氢钠溶液中的溶解能力究竟如何,并无相关实验研究。本论文分别系统考察了不同温度下BPA在系列浓度碳酸钠/碳酸氢钠溶液中溶解量的变化情况,以期为评价食源性BPA暴露风险提供关键基础信息。
1 材料与方法
1.1 试剂
BPA(纯度99%)、无水碳酸钠(纯度≥99.5%)、碳酸氢钠(纯度≥99.5%)购自国药集团试剂有限公司。甲醇(色谱纯),购自天津市凯通化学试剂有限公司。乙腈(色谱纯),购自默克化工技术(上海)有限公司。
1.2 平衡时间的确定
以水为溶剂,加入过量的BPA 粉末,30 ℃下振荡溶解12 h、24 h、36 h、48 h、60 h,1 000 g 离心5 min后取上清100µL 与甲醇按体积比1∶10 混合,HPLC 分析BPA 含量。结果表明,24 h 后BPA 已经充分溶解,后续实验BPA取样时间均设定在48 h之后。
1.3 BPA浓度测定
将水或一定浓度的碳酸钠(碳酸氢钠)溶液和过量的BPA放入1.5 mL的带盖离心管中,于不同温度下在恒温金属浴中振荡,开始12 h内每隔2 h在涡旋振荡器上涡旋振荡30 s,36 h后静置12 h。取上清液100µL与甲醇按体积比1∶10混合,用0.22µm滤膜对清液过滤,取1µL入HPLC,分析其中BPA含量。
1.4 数据拟合
为了更好地预测在不同浓度的NaCO3/NaHCO3溶液中BPA的溶解能力,构建经验性公式:

描述BPA 的饱和浓度和NaCO3/NaHCO3浓度(mol·L-1)之间的定量关系,其中,A 为无机盐离子浓度为1 mol·L-1时BPA的饱和浓度,c为不同盐溶液中BPA的饱和浓度(μg·mL-1),x为Na2CO3或NaHCO3浓度(mol·L-1),B为BPA饱和浓度随Na2CO3或NaHCO3浓度对数值的变化率。
1.5 分析方法
利用Water Acouity UPLC 分析BPA 含量,检测波长设定为278 nm,色谱柱为Waters C18 色谱柱,粒径1.7 μm,尺寸2.1 mm×100 mm,流动相由水(B)和乙腈(C)组成,流速0.3 mL·min-1。梯度洗脱,流动相随时间变化:(0~6)min,(42%~75%)B;(6.01~9)min,10%B;(9.01~13)min,75%B。BPA 保留时间为4.087 min。利用BPA标准曲线确定BPA浓度,日内差、日间差均小于2%。
2 结果与分析
2.1 水中BPA的溶解情况
为了验证实验的准确性,首先测定不同温度水中BPA的饱和浓度。30 ℃时,水中BPA的饱和浓度可达369µg·mL-1。这和当前接受的浓度一致(https://pubchem.ncbi.nlm.nih.gov/compound/6623#section=Solubility)。随着温度的升高,水对BPA的溶解能力明显增强(图1)。在50 ℃时,BPA在水中能达到的饱和浓度是30 ℃条件下的2.2倍。
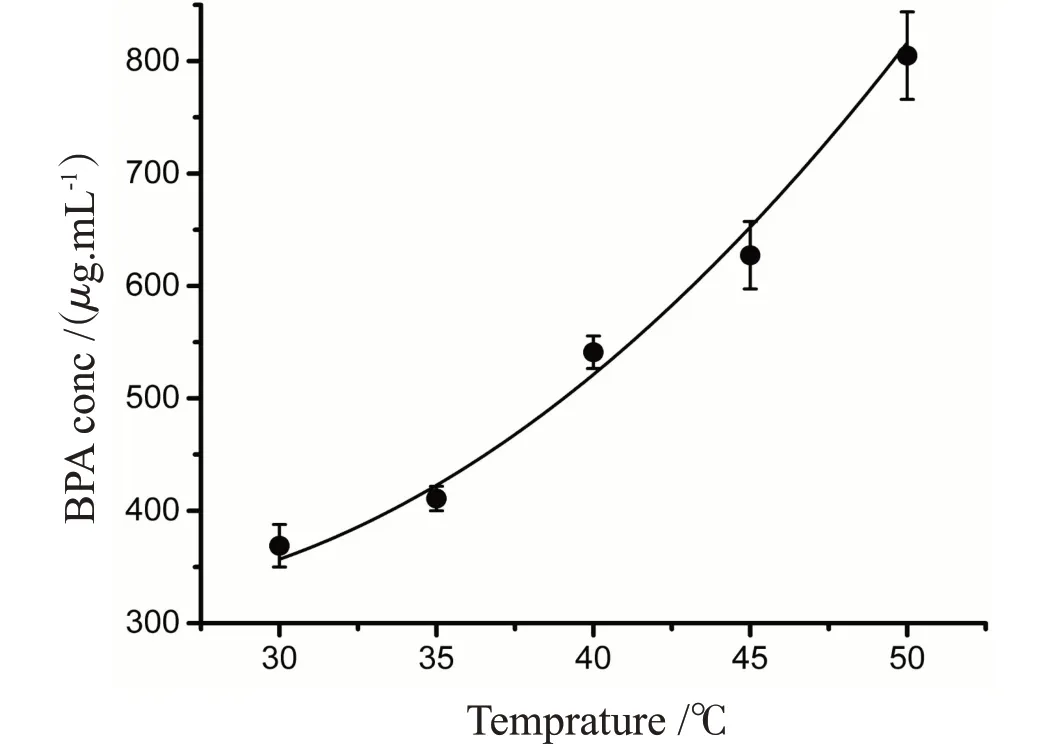
图1 不同温度下BPA在水中的饱和浓度
2.2 Na2CO3溶液中BPA的溶解情况
BPA在Na2CO3溶液中的溶解情况如图2所示,无论是在30 ℃,还是在50 ℃的情况下,低浓度Na2CO3(小于0.75 mol·L-1)均能促进BPA 的溶解,高浓度时(大于0.75 mol·L-1)对BPA 溶解的促进作用变弱。溶液中BPA 的饱和浓度(μg·mL-1)和Na2CO3的浓度(mol·L-1)在两个分区间(0.01~0.75)mol·L-1和(0.75~2)mol·L-1中均满足式(1),具体参数拟合情况如表1所示。
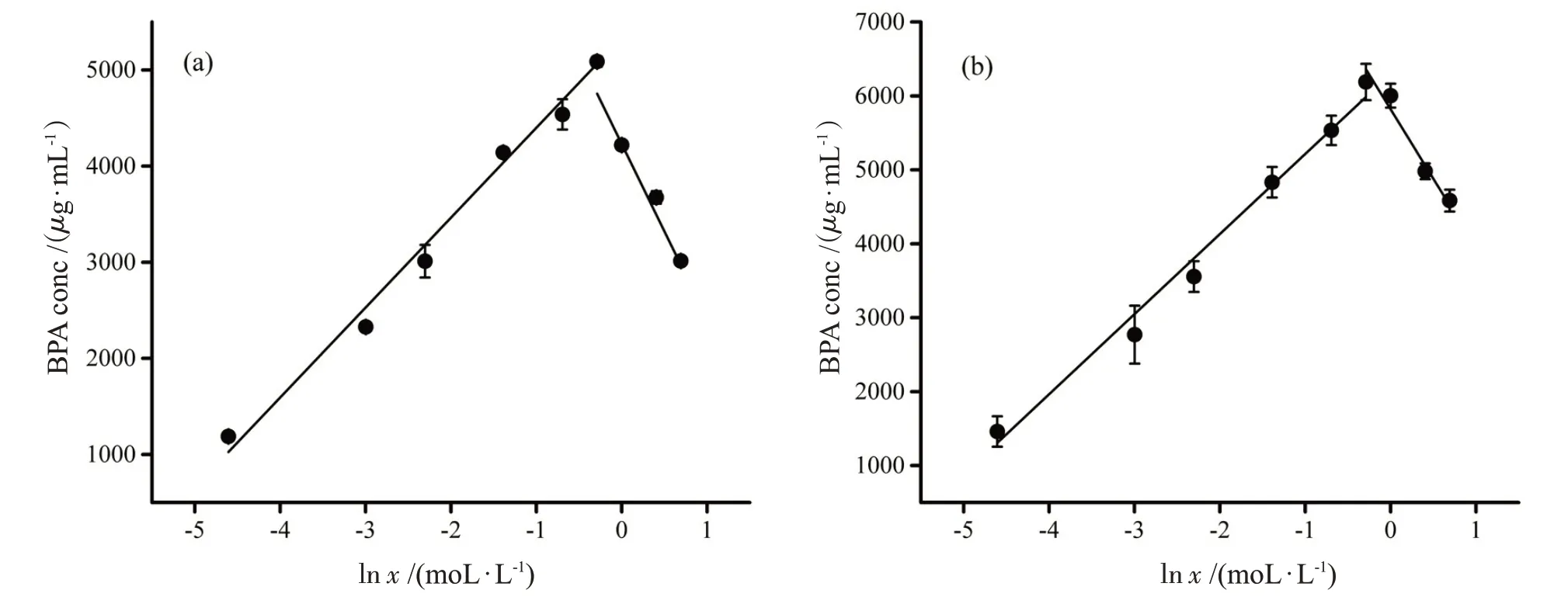
图2 BPA在不同浓度Na2CO3溶液中的饱和浓度。(a)T=30 ℃;(b)T=50 ℃
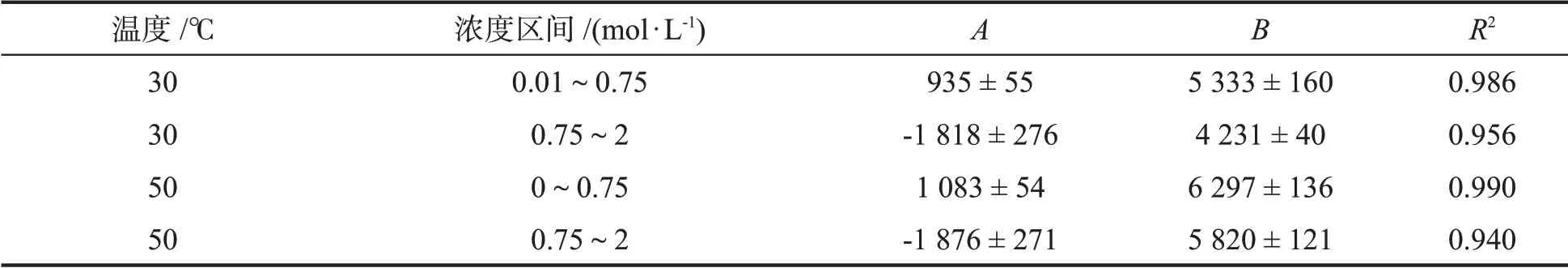
表1 BPA饱和浓度和Na2CO3浓度的定量关系模型参数
2.3 NaHCO3溶液中BPA的溶解情况
BPA在NaHCO3溶液中的溶解情况如图3所示。和Na2CO3不同,NaHCO3不能促进BPA的溶解。较低浓度时(小于0.1 mol·L-1),NaHCO3对BPA的溶解没有影响,但是在高浓度时[(0.1~1)mol·L-1],BPA的溶解受到了一定的抑制。抑制作用可用式(1)描述,具体参数拟合情况如表2所示。
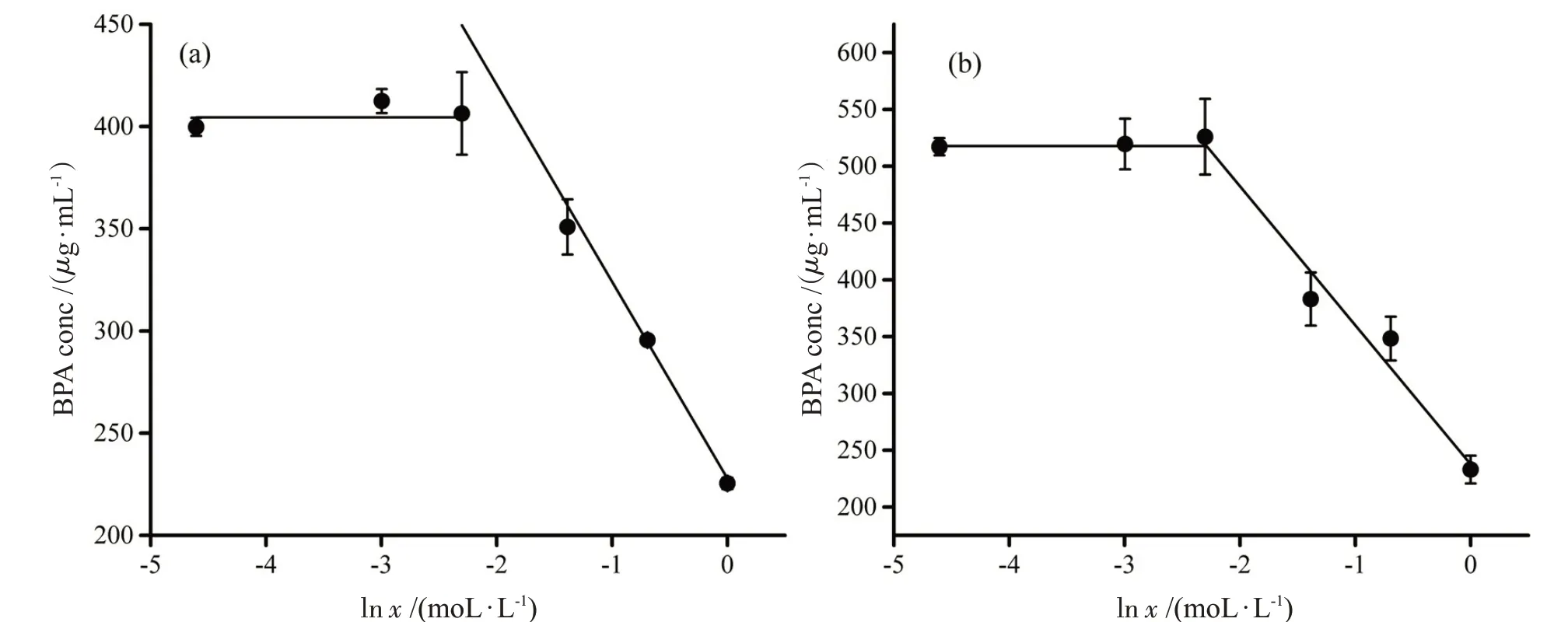
图3 条件下BPA在不同浓度NaHCO3溶液中的饱和浓度。(a)T=30 ℃;(b)T=40 ℃

表2 BPA饱和浓度和NaHCO3浓度的定量关系模型参数
3 讨 论
人对BPA的暴露量是公共卫生领域很关注的问题。本论文的研究结果表明,在利用塑料器具盛装含有Na2CO3的食物时,BPA 的溶出会相应增加。图2 表明在0.75 mol·L-1时,和无Na2CO3的情况相比,BPA的溶出量增加了约4倍。一个值得注意的事实是,目前国家标准对Na2CO3的使用量未做明确规定,很多时候按照生产需要增加,这无疑会增加BPA流入食品的风险。
虽然NaHCO3和Na2CO3同为弱碱性物质,但是其对BPA 的影响并不相同。NaHCO3对BPA 的溶解只表现出了抑制作用,可以认为此时只有电解质离子对疏水性物质溶解一般意义上的抑制作用。究其原因是NaHCO3造成碱性环境太弱(25 ℃时,0.1 mol·L-1水溶液的pH 值为8.3,https://pubchem.ncbi.nlm.nih.gov),难以促进BPA羟基的电离(BPA的pKa值为9.6,https://pubchem.ncbi.nlm.nih.gov)。和NaHCO3不同,Na2CO3的碱性要强于NaHCO3,通过促进酚羟基的电离增强BPA 在水中的溶解作用不能忽略(25℃时,质量浓度为1%水溶液的pH值为11.3,https://pubchem.ncbi.nlm.nih.gov)。与此同时,电解质对疏水性物质在水中溶解的抑制作用依然存在[14-15]。因此,Na2CO3对BPA 在水中的溶解表现出了双重作用(图3)。考虑到NaHCO3和Na2CO3在食品加工中均可用作酸度调节剂和膨松剂,如果选用NaHCO3,则导致BPA溶出的风险将会变小。
温度对BPA的溶解是另一个值得注意的现象。图1表明,温度由30 ℃升高到50 ℃时,BPA的溶解量增加了不止一倍。同样的情况见诸于Na2CO3溶液和NaHCO3溶液,较高温度时溶解量相对于较低温度时均有显著的提高。实际生产应用中,为了使用方便,溶液的温度可能会设定在较高的水平。本研究表明,食品生产过程中温度较高时,BPA溶出风险会变大;Na2CO3对BPA在水中的溶解有显著促进作用;和Na2CO3不同,NaHCO3对BPA在水中的溶解有抑制作用。在食品加工中,Na2CO3的使用将会促进BPA从器具转移到食品中,最终可能导致食源性BPA暴露量的增加;在可以同时使用这两种碱盐的场合,选用NaHCO3将会在一定程度上减小BPA的暴露量。
需要注意的是,在众多的食品添加剂中,有相当数量碱性食品添加剂的存在,包括防腐剂中的苯甲酸钠、山梨酸钾,洗涤用的氢氧化钠,酸度调节剂中的碳酸钾,抗氧化剂中的亚硫酸钠、硫代硫酸钠,甚至天然食品添加剂中的鱼精蛋白等,这些物质的存在对BPA的溶出有何影响,值得进一步评估。
