帕金森病患者血脂 血尿酸水平与疾病进展的相关性研究
2020-12-04周超宁谷有全陈江君党小利王天红刘赵东陈小明
周超宁 陈 军 谷有全 陈江君 党小利 王天红 刘赵东 陈小明
1)兰州大学第一医院,甘肃 兰州 730000 2)兰州大学第二医院,甘肃 兰州 730000
帕金森病是中老年常见的神经系统变性疾病之一,主要特征为黑质多巴胺神经元大量变性、丢失,纹状体多巴胺耗竭,引起基底神经调节功能受损。临床症状主要有运动迟缓、肌强直、姿势平衡障碍以及静止性震颤等,部分患者可能会出现一些非运动症状,如感觉症状、嗅觉减退、自主神经功能障碍、呼吸窘迫、强迫行为、夜间和白天的睡眠障碍、精神障碍、认知功能障碍等。流行病学研究发现,意大利PD患病率约为5.42/1 000[1],德国的患病率为217.22/10万[2],中国65岁以上老年人患病率约为1.7%[3]。由于社会人口的老龄化,PD患病率将逐年增加,PD患者到2030年预计将翻一番[4]。研究发现PD患者的死亡风险明显高于相似年龄和性别的非PD患者[5]。近年研究显示血脂、血尿酸水平可能与PD有一定相关性,然而关于血脂、血尿酸与PD关系的研究结果目前却有较大差别[6-8]。GUO等[9]研究显示PD患者TC、LDL、HDL、TG水平降低,脂质可能是PD严重程度的标志。另有研究表明TC可能与PD发病无关[10]。VIERU等[11]发现PD患者血清UA浓度显著低于健康对照组,而JAIN等[12]报道男性患者中UA水平和PD风险之间呈U形关系。本研究进一步探讨PD患者血脂、血尿酸水平变化及其与疾病进展的相关性。
1 资料与方法
1.1研究对象纳入2015-01—2019-01兰州大学第一医院神经内科收治的156例PD患者(PD组),其中男94例,女62例;年龄46~89(68.61±8.36)岁,病程0.1~21(3.48±3.1)a;Hoehn-Yahr分级:1~2级65例,2.5~3级48例,3级以上43例。入组患者均符合中华医学会神经病学分会帕金森病及运动障碍学组帕金森病诊断标准。排除标准:PD综合征及PD叠加综合征,近来口服调脂或降尿酸药物,存在严重心肝肾、胃肠道疾病。选取同期156例健康体检者(对照组),男90例,女66例;年龄48~90(66.93±7.84)岁。2组性别、年龄、体重指数等比较差异均无统计学意义(P>0.05),具有可比性。
1.2方法所有被检者前1 d禁用高脂食物,晨起空腹肘静脉采血4 mL,取上层血清时需等到血液凝固后,用高效液相色谱法对血清TC、TG、HDL、LDL、UA水平进行检测。

2 结果
2.1帕金森病组与对照组血脂、血尿酸水平比较PD组与对照组TC、HDL水平相比差异无统计学意义(P>0.05),PD组TG、LDL、UA均显著低于对照组,差异均有统计学意义(P<0.01)。见表1。
2.2帕金森病组不同性别患者血脂、血尿酸水平比较PD组男性患者TC、TG、HDL、LDL均较女性患者低,而UA较女性患者高,差异均有统计学意义(P<0.05)。见表2。

表1 PD组与对照组血脂、血尿酸水平比较Table 1 Comparison of the levels of serum lipid and uric acid between PD group and control

表2 PD组不同性别患者血脂、血尿酸水平比较Table 2 Comparison of the levels of serum lipid and uric acid in patients of different genders in PD
2.3相关性分析PD组UA及TG与病程呈负相关(r=-0.169,P=0.035;r=-0.209,P=0.009),与病情严重程度呈负相关,但差异无统计学意义(P>0.05),其余各项指标与病程及其严重程度均有相关性,但差异均无统计学意义(P>0.05)。见表3~4。

表3 PD组血脂、血尿酸水平与病程的相关性分析Table 3 Correlation analysis of serum lipid,uric acid leveland course of disease in PD group
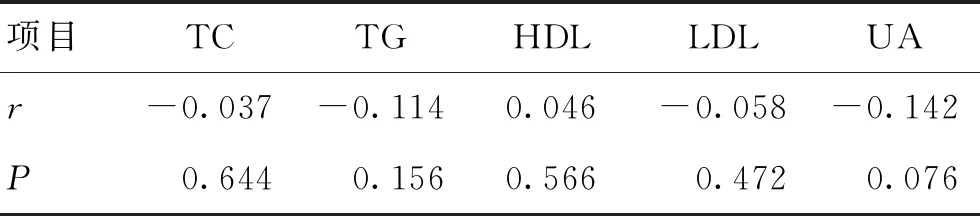
表4 PD组血脂、血尿酸水平与病情严重程度的相关性分析Table 4 Correlation analysis of serum lipid,uric acid leveland severity of disease in PD group
3 讨论
PD发病机制可能与多种因素相关,目前研究主要集中在氧化应激导致线粒体功能障碍、神经炎症、内质网应激引起异常蛋白质折叠、微生物群-肠-脑轴及相关基因改变等方面[13]。研究发现神经变性可能是因大多数编码大脑脂代谢或转运的先天性基因缺陷[14],而PD患者前额叶及黑质、视皮质等处脂筏存在脂质代谢的显著改变,提示脂质代谢异常可能与PD的发病有关[15-17]。当机体交感神经系统受到外界刺激时会导致儿茶酚胺分泌增加,引起血脂升高[18]。PD患者中大脑黑质纹状体系统的儿茶酚胺神经支配丧失[19],交感神经兴奋性下降[20]。UA为人体嘌呤代谢的最终产物,是一种天然抗氧化剂,可使氧化应激减轻,这种机制和PD的发病有关,UA水平升高可能有神经保护作用[21]。UA可减轻氧化应激造成的多巴胺能神经元损伤,起到一定的神经保护作用,这被PD动物模型实验所证实[22]。PD患者中UA水平明显下降,随疾病病程的进展,血清浓度水平继续降低,故UA可成为PD潜在的生物标志物之一,可对其风险及进展进行预测[6]。
大量临床和流行病学研究发现UA水平与PD的发展和进展呈负相关。西班牙南部一项研究发现,与对照组相比,PD病人的UA水平下降,男性病人血清UA水平与疾病严重程度呈负相关,而女性与之无关,说明UA水平的升高对PD患者可能有神经保护作用,且对其临床进展可能会有影响[33]。SHEN等[34]研究亦发现UA浓度的升高与PD患者风险降低有关,尤其在男性患者中UA长时间处于高水平可能会延迟PD的进展。研究还表明PD病人的UA水平明显低于健康对照组,是PD的独立危险因素[35]。本研究发现PD组UA水平较对照组明显偏低,与病程呈负相关,虽与病情严重程度呈负相关,但差异无统计学意义,说明低UA可能为PD发病的危险因素。本研究发现PD组男性患者UA水平较PD组女性高,其可能原因[21]:一方面,性激素尤其是雌激素可能促进肾脏更有效清除UA,并在多巴胺调节和多巴胺神经元的神经保护中发挥关键作用;另一方面,女性PD患者体质量低于男性PD患者,导致女性PD患者血浆中左旋多巴浓度相对增加。目前对于这种机制尚不清楚,需更多研究探讨UA与PD关系中的性别差异。
PD患者血脂、UA水平低于正常人,低TG、低UA可能是PD发病的危险因素之一。因本研究样本量小,需进一步大样本多中心临床随机对照试验研究证实。
