高海拔藏汉族OSAHS患者血清HIF-2α的相关性研究
2020-12-03拉周措毛李玲义高瑞刘虹
拉周措毛 李玲义 高瑞 刘虹
阻塞性睡眠呼吸暂停低通气综合征(obstructive sleep apnea-hypopnea syndrome,OSAHS)的特征是睡眠期间上呼吸道反复塌陷,导致间歇性缺氧、睡眠碎片及白天嗜睡等症状[1]。OSAHS是一种系统性疾病[2],可作为高血压、冠心病等的独立危险因素[3]。OSAHS 患者睡眠时反复发生间断性缺氧,导致氧饱和度下降,动脉血中二氧化碳分压升高。缺氧使低氧诱导因子(hypoxia-inducible factor,HIFs)活性增强,以促进参与糖酵解、血管生成和细胞存活等基因的转录[4]。HIFs由2个亚基组成:对氧敏感的α亚基和以连续方式产生且不依赖氧的β亚基[5]。时等人报道OSAHS 患者血浆HIF-1α水平显著升高,并通过调节VEGF参与OSAHS的发病[6]。本研究观察了海拔3000米以上藏汉族OSAHS患者血清HIF-2α水平,并初步探讨其与患者临床指标的相关性。
资料与方法
一、研究对象
选取2017年1月至2019年12月于青海大学附属医院确诊的藏族(20例)和汉族(20例) OSAHS患者,并以我国2009年制定的《阻塞性睡眠呼吸暂停低通气综合征诊断和外科治疗指南》为OSAHS诊断标准。同期选取非OSAHS且体检正常的藏汉族各30例。所有研究对象年龄范围为45±11岁,均居住在青海省海拔超过3 000米(高海拔)的地区,均排除:①合并神经、心脑血管、内分泌等疾病;②合并肺、肝或肾疾病;③贫血或其他原因红细胞增生患者;④恶性肿瘤患者;⑤近3个月内曾接受外科手术;⑥有糖尿病或自身免疫性疾病者。本研究获得青海大学附属医院伦理委员会的批准,且受试者均签署知情同意书。本研究共分为四组:组Ⅰ:健康且移居高海拔> 3年的汉族;组Ⅱ:移居高海拔> 3年的OSAHS汉族患者;组Ⅲ:健康且世居高海拔的藏族;组Ⅳ:世居高海拔的OSAHS藏族患者。
二、方法
1 多导睡眠(Polysomnography,PSG)监测
受试者于检查前3天不服镇静药,不抽烟和饮酒,不喝咖啡浓茶,监测当天不睡午觉。受试者来院后于休息室休息30分,记录年龄、性别,测量身高、体重、最大肺活量(forced vital capacity,FVC),晚22点至次日清晨7点,按平时生活习惯在睡眠监测室入睡,睡前测量动脉血压,用Polysmith多导睡眠仪进行PSG监测至少7小时。监测指标包括:胸腹运动、口鼻气流、脑电图、眼动图、心电图、下颌肌电图、体位、腿动、鼾声、脉冲式血氧饱和仪监测动脉血氧饱和度(SaO2)、晨起再次测量动脉血压、记录受试者的总睡眠时间。睡眠呼吸紊乱指数(apnea hypopnea index,AHI)监测结果由经计算机自动分析,经人工校正后记录。
2 血标本采集
在次晨受试者醒来时,空腹平卧位抽取外周静脉血3mL,并注入抗凝管中混匀,立即离心15min(4℃,2 000 r/min),取上层血清密封。-70℃冻存待测。样本符合:①无溶血;②清澈透明;③解冻一次;④保存时间不超过6个月。另外抽取2mL血液测量血红蛋白(hemoglobin,Hb)含量。
3 ELISA测定
严格按照说明书要求,使用ELISA试剂盒测量血清中HIF-2α的浓度。试剂盒购自美国Sigma公司。
三、统计学处理
结 果
一、受试者临床基本数据
各组年龄、性别、体质量指数(BMI)、最大肺活量(FVC)、总胆固醇水平和总睡眠时间比较差异无统计学意义(P>0.05)(见表1)。

表1 各组间临床基本数据

表2 各组间PSG监测指标和Hb含量比较
二、各组间PSG监测指标和Hb含量分析
与组Ⅰ相比,组Ⅱ的AHI、晨起收缩压、晨起舒张压、血氧饱和度<90%的时间(T-SaO2<90%)及Hb含量均显著升高(t=16.483、12.158、19.234、22.342、10.186,P值均<0.05),最低血氧饱和度(MinSaO2)显著降低(t=17.435,P<0.05),差异有统计学意义。与组Ⅲ相比,组Ⅳ的AHI、晨起收缩压、晨起舒张压、T-SaO2<90%及Hb含量均显著升高(t=28.123、14.634、16.583、19.563、30.256,P值均<0.05),MinSaO2显著降低(t=35.624,P<0.05),差异有统计学意义。组Ⅲ的Hb含量与组Ⅰ相比显著降低(t=26.347,P<0.05),组Ⅳ的Hb含量与组Ⅱ相比显著降低(t=10.434,P<0.05),差异有统计学意义(见表2)。
三、各组血清HIF-2α含量分析
与组Ⅰ相比,组Ⅱ的血清HIF-2α含量显著上升(t=9.584,P<0.01)。与组Ⅲ相比,组Ⅳ的血清HIF-2α含量显著增高(t=20.183,P<0.01),差异有统计学意义。(见表3)。
四、OSAHS藏汉族患者血清HIF-2α水平与PSG监测指标和Hb的相关性分析
组Ⅱ和组Ⅳ中HIF-2α血清含量与晨起收缩压、晨起舒张压、T-SaO2<90%及Hb无显著相关。组Ⅱ和组Ⅳ中HIF-2α血清水平与AHI呈正相关,而与MinSaO2呈负相关(见表4,图1)。

表3 各组血清HIF-2α含量比较
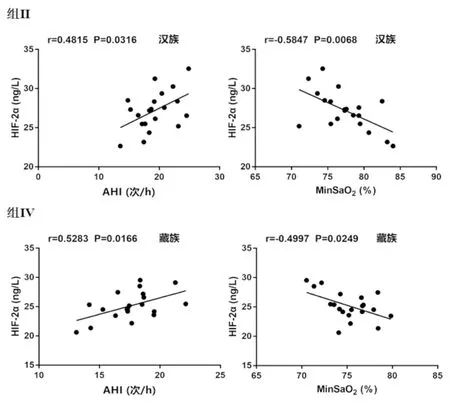
图1 组Ⅱ和组Ⅳ血清HIF-2α含量与AHI和MinSaO2相关性分析

表4 组Ⅱ和组Ⅳ血清HIF-2α水平与PSG监测指标和Hb相关性分析
讨 论
OSAHS是一种睡眠呼吸障碍性疾病,其特征是在睡眠期间反复发生上呼吸道阻力增加,并导致呼吸暂停/呼吸不足和夜间睡眠碎片[7]。已知OSAHS与心脑血管疾病、代谢紊乱和神经认知功能障碍等疾病的死亡和发病风险增加有关[8]。研究表明人体在高海拔低氧环境下做出的适应性反应,会导致一系列生理学改变[9]。据报道,与移居高原的汉族相比,世居高原的藏族对高原环境表现良好的适应性,且始终保持较低的Hb水平。我们的研究显示世居高原的健康藏族人或藏族OSAHS患者血清中Hb含量,比移居高原的健康汉族人或汉族OSAHS患者血清中Hb含量低。而藏汉族OSAHS患者血清HIF-2α含量、AHI、晨起收缩压和舒张压、T-SaO2<90%、MinSaO2之间并无显著差异,表明藏族人对OSAHS未表现出比汉族更好的适应性。
HIFs在机体生理、病理等诸多过程中发挥重要作用,是介导机体缺氧反应的重要转录因子家族之一[10]。HIF是由α和β亚基组成的异二聚体,其中α亚基对氧浓度敏感,而β亚基不依赖于氧。HIF-1α / HIF-1β和HIF-2α / HIF-1β二聚体是调节大多数哺乳动物细胞中低氧转录反应的主要因素[11]。HIF转录调节数百个缺氧反应性基因,这些产物通过平衡氧供应、输送和新陈代谢变化以适应氧气下降,最终促进细胞存活[12]。我们的结果显示,与正常藏汉族相比,患OSAHS藏汉族血清HIF-2α水平显著上调,显示HIF-2α在OSAHS发病过程中发挥重要作用。
据报道,H1F-1α在OSAHS患者中显著上调,且与AHI、晨起收缩压与舒张压、T-SaO2<90%呈正相关,与MinSaO2呈负相关[6]。罗玲的研究显示,随着OSAHS病情严重程度和缺氧程度的增加,HIF-1α的mRNA和蛋白水平均增加,且与AHI呈正相关,与夜间MinSaO2、平均血氧饱和度呈负相关,与氧降指数、嗜睡评分量表得分,均无相关性[13]。关巍等人的研究表明血清H1F-2α水平在高海拔世居藏族和高海拔移居汉族的体检健康者中有显著差异,且汉族H1F-2α水平与动脉血氧分压呈负相关,与Hb呈正相关[14]。李婧婧的结果显示,海拔2262m的汉族、不同海拔的藏族OSAHS患者血清H1F-2α水平与红细胞、Hb、红细胞压积都无显著相关性[15]。本研究结果表明,与正常藏汉族相比,患OSAHS藏汉族血清HIF-2α水平、AHI、晨起收缩压和舒张压、T-SaO2<90%显著上调,而MinSaO2显著下调。相关性分析结果显示,藏汉族OSAHS患者血清HIF-2α水平与晨起收缩压和舒张压、T-SaO2<90%及Hb含量无显著相关,与AHI呈正相关,与MinSaO2呈负相关。
本研究显示HIF-2α水平在高海拔OSAHS藏汉族患者中差异不大,但都显著高于高海拔正常藏汉族,且HIF-2α水平与呼吸紊乱指数和最低血氧饱和度具有显著相关性,提示HIF-2α可能参与OSAHS的发病机制。因此,对HIF-2α作用机制的研究有望成为OSAHS治疗的新突破点。
