长链非编码RNA UCA1 对肺腺癌A549细胞糖代谢及侵袭转移的影响
2020-12-02张卉王姝李雪娜李亚明
张卉 王姝 李雪娜 李亚明
中国医科大学附属第一医院核医学科,沈阳 110001
肺癌是世界范围内致死率较高的恶性肿瘤之一,近年来肺癌在我国的发病率和病死率均高居首位,其主要原因在于肺癌的高侵袭转移能力和高复发率[1]。非小细胞肺癌是肺癌中发病率最高的类型,手术治疗和放化疗是最常用和最基本的治疗手段,但预后依然较差,5 年生存率不足17%[2]。因此,研究肺癌的代谢及转移机制在一定程度上能提高肺癌的诊疗效果,进而降低肺癌的病死率。
在RNA 中,大部分为非编码RNA,其中长链非编码RNA(long non-coding RNA,lncRNA)长度一般超过200 bp,且缺乏明显的开放阅读框,因此其不编码蛋白质,但是广泛参与人体生理、病理活动,包括参与或介导肿瘤的发生、发展过程[3-3]。早期研究结果发现,lncRNA 尿路上皮癌胚抗原(urothelial carcinoma associated,UCA)1 在多种肿瘤细胞中表达上调,降低UCA1 的表达可以抑制肿瘤细胞的增殖、转移等生物学行为,调节肿瘤细胞的葡萄糖代谢[4],因此UCA1 可作为肿瘤早期诊断、预后监测的新型生物标志物[5-6]。
本研究首先通过检测lncRNA UCA1 在肺腺癌A549 细胞中的表达,然后体外实验进一步验证lncRNA UCA1 在肺腺癌中的作用,旨在进一步揭示肺癌的发生、发展机制,并为lncRNA UCA1 作为肺癌新的早期诊断指标及治疗靶点提供证据。
1 材料与方法
1.1 主要试剂与仪器
肺腺癌A549 细胞购自中国科学院上海生命科学研究院,人正常支气管上皮细胞HBE 购自中国科学院细胞库,胎牛血清购自美国CLACK 公司,DMEM/F12 细胞培养基、青-链霉素双抗和胰蛋白酶均购自美国Hyclone 公司,Opti-MEM 低血清培养基、Lipofectamine 3000 和Trizol 试剂均购自美国Invitrogen 公司,SYBR Premix Ex Taq Ⅱ试剂盒(RR820A)、PrimeScriptTMRT reagent 试 剂 盒(RR047A)购自日本Takara 公司,BCA 蛋白浓度测定试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶快速制备试剂盒购自上海碧云天生物技术公司,抗体均购自美国ABcam 公司,Transwell 小室购自美国Corning 公司。18F-FDG由本科室的美国GE 公司的MINItrace 加速器合成,放射化学纯度>95%。Image Lab 图像分析系统为美国伯乐公司生产,γ 计数器(GC-1500)为安徽中科中佳科学仪器有限公司生产。
1.2 细胞培养及转染
人正常支气管上皮细胞HBE 培养于含有10%胎牛血清的1640 培养基中,肺腺癌A549 细胞培养于含10%胎牛血清和1%双抗DMEM/F12 完全培养基中,均置于37℃的恒温培养箱中培养(内含5%CO2);然后加1 mL 胰蛋白酶消化收集细胞,再用1 mL 无双抗的完全培养基中和,重悬为细胞悬液,按1×105个数量接种于六孔板中,待细胞密度约为70%时,进行转染。将小干扰RNA(small interfering,siRNA)转染细胞分为NC 组(阴性对照组,转染siRNA-UCA1 序列)和siRNA-UCA1 组(转染siRNA-UCA1 敲降序列),以上序列由上海吉凯公司设计合成。转染24 h 后换液,继续培养24 h 后用Trizol 试剂裂解细胞,用于检测干扰效率。
1.3 UCA1 的干扰效率验证与糖代谢的相关指标检测
提取人正常支气管上皮细胞HBE 和肺腺癌A549 细胞的RNA,进行反转录反应(去除基因组DNA 和反转录反应)和实时荧光定量(quantitative real-time,qRT)PCR 反应,后者包括预变性95℃30 s,反应40 个循环,溶解95℃ 5 s、60℃ 30 s、72℃ 5 s、4℃降温30 s 等步骤。并以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,通过2-△△CT法计算以上2 种细胞的UCA1 相对表达量,检测肺腺癌A549细胞的糖代谢相关指标:己糖激酶(hexokinase,HK)2、葡萄糖转运蛋白(glucose transporter protein,GLUT)1 和丙酮酸激酶(pyruvate kinase isozymes M,PKM)2 的表达量,以β-actin 为内参。引物序列如下:
GAPDH 引物序列:
正向5′-GAGTCAACGGATTTGGTCGT-3′
反向5′-TTGATTTTGGAGGGATCTCG-3′
β-actin 引物序列:
正向5′-GCAGAAGGAGATCACTGCCCT-3′
反向5′-GCTGATCCACATCTGCTGGAA-3′
UCA1 引物序列:
正向5′-CTCTCCATTGGGTTCACCATTC-3′
反向5′-GCGGCAGGTCTTAAGAGATGAG-3′
GLUT1 引物序列:
正向5′-ATACTCATGACCATCGCGCTAG-3′
反向5′-AAAGAAGGCCACAAAGCCAAAG-3′
HK2 引物序列:
正向5′-GGCAATGAAACCAAAGCCAGGAG-3′
反向5′-GGAAGGAGGAGCCAGAAGCAACC-3′
PKM2 引物序列:
正向5′-GGGTTCGGAGGTTTGATG-3′
反向5′-ACGGCGGTGGCTTCTGT-3′
1.4 Transwell 实验和划痕实验检测细胞侵袭及迁移
肺腺癌A549 细胞转染48 h 后,先用胰蛋白酶消化,再用无血清培养基稀释,以2×105个的数量加入上室中。在下室加入600 μL 含20%血清的DMEM/F12 培养基,将上室放入后继续培养。8 h后取出上室,用4%的多聚甲醛固定30 min,结晶紫染色30 min,用PBS 进行清洗后,擦去上室内残留细胞,晾干拍照。实验至少重复3 次。
细胞转染48 h 后进行划痕实验,用10 μL 加样器的枪头垂直于六孔板划一道竖线,PBS 清洗1 次后进行拍照,更换无血清培养基培养24 h 后再进行拍照,尽量选择同一视野。使用Image J 软件(http://rsb.info.nih.gov/ij/download.html)测各个时间点细胞未覆盖的面积。
划痕愈合率(%)=1-(各时间点划痕面积/开始的划痕面积×100%)
1.5 Western blot 检测糖代谢相关蛋白
肺腺癌A549 细胞转染48 h 后,用PBS 清洗再加入裂解液,冰上裂解30 min,4℃离心(17 000×g)25 min 后取上清,进行蛋白浓度测定,电泳仪设置电压为80 V 跑电泳,至分离胶和浓缩胶交界处时将电压更改为120 V,至样品跑出即可停止电泳。5%脱脂奶封闭2 h,一抗为HK2(1∶1000)、GLUT1(1∶2000)、PKM2(1∶1000),以β-actin(1∶10000)为内参,4℃ 过夜后,第2 天用TBST(Tris buffered Tween)缓冲液清洗3 次,每次15 min。山羊抗兔二抗(1∶5000)室温孵育2 h,TBST 清洗3 次后进行化学发光法检测和曝光拍照,结果用image-Lab 图像分析系统测定各条带的灰度值,计算HK2、GLUT1 和PKM2 的相对表达量,实验重复3 次。
1.6 18F-FDG 摄取实验
六孔板内未转染的肺腺癌A549 细胞每孔加入37 000 Bq 的18F-FDG,37℃分别孵育5、15、30、60、90、120 min,计算不同时间点18F-FDG 的摄取率,选取摄取率最高的时间点进行后续实验。肺腺癌A549 细胞在六孔板内转染48 h 后,每孔加入0.296 MBq(8 μCi)/mL 的18F-FDG,37℃孵育60 min,吸取上清液后用1 mL 的PBS 清洗3 次。用胰蛋白酶消化细胞,收集后用1 mL 的PBS 再清洗3 次,均加入试管中,最后用γ 计数器测量每个试管内的放射性计数,计算细胞对18F-FDG 的摄取率:18F-FDG 摄取率=细胞内放射性计数/(细胞内放射性计数+上清液放射性计数)×100%。
1.7 统计学分析
以上所有实验均重复3 次以确保结果的可靠性。采用SPSS20.0 软件和GraphPad Prism7.0 软件对数据进行统计学分析。符合正态分布的计量资料用均数±标准差表示,方差齐的2组数据的比较采用t 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 UCA1 在A549 细胞中的表达
用qRT-PCR 检测人正常支气管上皮细胞HBE和肺腺癌A549 细胞中UCA1 的表达时发现,UCA1 在A549 细胞中的表达显著升高,是在HBE中表达量的4.26 倍,且差异有统计学意义(t=16.26,P<0.001)。
2.2 siRNA-UCA1 对GLUT1、 HK2 和PKM2 的影响
qRT-PCR 结果显示,UCA1 的siRNA 转染能够抑制肺腺癌A549 细胞GLUT1、HK2 和PKM2基因的表达(图1)。进一步的Western blot 结果表明,与NC 组相比,siRNA-UCA1 组的GLUT1、HK2和PKM2 蛋白的表达水平均明显下降,且差异均有统计学意义(图2)。
2.3 LncRNA UCA1 对肺腺癌细胞侵袭和迁移能力的影响
Transwell 侵袭实验结果显示,siRNA-UCA1组和NC 组细胞穿过数量分别为(12.0000±0.5774)、(127.7000±5.9250)个(图3),说明下调UCA1 时,肺腺癌细胞的侵袭能力与对照组相比显著降低(t=19.43,P<0.001)。
划痕实验结果显示,经过24 h 的爬行,与NC 组相比,siRNA-UCA1 组细胞的迁移运动能力明显降低(图4)。
2.4 siRNA-UCA1 对肺腺癌细胞18F-FDG 摄取率的影响
未转染的肺腺癌A549 细胞在5、15、30、60、90、120 min 时对18F-FDG 的摄取率分别为1.95%、2.28%、2.55%、2.86%、2.40%、2.34%,60 min 时的摄取率达到峰值,因此选择60 min 作为测定的时间点。转染后的肺腺癌A549 细胞测定结果如图5 显示,siRNA-UCA1 组对18F-FDG 的摄取率较NC 组明显降低,且差异有统计学意义。
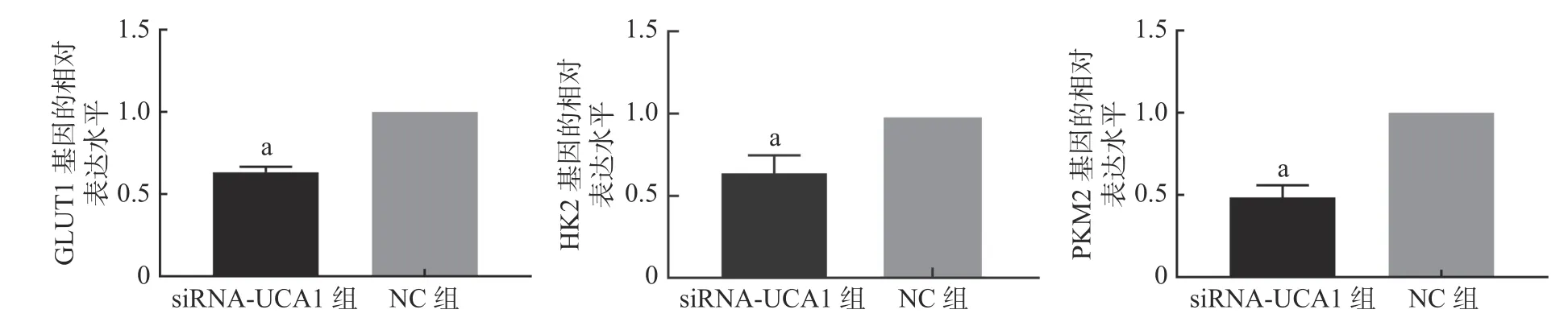
图1 qRT-PCR 检测3 种基因的表达情况 图中,a:与NC 组相比,差异均有统计学意义(t=19.66、5.81、11.98,均P<0.001)。qRT-PCR:实时荧光定量聚合酶链式反应;siRNA-UCA1:小干扰RNA 下调尿路上皮癌胚抗原1;GLUT:葡萄糖转运蛋白;HK:己糖激酶;PKM:丙酮酸激酶;NC:阴性对照Fig. 1 qRT-PCR was used to detect the expression of three genes
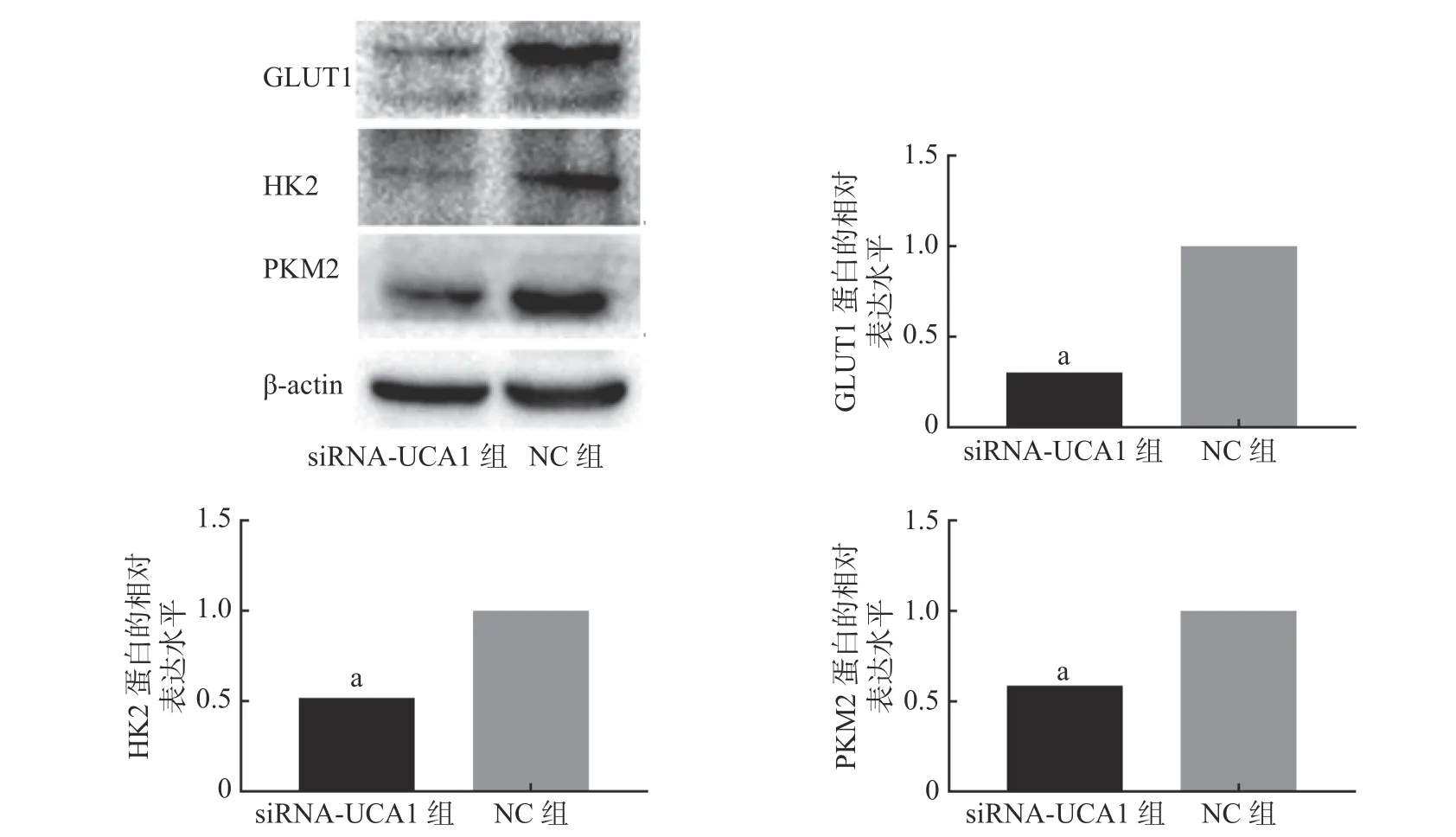
图2 Western blot 检测3 种蛋白的表达情况 图中,a:与NC 组相比,差异均有统计学意义(t=61.35、145.90、88.19,均P<0.001)。siRNA-UCA1:小干扰RNA 下调尿路上皮癌胚抗原1;GLUT:葡萄糖转运蛋白;HK:己糖激酶;PKM:丙酮酸激酶;NC:阴性对照Fig. 2 Western blot was used to detect the expression of three proteins
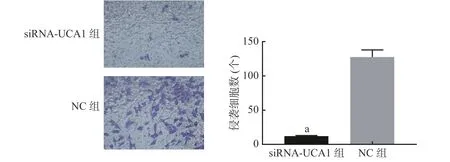
图3 siRNA-UCA1 对肺腺癌A549 细胞侵袭能力的影响(结晶紫染色,×400) 图中,a:与NC 组相比,差异有统计学意义(t=19.43,P<0.001)。siRNA-UCA1:小干扰RNA 下调尿路上皮癌胚抗原1;NC:阴性对照Fig. 3 Effect of siRNA-urothelial carcinoma associated 1 on the invasive ability of lung adenocarcinoma A549 cells( crystal violet staining, ×400)
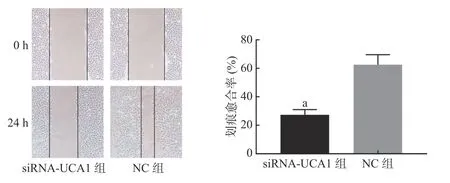
图4 siRNA-UCA1 对肺腺癌A549 细胞迁移能力的影响(×100) 图中,a:与NC 组相比,差异有统计学意义(t=7.71,P=0.002)。siRNA-UCA1:小干扰RNA 下调尿路上皮癌胚抗原1;NC:阴性对照Fig. 4 Effect of siRNA-urothelial carcinoma associated 1 on the migration ability of lung adenocarcinoma A549 cells(×100)
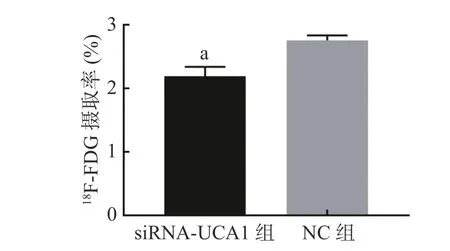
图5 siRNA-UCA1 对肺腺癌A549 细胞18F-FDG 摄取率的影响 图中,a:与NC 组相比,差异有统计学意义(t=5.79,P=0.004)。siRNA-UCA1:小干扰RNA 下调尿路上皮癌胚抗原1;FDG:氟脱氧葡萄糖;NC:阴性对照Fig. 5 Effect of siRNA-urothelial carcinoma associated 1 on the 18F-FDG uptake rate of lung adenocarcinoma A549 cells
3 讨论
目前针对恶性肿瘤的治疗手段包括手术切除并行同步放化疗,但整体预后仍不理想[7]。因此,研究肺癌病变的确切机制和发现新的关键靶点至关重要,对开展肺腺癌患者的个体化治疗和改善预后具有重要意义。
代谢重编程是肿瘤细胞的标志之一,并且与细胞生长调节的过程密切相关[8]。FDG 是一类葡萄糖类似物,可以反映葡萄糖的代谢情况。近年来随着PET 类的医学成像设备被临床广泛应用,FDG可以用于肿瘤的诊断、分期和治疗监测。由于细胞在快速增殖侵袭过程中所需的能量会急剧增加,可加快肿瘤发生发展的进程[9-10],因此研究肿瘤的代谢调节过程有利于寻找更好的治疗靶点。而lncRNA最开始被认为是基因转录的副产物,不存在生物学功能[11]。但近年来的研究结果表明,lncRNA 与肿瘤的发生发展有密切关系,已成为基因组学新的研究热点[12-13]。
目前,有研究结果表明UCA1 在肺癌细胞中呈高表达状态,并且可以促进小细胞肺癌的生长、侵袭和迁移[14-15],与本研究的结果一致。除此之外,本研究还通过qRT-PCR 及Western blot 实验检测UCA1 在A549 细胞糖代谢中的关键酶,发现下调UCA1 后,GLUT1、HK2 和PKM2 表达均显著降低,抑制细胞糖代谢的过程,这在国内外尚无报道。我们用Transwell 侵袭实验和划痕实验进行生物学行为的检测,结果表明,下调UCA1 后会使A549 细胞的侵袭和迁移能力显著下降,但具体机制仍需要进一步探索。有研究者发现,UCA1 在胰腺癌中可以通过Hippo 通路促进胰腺癌细胞侵袭和转移[16];对肝细胞癌的研究发现,UCA1 可以通过与miR-203 结合,激活转录因子Snail 2,促进肝癌细胞的增殖和侵袭[17]。因此,UCA1 沉默后,相应糖代谢指标表达降低,抑制肿瘤的能量代谢,使肿瘤侵袭转移能力下降。
综上所述,本研究发现UCA1 可以影响糖代谢的关键酶,并且促进肺腺癌A549 细胞的迁移和侵袭,这提示其可能在肺癌发生过程中起到癌基因的作用,有望成为肺癌治疗的潜在新靶点。本研究结果为进一步深入探讨UCA1 对促进肺癌细胞恶性生物学特征的分子机制奠定了基础。由于我们只进行了体外实验,尚存在不足之处,比如UCA1与临床病理因素及预后的关系等都值得进一步研究。接下来将进行机制研究,深入探讨UCA1 通过哪种信号通路对糖代谢指标进行调节,同时加上体外动物实验进行验证,以得到更明确的治疗效果。
利益冲突本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明张卉负责试验的设计与实施、论文的撰写;王姝负责数据的分析;李雪娜、李亚明负责论文的审阅与修订。
