茶多酚对可食性马铃薯淀粉/海藻酸钠复合膜性能影响及表征
2020-12-02卢俊宇吴贺君雷晏琳魏雪颖刘登鸿
卢俊宇 朱 芮 吴贺君 雷晏琳 肖 迪 焦 春 魏雪颖 刘登鸿
(四川农业大学食品学院,四川 雅安 625000)
随着人们对食品安全问题的担忧及环保意识的增强,塑料包装导致的环境污染已经引起广泛重视。可食性膜作为新型环保包装材料具有绿色环保、可自然降解、来源广泛等优点,近年来得到越来越多的关注与应用[1-3]。由于石油资源的短缺且制成塑料后难以降解,以多糖蛋白质和脂质等天然来源物质制成的可食膜受到极大关注[2]。
淀粉由于价格低、可再生以及可降解等优点成为可食性膜中的研究热点[1,4],其中马铃薯淀粉糊化温度、粘度、透明度等理化指标均优于其他淀粉,常作为可食性淀粉膜的成膜基材[5]。然而纯淀粉膜的耐水和力学性能等存在不足[6],因此有学者将淀粉与其他天然大分子物质制成复合膜来改善其相关性能[7]。海藻酸钠是一种常见的天然多糖,除具有生物降解性、可再生性、稳定性和安全性等优点外,还具有增稠作用,同时自身也可成膜,可被用来改善淀粉膜性能[8]。王静平[9]发现淀粉与海藻酸钠共混制备的复合膜可形成比纯淀粉膜更致密的网状结构。闻燕等[10]将淀粉与海藻酸钠共混发现膜的力学性能和阻隔性能得到显著改善。然而淀粉基复合膜因原料可食,自身营养丰富,容易被微生物所利用,因此强化其抗菌等功能特性以便拓展其在食品包装等方面的应用已成为当前该领域研究的重点方向之一[11]。
茶多酚(tea polyphenols,TP)是茶叶中多酚类物质的总称,作为天然多酚类物质其安全性高、成本低、无毒、来源丰富且具有生物相容性[12],因此越来越多的学者将TP作为天然抗氧化剂或抗菌剂用于强化可食性膜的功能活性。Qin等[13]将TP加入到壳聚糖膜发现,添加TP的壳聚糖膜具有抑菌性能,且可以延长食品保质期;Liu等[14]发现TP可以提高明胶膜的抗氧化活性;Wu等[15]发现TP可以提高柚皮粉生物活性膜的抗菌性和抗氧化活性。将TP等天然活性物质加入淀粉膜中可赋予其一定的抗菌性和抗氧化活性,同时对膜的其他理化性能也会产生影响,但目前相关研究报道较少。因此本试验将TP添加到马铃薯淀粉/海藻酸钠复合膜中,探究TP添加量对复合膜的外观、物理性能、力学性能、阻湿性能、抗菌和抗氧化性等的影响,以期为基于淀粉等多糖类可食性膜的功能化及其在食品包装方面的应用提供一定的理论指导和数据参考。
1 材料与方法
1.1 材料与试剂
马铃薯淀粉、TP(纯度≥98.0%),上海瑞永生物科技有限公司;海藻酸钠,成都市科龙化工试剂厂;丙三醇,成都金山化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(2,2-diphenyl-1-picrylhydrazyl,DPPH),源叶生物有限公司;福林酚,北京索莱宝科技有限公司;金黄色葡萄球菌(Staphylococcusaureus,ATCC29215)、大肠杆菌(Escherichiacoli,ATCC25922),四川农业大学食品微生物学实验室;没食子酸,成都科龙化学试剂厂;营养琼脂培养基、营养肉汤培养基,杭州微生物制剂有限公司。
1.2 仪器与设备
FA2004N型电子天平,上海箐海仪器有限公司;CS101-3型电热鼓风干燥箱,中国重庆实验设备厂;JB-5定时双向数显恒温磁力搅拌器,江苏金坛荣华仪器制造有限公司;SHB-3型循环水式多用真空泵,巩义市英峪华科仪器厂;SB-5200DTN超声波清洗机,宁波新芝生物科技股份有限公司;148-121型螺旋测微计器,郑州中天实验仪器有限公司;玻璃成膜板(模腔尺寸为20.0 cm×50.0 cm×0.5 cm),实验室自制;BHC-1300IIA2型洁净工作台,苏净集团苏州安泰空气技术有限公司;GZ-150-M霉菌培养箱,韶关市广智科技设备有限公司;WGW型光电雾度仪,上海仪电物理光学仪器有限公司;W3-031水蒸气透过率测试仪,济南兰光光电仪器有限公司;HD-B609B-S电子显示拉力试验机、HD-E702-100型恒温恒湿箱,海达国际仪器有限公司;FT-IR NICOLET IS 10型傅里叶变换红外光谱仪,美国赛默飞公司;TCP2全自动测色色差仪,北京奥依克光电仪器有限公司;DSA30光学接触角测定仪,德国KRUSS公司。
1.3 试验方法
1.3.1 添加不同质量分数TP的海藻酸钠/马铃薯淀粉膜制备方法 称取7 g马铃薯淀粉、2 g甘油溶于50 mL蒸馏水中备用;称取3 g海藻酸钠溶于60℃ 100 mL蒸馏水中,混合马铃薯淀粉溶液和海藻酸钠溶液,充分搅拌;将混合溶液置于恒温磁力搅拌器70℃、200 r·min-1搅拌30 min;然后向混合溶液加入不同质量分数[0(空白组)、1.25%、2.50%、5.00%、7.50%、10.00%]的TP,继续70℃搅拌10 min。将成膜液倒入真空抽滤瓶,保持抽滤瓶负压≥0.09 MPa,持续30 min,期间将抽滤瓶放入超声波清洗机振动,促进气泡排除;最后将成膜液倒入玻璃成膜板,流延均匀后放入55℃烘箱烘干,18 h后揭膜,置于23℃、55%(相对湿度)的恒温恒湿箱中平衡48 h。
1.3.2 傅里叶变换红外光谱分析 用傅里叶变换红外光谱仪对空白马铃薯淀粉/海藻酸钠膜和含不同质量分数TP的马铃薯淀粉/海藻酸钠膜进行红外光谱分析,用于表征膜结构,扫描范围为4 000~500 cm-1。
1.3.3 复合膜性能测定
1.3.3.1 厚度测定 根据《GB/T 6672-2001塑料薄膜和薄片厚度测定 机械测量法》[16],用螺旋测微器在被测膜上随机取点测定,测量5次取平均值,以μm为单位。
1.3.3.2 色差测定 采用色差计测定膜的色泽差异,L*值代表明度;a*值代表红绿色度,正值表示红色程度,负值表示绿色程度;b*值代表黄蓝色度,正值表示黄色程度,负值表示蓝色程度;用标准白板GSB A67002-86(L=99.77、a=0.03、b=0.30)校正,根据公式计算总色差(△E):
(1)。
1.3.3.3 透光率测定 参照《GB/T 2410-2008透明塑料透光率和雾度的测定》[17],采用光电雾度仪测定光通量T,将膜裁成正方形(50 mm×50 mm),每组做5个平行,取平均值,按照公式计算透光率(Tt):
(2)
式中,T1和T2分别为入射光通量和透射光通量,%;其中T1为100%。
1.3.3.4 水蒸气透过系数测定 参照《GB/T 1037-1988塑料薄膜和片材透水蒸气性试验方法 杯式法》[18]及《GB/T 16928-1997包装材料试验方法 透湿率》[19]进行测定。试样面积33 cm2,采用水蒸气透过率测试仪配套软件计算水蒸气透过系数(water vapor permeability,WVP),单位g·cm-1·s-1·Pa-1,测试3次取平均值。
(3)
式中,△M为t 时间内质量变化,g;d为厚度,cm;A为水蒸气透过的有效面积,cm2;t为质量变化稳定后的两次间隔时间,s;△P为样品两侧水蒸气压差,Pa。
1.3.3.5 抗张强度、断裂伸长率测定 参照《GB/T 1040.3-2006塑料 拉伸性能的测定 第3部分:薄塑和薄片的试验条件》[20],并稍作修改。将膜裁成100 mm×10 mm的薄条,测量厚度;在拉力试验机上测定膜的抗张强度(tensile strength,TS)和断裂伸长率(elongation at break,EAB),设定测试速率为50 mm·min-1, 初始距离为100 mm,每组测试10次取平均值。TS单位为MPa。按照公式计算TS:
(4)
式中,F为试样断裂时承受的最大张力,N;A为试样横截面积,mm2。
EAB是膜受到张力至断裂时所增加长度与原试样长度的百分比,测量TS时同步得出。按照公式计算EAB:
(5)
式中,L0为试样测试前的长度,mm;L为试样在断裂时的长度,mm。
1.3.3.6 含水量和溶解度测定 参照Gontard等[21]的方法,将膜样(20 mm×20 mm)在室温下称重(m0),然后在100℃条件下干燥至恒量,称重(m1)。将恒重样品放入盛有50 mL 蒸馏水的离心管中,于25℃条件下浸泡24 h,并定时搅动。将未溶解的膜取出,用滤纸吸干膜表面水分,于100℃干燥至恒重,称重(m2)。根据公式计算含水量(water content,WC)和溶解度(solubility,S):
(6)
(7)。
1.3.4 复合膜抗氧化能力测定
1.3.4.1 DPPH自由基清除率测定 参照钟宇等[22]的方法,略作修改。避光条件下,将3 mg DPPH加入到100 mL无水甲醇中,配置成75 μmol·L-1的DPPH-甲醇溶液,4℃冷藏备用。将膜裁成40 mm×40 mm的方块,置于盛有100 mL蒸馏水的烧杯中,25℃恒温磁力搅拌至完全混匀。以蒸馏水为空白对照,取上述溶液1 mL加入到4 mL DPPH-甲醇溶液中震荡混匀,避光静置60 min,测定516 nm波长处的吸光度值。按照公式计算 DPPH自由基清除率:
(8)
式中, A样为样品吸光度值;A空为空白试样吸光度值。
1.3.4.2 总酚含量测定 参照Singleton等[23]的方法,略作修改。称取0.125 g复合膜,放入15 mL蒸馏水并浸泡24 h,制得膜溶液。取0.1 mL膜溶液,再加入7 mL蒸馏水和0.5 mL福林酚试剂,轻轻摇晃,静置8 min,之后加入1.5 mL 10%的Na2CO3溶液,最后加入0.9 mL蒸馏水混匀。置于暗室中使其充分反应2 h,之后用紫外分光光度计测定浸液在765 nm波长处的吸光度值。配制浓度为0~15 μg·mL-1的没食子酸水溶液,按照上述步骤测定765 nm波长处的吸光度值,绘制标准曲线,用于计算样品所含总酚含量(以没食子酸当量GAE计算,单位mg GAE·g-1)。
1.3.5 复合膜抑菌性能测试
1.3.5.1 抑菌圈法测定膜抗菌能力 参照Otoni等[24]的方法,利用抑菌圈法测定膜对大肠杆菌(Escherichiacoli)、金黄色葡萄球菌(Staphylococcusaureus)的抑菌效果,裁取直径15 mm圆形膜片贴于琼脂培养皿中,在37℃恒温培养箱培养24 h后测定膜的抑菌圈直径,得出抑菌圈面积。
1.3.5.2 十字交叉法定性测定膜抑菌能力 参照十字交叉划线法[25],测试膜对E.coli的抑菌性能:将含膜样品裁成10 mm×60 mm的长条,紫外光灭菌30 min备用。配制约0.5麦氏浊度的E.coli菌悬液。将膜片贴于固体琼脂营养培养基的平板中央,用灭菌棉签蘸取少量菌液,靠近薄膜两侧垂直划线(图1)。将培养基在37℃恒温培养箱培养24 h,观察细菌生长情况。

图1 十字交叉划线法示意图Fig.1 The mode of cross-streak method for inhibition zone
1.4 数据分析
采用SPSS 24.0软件处理试验数据,并通过Duncan多重检验法检验显著性,试验数据用平均值±标准偏差表示,P<0.05 为差异显著。以Origin 2017软件制图以及拟合数据。
2 结果与分析
2.1 傅里叶变换红外光谱分析结果
由图2可知,3 300 cm-1附近吸收峰来自O-H 的对称和不对称伸缩振动[26],与空白组相比,当TP 含量为2.50%时,该吸收峰强度明显下降且略微向低波数移动,表明TP与淀粉中羟基形成分子间氢键[27]。2 927 cm-1附近吸收峰源于淀粉亚甲基C-H不对称伸缩振动,当淀粉分子中羟基与其他分子发生氢键结合,羟基对亚甲基上两个氢原子的吸引力减小会导致2 927 cm-1峰值降低[28];加入TP后,该波段峰值强度降低并逐渐向低频率移动,表明TP可与淀粉分子羟基发生氢键结合,这与3 300 cm-1处吸收峰结果一致。1 602 cm-1附近吸收峰为海藻酸钠COO-的不对称与对称伸缩振动峰[29],随着TP的加入,峰的强度减弱,并逐渐向高频率处移动,表明TP与海藻酸钠COO-发生了结合或分子间氢键作用,从而降低了该波段峰值。994 cm-1处吸收峰来源于甘油分子中 O-H与淀粉分子糖苷键上氧原子形成的氢键吸收峰[30]。
2.2 不同质量分数TP对复合膜透光率和色差的影响
由表1可知,随着TP质量分数的增加,复合膜的L*值逐渐降低,表明复合膜的亮度减弱;而b*值及△E值显著增加,表明复合膜逐渐变黄,且更加鲜艳。

图2 TP和含不同质量分数TP的马铃薯淀粉/海藻酸钠膜的傅里叶变换红外光谱图Fig.2 Fourier transform infrared spectra of TP and potato starch/sodium alginate films with different contents of TP
这是由于TP本身呈黄褐色,随着TP质量分数的增加,膜的黄色逐渐加深。复合膜的透光率随TP质量分数增加而下降,这是由于加入TP后,其与马铃薯淀粉和海藻酸钠基质间发生了相互作用,阻碍了光的透射,从而使复合膜透光率下降;同时溶质增加导致膜厚度变大也会进一步阻碍光线的透过。此外,由图3可知,随着TP质量分数增加,复合膜亮度有所减弱且逐渐变黄;但各组复合膜均能清晰看到所覆盖图案,表明透光率良好。
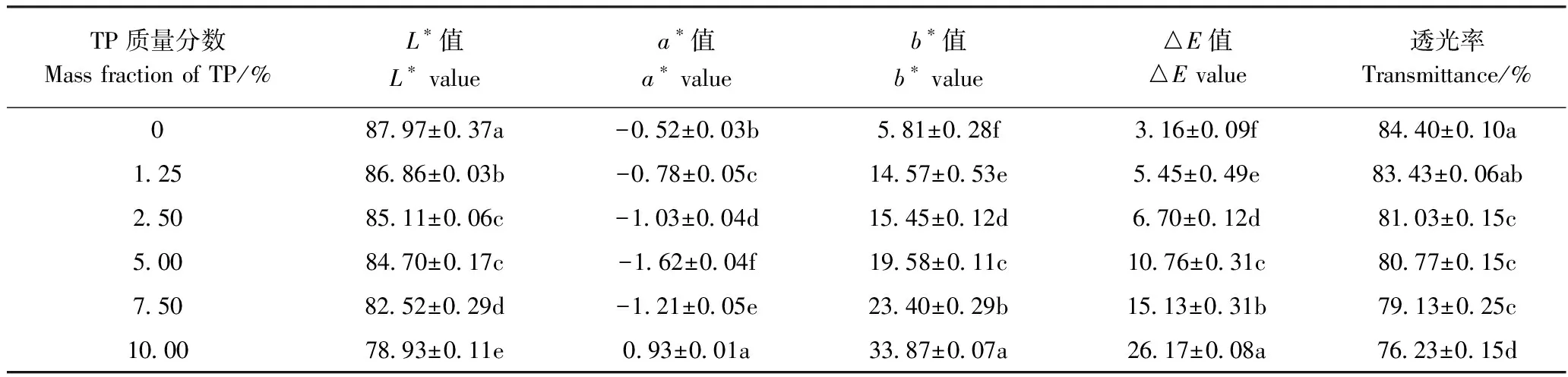
表1 不同质量分数TP对复合膜透光率和色差的影响Table 1 Effect of TP content on transmittance and color difference of the composite films
2.3 不同质量分数TP对复合膜厚度、水分含量、溶解度、水蒸气透过系数的影响
由表2可知,复合膜的厚度随着TP质量分数的增加而显著上升,这主要是由于TP的加入使膜溶质增加。当TP质量分数介于0~5.00%时,复合膜的含水量和溶解度变化不显著,当TP质量分数大于5.00%时,复合膜的含水量和溶解度显著高于空白组,可能是多余的TP会迁移到膜表面增强其亲水性,导致复合膜的含水量和溶解度增加。复合膜的WVP随着TP质量分数增加呈现先减小后增大的趋势,当TP质量分数为5.00%时达到最低值(2.33×10-12g·cm-1·s-1·Pa-1), 显著低于空白组。说明适量添加TP有利于改善复合膜的水蒸气阻隔性能。

图3 不同质量分数TP的马铃薯淀粉/海藻酸钠膜的照片Fig.3 Picture of potato starch/sodium alginate films with different contents of TP
2.4 不同质量分数TP对复合膜力学性能的影响
由图4可知,TP质量分数从0增加至5.00%时复合膜的TS和EAB持续增加,当TP质量分数继续增加,复合膜的TS和EAB显著降低。与空白组相比,添加5.00% TP复合膜的TS为20.78 MPa,约增加32%,EAB为24.33%,约增加6.5个百分点。这是由于马铃薯淀粉/海藻酸钠膜本身含水量较高,适量添加TP可填充马铃薯淀粉-海藻酸钠骨架之间的空隙,使得膜结构更致密;另一方面淀粉网络结构与适量多酚化合物可形成氢键作用[31],使膜力学性能提高,红外

表2 不同质量分数TP对复合膜厚度、水分含量、溶解度、水蒸气透过系数的影响Table 2 Effect of TP content on film thickness, water content, solubility and water vapor permeability

注:不同字母表示同一指标间差异显著(P<0.05)。下同。Note:Different lowercase letters indicate significant differenceat 0.05 level among the same index. The same as following.图4 不同质量分数TP对复合膜抗张强度和断裂伸长率的影响Fig.4 Effect of TP content on tensile strength and elongation at break of the composite films
光谱表征也能证实该结果。然而当TP质量分数大于5.00%时,不仅有多余的TP颗粒在膜中游离,复合膜原有分子间作用的平衡被打破,使聚合物松弛过程加快,致密性降低[32];且多余TP颗粒会影响膜的网络结构稳定性,使得膜易撕裂[33],因此过量TP导致复合膜的TS和EAB显著降低。
2.5 不同质量分数TP对复合膜总酚含量和DPPH自由基清除率的影响
由表3可知,空白组复合膜总酚含量与DPPH自由基清除率均为0。随着TP质量分数的增加,复合膜的DPPH自由基清除率和总酚含量显著提高。这是由于TP是一种多酚类物质,存在酪氨酸和组氨酸等氨基酸残基,这些残基能够与Folin-Ciocalteu试剂发生反应[34];且TP中含有的儿茶素对O2-、·OH清除率可达98%以上[35]。因此随TP质量分数增加,复合膜的抗氧化能力逐渐增强。
2.6 不同质量分数TP对复合膜抗菌性能的影响
2.6.1 抑菌圈法测定膜抑菌性能 由表4和图5可知,空白组复合膜对金黄色葡萄球菌和大肠杆菌均无抑菌效果。随TP质量分数的增加,复合膜对金黄色葡萄球菌的抑菌圈面积持续增大,而对于大肠杆菌因抑菌圈界限不明显而无法得到具体数据用于效果评价。
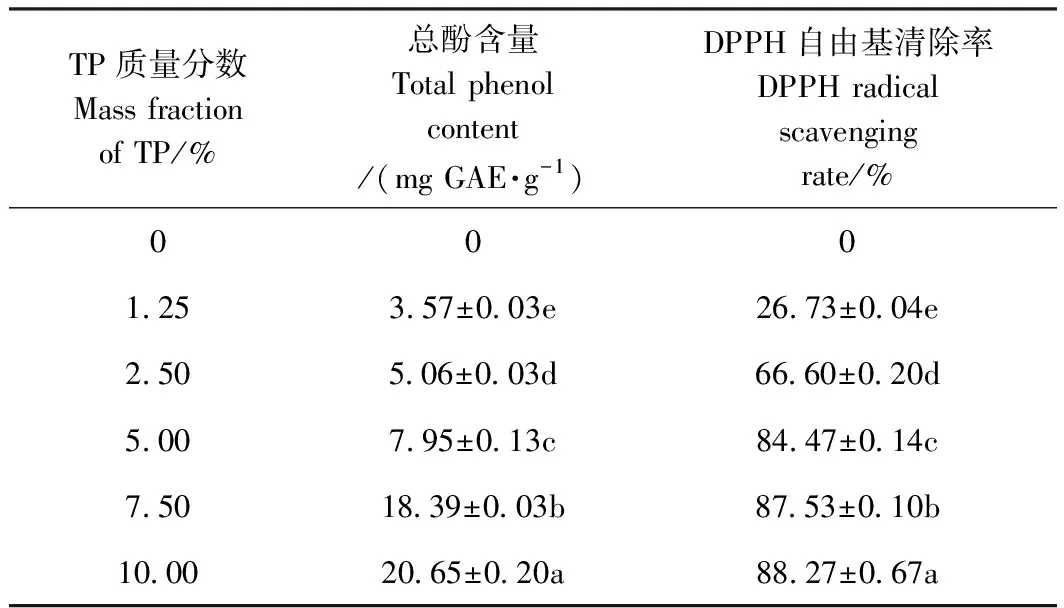
表3 不同质量分数TP对复合膜总酚含量和DPPH自由基清除率的影响Table 3 Effects of TP content on total phenol content and DPPH free radical scavenging rate of the composite films
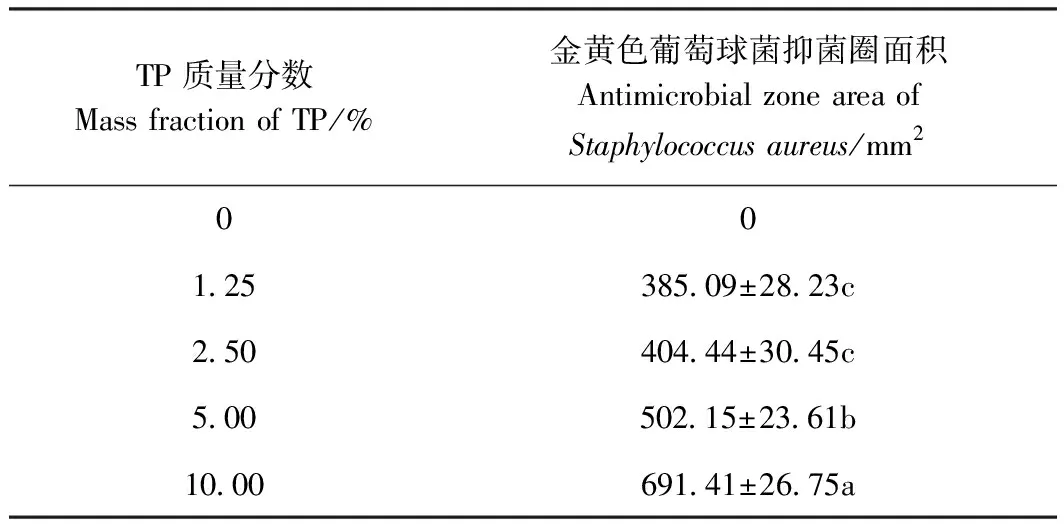
表4 不同质量分数TP对复合膜金黄色葡萄球菌抑菌圈面积的影响Table 4 Effects of TP content on antimicrobial zone area(Staphylococcus aureus) of the composite films

注:A:大肠杆菌;B:金黄色葡萄球菌。Note:A:E. coli. B:Staphylococcus aureus.图5 不同质量分数TP对复合膜抑菌圈的影响Fig.5 Effects of TP content on the inhibitory zone of the composite films

图6 十字交叉法测定复合膜对大肠杆菌的抑菌作用Fig.6 Determination of bacteriostatic capability of composite films on E.coli by cross-section method
2.6.2 十字交叉法测定复合膜抑菌性能 由图6可知,TP质量分数为0时,复合膜四周及膜上长满大肠杆菌,复合膜无抑菌效果。随着TP质量分数的增加,复合膜本身及周围的菌落生长明显减少,尤其是当TP质量分数为10.00%时,复合膜的边缘几乎未见任何菌落,表明高TP质量分数的复合膜对大肠杆菌同样具有明显抑菌效果[25]。这是因为与抑菌圈法相比,十字交叉法中使用的膜片试样面积较大,TP负载量更多,同时培养基中菌液接种量较低,因此复合膜对大肠杆菌有明显的抑制作用。TP的抑菌原理主要基于TP分子中的众多酚羟基可与蛋白质分子中的氨基或羧基发生氢结合,其疏水性的苯环结构也可与蛋白质发生疏水结合;且TP与蛋白质之间可发生多点结合作用[36],从而导致微生物失活。
3 讨论
TP作为一种具有良好抗菌活性和抗氧化性能的天然活性物质,具有安全性高、生物相容性好等优势,在可食膜的功能化改性等方面得到研究和应用[37]。本研究结果表明,TP的加入可与淀粉和海藻酸钠基质间形成氢键等相互作用,因此红外光谱图中3 300 cm-1、2 927 cm-1等分别对应于O-H和C-H不对称伸缩振动的吸收峰强度有所降低或略微向低波数移动,这与Lei等[37]制备的添加TP的果胶/魔芋胶复合膜以及Dou等[38]制备的添加TP的明胶/海藻酸钠复合膜中观察到的结果一致。由于本研究所用TP原料本身是一种黄色粉末,故最终制备的含TP的马铃薯淀粉/海藻酸钠复合膜呈浅黄色,且随着TP质量分数增加,复合膜的L*值和透光率不断降低,b*值、ΔE值逐渐升高[37-38],但复合膜总体上外观平整光滑,同时具有良好的透光性,在包装材料领域具有潜在的应用价值。
随着TP质量分数增加,复合膜的含水量升高,且一定程度增加了膜的溶解度。WVP是评价包装膜阻隔性能的一项重要指标。本研究结果表明,随着TP质量分数的增加,复合膜的WVP先降低再增加,当TP质量分数为5.00%时达到最低值。这是因为一方面TP作为小分子物质,适量的TP填补了马铃薯淀粉-海藻酸钠骨架间的空隙;另一方面淀粉网络结构与适量多酚化合物可形成氢键,限制了羟基基团与水的相互作用[31],这与图2中红外光谱的显示结果相符。然而,过量的TP会在膜内游离,易在膜的表面析出结晶,导致膜表面亲水性增加,会对其耐水性能产生不利影响[15,37,39]。这与Feng等[31]制备的含TP的的淀粉膜、Wu等[15]制备的含TP的柚皮基生物活性膜、蓝鸿雁[39]制备的TP缓释抗氧化膜得出的过量TP会影响膜的耐水性结果一致。
随着TP的加入,复合膜的TS和EAB均呈先增加后减小的趋势,这与孙琳琳等[40]的研究结果一致;也有文献指出在羟丙基高直链玉米淀粉膜中,随着TP含量增加,膜的TS先降低后逐渐增加,EAB先降低后逐渐增加[31];或随TP含量增加复合膜的EAB逐渐降低,而TS先增加后降低[15,38]或不断增加[41]。造成上述差异的原因可能是成膜基质、膜组分之间的相互作用及制膜工艺等的不同,因此TP对不同基质可食膜力学性能的影响机制,仍有待进一步研究。
随着TP质量分数的增加,复合膜的DPPH自由基清除率不断增大,当TP质量分数达到10.00%时,膜的自由基清除率为88.27%,总酚含量为20.65 mg GAE·g-1,说明复合膜具有较强的抗氧化活性,这与Liu等[14]制备的含TP的明胶膜、Wu等[15]制备的含TP的柚皮基生物活性膜研究结果一致。本研究还发现添加TP的复合膜对以金黄色葡萄球菌为代表的革兰氏阳性菌和以大肠杆菌为代表的革兰氏阴性菌具有一定的抑菌效果,同时抑菌圈法发现复合膜对前者的抑制作用更强。这源于革兰氏阴性菌的肽聚糖层外还存在一层脂多糖外膜,从而阻止TP与肽聚糖层结合,造成了抑菌效果差异[42]。
综上所述,TP的加入不仅可以提升马铃薯淀粉/海藻酸钠复合膜的抗菌、抗氧化等功能活性,而且适当添加TP对复合膜的力学和阻隔性能等具有一定增强效应,在实现可食膜的高性能化和多功能化方面具有潜在的应用价值。
4 结论
本研究以马铃薯淀粉/海藻酸钠膜为基膜,向膜中添加不同质量分数TP,结果发现TP对复合膜理化特性,抗菌抗氧化性能等均有影响。当TP的质量分数为5.00%时,可食性马铃薯淀粉/海藻酸钠膜具有最佳的力学性能和阻湿性能,同时可以显著提升复合膜的抗菌和抗氧化活性。但本研究仅考察了茶多酚添加量对复合膜结构和性能的影响,并未探究复合膜在具体食品包装方面的实际应用效果,这将是下一步研究的重点。
