异戊烯基查尔酮的合成与抗肿瘤活性
2020-12-01曾晓萍梁光义孟雪玲徐必学
王 霞, 曾晓萍, 梁光义, 孟雪玲*, 徐必学*
(1. 贵州中医药大学,药学院,贵州 贵阳 550025; 2. 贵州医科大学 省部共建药用植物功效与利用国家重点实验室,贵州 贵阳 550014; 3. 贵州省中国科学院天然产物化学重点实验室,贵州 贵阳 550014)
癌症是导致全世界发病率和死亡率的第二大疾病[1]。据世界卫生组织报告,2018年全球新增1810万癌症患者,死于癌症的患者达960万人[2-3],常规化疗是治疗癌症的主要方法,常用的化疗药物可通过抑制核酸蛋白质的合成代谢、有丝分裂、和干扰DNA复制等[4],有效抑制癌细胞增殖。尽管在开发更好的抗癌药物方面做出了巨大的努力,但缺乏选择性和耐药性削弱了癌症化疗的效果[5],例如,卡培他滨和其前体化合物可诱发心脏毒性,引起急性冠脉综合征[6],顺铂可诱发高血压,增加心脏负荷和肝损伤等[7-8],因此,寻找和开发更好的治疗策略和更有效的抗癌药物仍然是一项艰巨的任务。
异戊烯基查尔酮类化合物具有抗肿瘤[9]的作用,同时还有抗疟疾[10]、抗炎[11]、抗菌[12]、抗病毒[13-14]、抗氧化[15]等生物活性。Heilmann等[16]合成了43个黄腐酚类似物(Chart 1),发现含硝基取代的查尔酮化合物对HeLa细胞具有很好的细胞毒性(IC50=1.4 μmol/L)。Calvo-Castro等[17]研究了啤酒花中异戊烯基查尔酮和黄酮类化合物的保健和抗癌活性,其中8-prenylnaringenin(8-PN)能提高PBMC的存活率且生物利用度优于其同分异构体。Ma等[18]合成3-哌嗪取代的异戊烯基查尔酮(MY3)能增加DOX在细胞内的积累,抑制P-gp在mRNA和蛋白水平上的表达,且对MCF7细胞和MCF-7/DOX细胞有明显抑制作用。
本课题组[19-20]前期设计合成的化合物C10(Chart 1)对前列腺癌细胞株(PC3),乳腺癌细胞株(MDA),人红白血病细胞株(HEL)及红白血病细胞株(K562)具有较好的抑制活性,为进一步考察查尔酮B环不同取代基以及引入各种杂环对其抗肿瘤活性的影响,设计合成了B环含三羟基(或烷氧基)和单异戊烯基取代的查尔酮衍生物。以2,4,6-三羟基苯乙酮作为起始原料,通过与MOMCl选择性反应得单羟基中间体1,再经异戊烯基取代得到已知化合物2;2经克莱森重排得已知化合物3;3经甲基化反应得已知化合物4[16],将4与3-溴-4-甲氧基苯甲醛、糠醛或吡啶-3-甲醛等不同芳基甲醛进行缩合得中间体5;5经酸性条件下脱MOM保护基得目标化合物6a~6i;将中间体4在酸性条件下脱MOM保护基[21]得中间体7;7经甲基化得中间体8,然后分别与吡啶-3-甲醛、2-噻吩甲醛、2-萘甲醛等经羟醛缩合即得目标化合物9a~9f(Scheme 1)。所得目标化合物均经1H NMR、13C NMR和ESI-MS进行了结构确证,采用MTT法评价了所得目标化合物对5种肿瘤细胞株的体外抑制活性。
1 实验部分
1.1 仪器与试剂
Bruker Avance NEO 600 MHz型核磁共振仪(DMSO-d6或CDCl3为溶剂,TMS为内标);Hewlett-Packard HP-5793型质谱仪。
参照文献[16]方法,合成化合物1、2、3和4;其余所用试剂均为分析纯。
1.2 合成
(1)5的合成(以5a为例)
取化合物4167 mg(0.49 mmol)置于10 mL反应瓶中,氩气保护下,加入乙醇和1,4-二氧六环(3 mL/2 mL),搅拌10 min,加入3-溴-4-甲氧基苯甲醛212 mg(0.99 mmol),再加入148 μL NaOH(40%,m/V),室温搅拌反应19 h(TLC检测)。将反应液分散于乙酸乙酯和1 mol·L-1稀盐酸中,分液,乙酸乙酯层依次用水和饱和氯化钠溶液洗涤,无水MgSO4干燥,浓缩,残余物经硅胶柱层析(洗脱剂:乙酸乙酯/石油醚=1/25,V/V) 纯化得黄色固体5a168.0 mg, 收率88.6%, m.p.219.8~220.5 ℃;1H NMR(CDCl3, 600 MHz)δ: 7.73(d,J=2.1 Hz, 1H), 7.45(dd,J=8.6 Hz, 2.1 Hz, 1H), 7.29(d,J=16.1 Hz, 1H), 6.88(d,J=3.4 Hz, 1H), 6.86(d,J=10.7 Hz, 1H), 6.58(s, 1H), 5.23(s, 2H), 4.90(s, 2H), 3.91(s, 3H), 3.75(s, 3H), 3.49(s, 3H), 3.41(s, 3H), 3.34(d,J=6.8 Hz, 2H), 1.75(s, 3H), 1.67(s, 3H);13C NMR(CDCl3, 151 MHz)δ: 193.7, 157.7, 157.4, 156.3, 154.1, 142.3, 133.0, 131.2, 129.2, 129.0, 127.8, 123.2, 118.3, 117.2, 112.2, 111.8, 100.8, 94.9, 94.4, 57.5, 56.4, 56.1, 56.1, 25.7, 23.1, 17.9; MS(ESI)m/z: 558.4{[M+Na]+}。用类似方法合成中间体5b~5i。
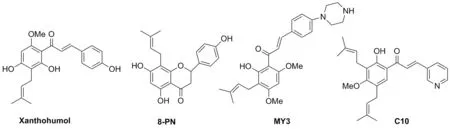
Chart 1

Scheme1
(2)6的合成
取5a168 mg(0.31 mmol)置于10 mL反应瓶中,氩气保护下,加入甲醇(28 mL),搅拌溶解,加入1.7 mL稀盐酸(3 mol·L-1), 65 ℃反应3 h(TLC检测)。将反应液分散于乙酸乙酯和水中,乙酸乙酯层依次用水和饱和氯化钠溶液洗涤,无水MgSO4干燥,浓缩,残余物经硅胶柱层析(洗脱剂:乙酸乙酯/石油醚=1/10,V/V)纯化得黄色粉末状固体6a42.1 mg,收率30.0%, m.p.219~220 ℃;1H NMR(DMSO-d6, 600 MHz)δ: 14.43(s, 1H), 10.64(s, 1H), 7.93(d,J=2.3 Hz, 1H), 7.79(d,J=15.6 Hz, 1H), 7.74(d,J=8.6 Hz, 1H), 7.63(d,J=15.6 Hz, 1H), 7.17(d,J=7.6 Hz, 1H), 6.09(s, 1H), 5.15(t,J=6.6 Hz, 1H), 3.91(s, 3H), 3.86(s, 3H), 3.15(d,J=7.0 Hz, 2H), 1.70(s, 3H), 1.61(s, 3H);13C NMR(DMSO-d6, 151 MHz)δ: 192.0, 165.0, 163.2, 161.1, 157.3, 140.5, 133.3, 130.4, 129.7, 126.9, 123.4, 113.4, 111.7, 107.8, 105.1, 91.5, 56.9, 56.3, 25.9, 21.5, 18.1; MS(ESI)m/z: 446.1{[M-H]-}。
用类似方法合成6b~6i。
6b: 黄色粉末状固体,收率38.4%, m.p.173~175 ℃;1H NMR(CDCl3, 600 MHz)δ: 14.69(s, 1H), 7.80(d,J=15.3 Hz, 1H), 7.75(d,J=15.4 Hz, 1H), 7.19(d,J=8.2 Hz, 1H), 7.13(s, 1H), 6.89(d,J=8.4 Hz, 1H), 6.29(s, 1H), 5.95(s, 1H), 5.29(t,J=7.6 Hz, 1H), 4.15(q,J=7.1 Hz, 2H), 3.93(s, 3H), 3.89(s, 3H), 3.41(d,J=7.3 Hz, 2H), 1.83(s, 3H), 1.78(s, 3H), 1.49(s, 3H);13C NMR(CDCl3, 151 MHz)δ: 192.7, 165.2, 161.8, 161.1, 150.4, 149.3, 142.5, 135.8, 128.5, 125.6, 122.6, 121.8, 112.3, 110.8, 106.4, 106.1, 91.2, 64.4, 55.9, 55.7, 25.8, 21.6, 17.9, 14.7; MS(ESI)m/z: 412.5{[M-H]-}。
6c: 黄色粉末状固体,收率45.4%, m.p.154~156 ℃;1H NMR(CDCl3, 600 MHz)δ: 14.68(s, 1H), 7.79(d,J=15.5 Hz, 1H), 7.74(d,J=15.5 Hz, 1H), 7.18(dd,J=8.4 Hz, 2.0 Hz, 1H), 7.12(d,J=2.0 Hz, 1H), 6.90(d,J=8.3 Hz, 1H), 6.40(s, 1H), 5.94(s, 1H), 5.29(t,J=7.2 Hz, 1H), 4.63~4.59(m, 1H), 3.90(s, 3H), 3.87(s, 3H), 3.40(d,J=7.2 Hz, 2H), 1.82(s, 3H), 1.76(s, 3H), 1.40(s, 3H), 1.39(s, 3H);13C NMR(CDCl3, 151 MHz)δ: 192.7, 165.1, 161.8, 161.1, 150.1, 149.5, 142.4, 135.5, 128.6, 125.6, 122.4, 121.8, 114.6, 111.3, 106.5, 106.1, 91.1, 71.3, 55.9, 55.7, 25.8, 22.0, 21.6, 17.9, 1.0; MS(ESI)m/z: 425.5{[M-H]-}。
6d: 黄色粉末状固体,收率25.7%, m.p.152~153 ℃;1H NMR(CDCl3, 600 MHz)δ: 14.91(s, 1H), 7.82(d,J=15.3 Hz, 1H), 7.75(d,J=15.4 Hz, 1H), 7.52(s, 1H), 7.51(s, 1H), 6.70(s, 1H), 6.69(s, 1H), 6.23(s, 1H), 5.94(s, 1H), 5.30(t,J=7.0 Hz, 1H), 3.89(s, 3H), 3.40(d,J=7.2 Hz, 2H), 3.03(s, 6H), 1.83(s, 3H), 1.77(s, 1H);13C NMR(CDCl3, 151 MHz)δ: 192.7, 165.1, 161.4, 161.1, 151.8, 143.7, 135.6, 130.3, 123.5, 122.4, 122.0, 111.9, 106.3, 91.0, 55.7, 40.2, 25.8, 21.7, 17.9; MS(ESI)m/z: 404.2{[M-H]-}。
6e: 黄色粉末状固体,收率65.7%, m.p.170~171 ℃;1H NMR(CDCl3, 600 MHz)δ: 14.62(s, 1H), 7.91(d,J=15.3 Hz, 1H), 7.74(d,J=15.2 Hz, 1H), 7.37(d,J=5.1 Hz, 1H), 7.30(d,J=3.6 Hz, 1H), 7.07(dd,J=5.1 Hz, 3.6 Hz, 1H), 6.26(s, 1H), 5.93(s, 1H), 5.29(t,J=7.2 Hz, 1H), 3.89(s, 3H), 3.40(d,J=7.2 Hz, 2H), 1.83(s, 3H), 1.77(s, 3H);13C NMR(CDCl3, 151 MHz)δ: 192.1, 165.2, 162.0, 161.2, 141.3, 135.9, 134.8, 131.2, 128.3, 128.1, 126.8, 121.7, 106.3, 106.0, 91.2, 55.7, 25.8, 21.6, 17.9; MS(ESI)m/z: 343.4{[M-H]-}。
6f: 黄色粉末状固体,收率59.0%, m.p.188~190 ℃;1H NMR(DMSO-d6, 600 MHz)δ: 14.52(s, 1H), 10.63(s, 1H), 8.04~7.99(m, 1H), 7.76~7.72(m, 2H), 7.68~7.63(m, 1H), 7.55~7.50(m, 1H), 6.09(s, 1H), 5.14(t,J=7.3 Hz, 1H), 3.87(s, 3H), 3.14(d,J=7.1 Hz, 2H), 1.70(s, 3H), 1.61(s, 3H);13C NMR(DMSO-d6, 151 MHz)δ: 192.4, 165.0, 163.2, 161.1, 138.8, 136.2, 130.4, 130.3, 128.4, 127.4, 126.1, 123.4, 107.8, 105.0, 91.4, 56.2, 26.0, 21.5, 18.1; MS(ESI)m/z: 343.4{[M-H]-}。
6g: 黄色粉末状固体,收率55.4%, m.p.144~145 ℃;1H NMR(DMSO-d6,600 MHz)δ: 14.54(s, 1H), 10.66(s, 1H), 7.89(d,J=1.8 Hz, 1H), 7.72(d,J=15.4 Hz, 1H), 7.56(d,J=15.4 Hz, 1H), 7.00(d,J=3.4 Hz, 1H), 6.67(dd,J=3.4 Hz, 1.8 Hz, 1H), 6.10(s, 1H), 5.14(t,J=7.2 Hz, 1H), 3.85(s, 3H), 3.14(d,J=7.0 Hz, 2H), 1.70(s, 3H), 1.61(s, 3H);13C NMR(DMSO-d6, 151 MHz)δ: 191.4, 165.1, 163.2, 161.0, 151.9, 146.5, 130.5, 129.2, 124.6, 123.4, 117.1, 113.5, 107.9, 105.0, 91.5, 56.2, 25.9, 21.5, 18.1; MS(ESI)m/z: 327.1{[M-H]-}。
6h: 黄色粉末状固体,收率70.1%, m.p.144~145 ℃;1H NMR(CDCl3, 600 MHz)δ: 14.32(s, 1H), 10.72(s, 1H), 8.89(d,J=2.2 Hz, 1H), 8.60(dd,J=4.8 Hz, 1.6 Hz, 1H), 8.17~8.14(m, 1H), 7.99(d,J=15.8 Hz, 1H), 7.70(d,J=15.7 Hz, 1H), 7.48(dd,J=8.0 Hz, 4.7 Hz, 1H), 6.11(s, 1H), 5.15(t,J=7.1 Hz, 1H), 3.88(s, 3H), 3.15(d,J=7.2 Hz, 2H), 1.70(d,J=1.3 Hz, 3H), 1.61(d,J=1.5 Hz, 3H);13C NMR(CDCl3, 151 MHz)δ: 191.4, 164.6, 163.1, 160.7, 150.6, 149.8, 137.8, 134.7, 130.9, 130.0, 129.4, 124.1, 122.9, 107.3, 104.6, 91.0, 55.8, 25.5, 21.0, 17.6; MS(ESI)m/z: 338.4{[M-H]-}。
6i: 黄色粉末状固体,收率46.7%, m.p.192~193 ℃;1H NMR(CDCl3, 600 MHz)δ: 14.63(s, 1H), 8.01(d,J=15.6 Hz, 1H), 7.99(s, 1H), 7.95(d,J=15.6 Hz, 1H), 7.90~7.81(m, 3H), 7.77~7.74(m, 1H), 7.54~7.49(m, 2H), 6.27(s, 1H), 5.97(s, 1H), 5.31(t,J=7.3 Hz, 1H), 3.93(s, 3H), 3.43(d, 2H), 1.84(s, 3H), 1.79(s, 3H);13C NMR(CDCl3, 151 MHz)δ: 192.8, 165.2, 162.1, 161.3, 142.2, 136.0, 134.2, 133.4, 133.2, 130.3, 128.6, 128.6, 128.0, 127.8, 127.1, 126.6, 123.8, 121.7, 106.3, 106.2, 91.2, 55.9, 25.9, 21.7, 17.9; MS(ESI)m/z: 388.4{[M-H]-}。
(3)7的合成
取化合物43.0 g(8.9 mmol)置于250 mL反应瓶,氩气保护下,加入甲醇(50 mL),搅拌溶解,加入29.6 mL稀盐酸(3 mol/L),65 ℃反应4 h(TLC检测)。减压回收甲醇,反应液用乙酸乙酯(3×100 mL)和水(3×50 mL)萃取,合并有机层,依次用水和饱和氯化钠溶液洗涤,无水MgSO4干燥,浓缩,残余物经硅胶柱层析(洗脱剂:乙酸乙酯/石油醚=1/13,V/V)纯化得白色粉末状固体1.1 g,收率50.0%。
(4)8的合成
取化合物71.1 g(4.4 mmol)和K2CO30.6 g(4.4 mmol)于50 mL反应瓶中,氩气保护,加入25 mL DMF,再缓慢滴加碘甲烷0.3 mL(4.4 mmol),室温反应10 h(TLC检测反应)。反应液用乙酸乙酯(3×60 mL)和水(3×40 mL)萃取,合并有机层,依次用饱和氯化钠洗涤,无水MgSO4干燥,浓缩,得粗品1.2 g,直接用于下一步反应。
(5)9a~9f的合成(以9a为例)
称取化合物893.5mg(0.35 mmol)和3-吡啶苯甲醛66.5 μL(0.71 mmol)置于10 mL反应瓶中,氩气保护下,加入4 mL乙醇,搅拌10 min,再加入NaOH 70.7 mg(1.77 mmol),室温反应18 h(TLC检测反应)。将反应液分散于乙酸乙酯和1 mol/L稀盐酸中,乙酸乙酯层依次用水和饱和氯化钠溶液洗涤,无水MgSO4干燥,浓缩,残余物经硅胶柱层析(洗脱剂:乙酸乙酯/石油醚=1/5,V/V)纯化得黄色固体9a52.7 mg, 收率42.2%, m.p.106~107 ℃;1H NMR(CDCl3, 600 MHz)δ: 13.90(s, 1H), 8.84(d,J=2.3 Hz, 1H), 8.58(dd,J=4.9 Hz, 1.6 Hz, 1H), 7.91(d,J=15.7 Hz, 1H), 7.87~7.84(m, 1H), 7.70(d,J=15.7 Hz, 1H), 7.33(dd,J=7.9 Hz, 4.8 Hz, 2H), 6.00(s, 1H), 5.19(t,J=7.1 Hz, 1H), 3.94(s, 3H), 3.91(s, 3H), 3.29(d,J=7.1 Hz, 2H), 1.77(s, 3H), 1.67(s, 3H);13C NMR(CDCl3, 151 MHz)δ: 192.3, 164.1, 163.7, 161.3, 150.5, 149.6, 137.7, 134.7, 131.5, 131.5, 129.9, 123.7, 122.5, 110.2, 106.3, 86.5, 55.8, 55.6, 25.8, 21.4, 17.8; MS(ESI)m/z: 353.4{[M-H]-}。
9b: 黄色固体,收率58.9%, m.p.98~99 ℃;1H NMR(CDCl3, 600 MHz)δ: 14.13(s, 1H), 7.76(d,J=15.4 Hz, 1H), 7.56(d,J=15.3 Hz, 1H), 7.50(d,J=1.7 Hz, 1H), 6.65(d,J=3.4 Hz, 1H), 6.49(dd,J=3.4 Hz, 1.8 Hz, 1H), 5.98(s, 1H), 5.21(t,J=7.1 Hz, 1H), 3.93(s, 3H), 3.89(s, 3H), 3.29(d,J=7.0 Hz, 2H), 1.78(s, 3H), 1.67(s, 3H);13C NMR(CDCl3, 151 MHz)δ: 192.4, 164.1, 163.3, 161.3, 152.3, 144.5, 131.4, 128.6, 125.4, 122.8, 115.2, 112.5, 110.0, 106.4, 86.4, 55.7, 55.5, 25.8, 21.4, 17.8; MS(ESI)m/z: 341.4{[M-H]-}。
9c: 黄色固体,收率59.0%, m.p.106~107 ℃;1H NMR(CDCl3, 600 MHz)δ: 14.11(s, 1H), 7.90(d,J=15.3 Hz, 1H), 7.71(d,J=15.3 Hz, 1H), 7.36(d,J=5.0 Hz, 1H), 7.28(d,J=3.2 Hz, 1H), 7.06(dd,J=5.1 Hz, 3.6 Hz, 1H), 5.97(s, 1H), 5.21(t,J=7.1 Hz, 1H), 3.93(s, 3H), 3.89(s, 3H), 3.30(d,J=7.0 Hz, 2H), 1.78(s, 3H), 1.68(s, 3H);13C NMR(CDCl3, 151 MHz)δ: 192.3, 164.1, 163.4, 161.3, 141.3, 134.6, 131.4, 131.1, 128.3, 128.1, 127.0, 122.8, 110.0, 106.3, 86.5, 55.7, 55.5, 25.8, 21.4, 17.8; MS(ESI)m/z: 358.4{[M-H]-}。
9d: 黄色固体,收率48.4%, m.p.117~119 ℃;1H NMR(CDCl3, 600 MHz)δ: 14.07(s, 1H), 7.77(d,J=15.5 Hz, 1H), 7.70(d,J=15.5 Hz, 1H), 7.54~7.53(m, 1H), 7.38~7.32(m, 2H), 5.99(s, 1H), 5.21(t,J=6.6 Hz, 1H), 3.93(s, 3H), 3.90(s, 3H), 3.30(d,J=7.1 Hz, 2H), 1.78(s, 3H), 1.67(s, 3H);13C NMR(CDCl3, 151 MHz)δ: 193.1, 164.0, 163.2, 161.2, 138.9, 135.5, 131.4, 128.1, 127.6, 126.7, 125.3, 122.7, 110.1, 106.4, 86.4, 55.7, 55.5, 25.8, 21.4, 17.7; MS(ESI)m/z: 357.4{[M-H]-}。
9e: 黄色固体,收率67.5%, m.p.145~146 ℃;1H NMR(CDCl3, 600 MHz)δ: 14.04(s, 1H), 7.73(d,J=15.5 Hz, 1H), 7.68(d,J=15.5 Hz, 1H), 7.36(d,J=12.2 Hz, 1.6 Hz, 1H), 7.31~7.26(m, 1H), 6.96(t,J=8.5, 1.0 Hz, 1H), 6.00(s, 1H), 5.20(t,J=7.1 Hz, 1H), 3.95(s, 3H), 3.93(s, 3H), 3.90(s, 3H), 3.29(d,J=7.0 Hz, 2H), 1.78(s, 3H), 1.67(s, 3H);13C NMR(CDCl3, 151 MHz)δ: 192.7, 164.1, 163.4, 161.3, 152.4(d,J=246.6 Hz), 149.3(d,J=11.0 Hz), 140.7(d,J=3.0 Hz), 131.4, 129.0(d,J=6.4 Hz), 126.9, 126.0(d,J=3.0 Hz), 122.7, 114.4(d,J=18.5 Hz), 113.2(d,J=2.1 Hz), 110.1, 106.5, 86.5, 56.3, 55.9, 55.5, 25.8, 21.4, 17.8; MS(ESI)m/z: 399.4{[M-H]-}。
9f: 黄色固体,收率52.3%, m.p.118~120 ℃;1H NMR(CDCl3, 600 MHz)δ: 14.10(s, 1H), 8.00~7.96(m, 2H), 7.93(d,J=15.6 Hz, 1H), 7.87(dd,J=6.0 Hz, 3.6 Hz, 1H), 7.85~7.81(m, 2H), 7.75(d,J=6.9 Hz, 1H), 7.53~7.49(m, 2H), 6.01(s, 1H), 5.23(t,J=7.0 Hz, 1H), 3.97(s, 3H), 3.91(s, 3H), 3.32(d,J=7.0 Hz, 2H), 1.80(s, 3H), 1.69(s, 3H);13C NMR(CDCl3, 151 MHz)δ: 192.9, 164.1, 163.3, 161.3, 141.9, 134.1, 133.4, 133.1, 131.4, 130.2, 128.5, 128.5, 128.1, 127.7, 127.0, 126.6, 123.7, 122.7, 110.1, 106.5, 86.5, 55.8, 55.5, 25.8, 21.4, 17.8; MS(ESI)m/z: 401.4{[M-H]-}。
1.3 抗肿瘤活性
选阿霉素作为阳性对照[19],采用MTT[22]法测试化合物对乳腺癌细胞(MDA-231)、前列腺癌细胞(LNCAP)、人肺癌细胞(A549)、肾癌细胞(A498)和宫颈癌细胞(Hela)的体外抑制活性。
2 结果与讨论
2.1 合成
以中间体4通过羟醛缩合合成5的过程中,使用NaOH和EtOH的方法发现收率低或者反应失败,可能原因是中间体4的溶解性较差,采用40% NaOH水溶液,1,4-二氧六环和EtOH的条件,溶解性好,收率较高(70.0%~90.0%)。
2.2 抗肿瘤活性
目标化合物6a~6i和9a~9f对乳腺癌细胞(MDA-231)、前列腺癌细胞(LNCAP)、人肺癌细胞(A549)、肾癌细胞(A498)和宫颈癌细胞(Hela)的抗肿瘤抑制活性见表1。
由表1可知:合成的所有化合物对Hela和A549细胞都具有一定的抑制活性,化合物6a、6b、6h、6i和9f对5种细胞株也均有一定的抑制活性。当R为苯环邻对位和对位取代基或芳杂环糠醛基和噻吩基时,抑制活性均明显低于3-吡啶基和2-萘基,且苯环上有吸电子或供电子时,活性均不理想。其中化合物6h、6i和9a在5 μmol/L浓度下对A498细胞的抑制率分别为

表1 6a~6i和9a~9f的体外抗肿瘤活性

图1 6h、 6i和9a对LO2正常细胞的毒副作用
59.12%、 49.82%和50.95%,化合物6h和6i在5 μmol/L浓度下对Hela的抑制率分别为59.19%和41.87%,化合物6h和6i对A549的抑制率分别为62.65%和54.82%。
对抗肿瘤活性较好的化合物6h、6i和9a进行了其对LO2正常细胞毒性测验,从图1结果可得:6h、6i和9a在24、 48和72 h 这3个时间段对正常细胞的毒副作用均比阳性对照组阿霉素低,且6i在24 h对正常细胞呈促进作用,48 h显示出细胞毒性,72 h后毒性降低。
合成了15个异戊烯基查尔酮类衍生物,经MTT法测试了其抗肿瘤抑制活性,结果显示:所有化合物对Hela和A549细胞都有一定的抑制活性。化合物6a、6b、6h、6i和9f对5种细胞株也均有一定的抑制活性,其中化合物6h、6i和9a在5 μmol/L浓度下对A498细胞的抑制率分别为59.12%、 49.82%、 50.95%,化合物6h和6i在5 μmol/L浓度下对Hela的抑制率分别为59.19%和41.87%,化合物6h和6i在5 μmol/L浓度下对A549的抑制率分别为62.65%和54.82%。
