利拉鲁肽对2型糖尿病肾病患者肠道菌群的影响
2020-11-30胡家霍丽霞王菲菲张玲倪林
胡家 霍丽霞 王菲菲 张玲 倪林
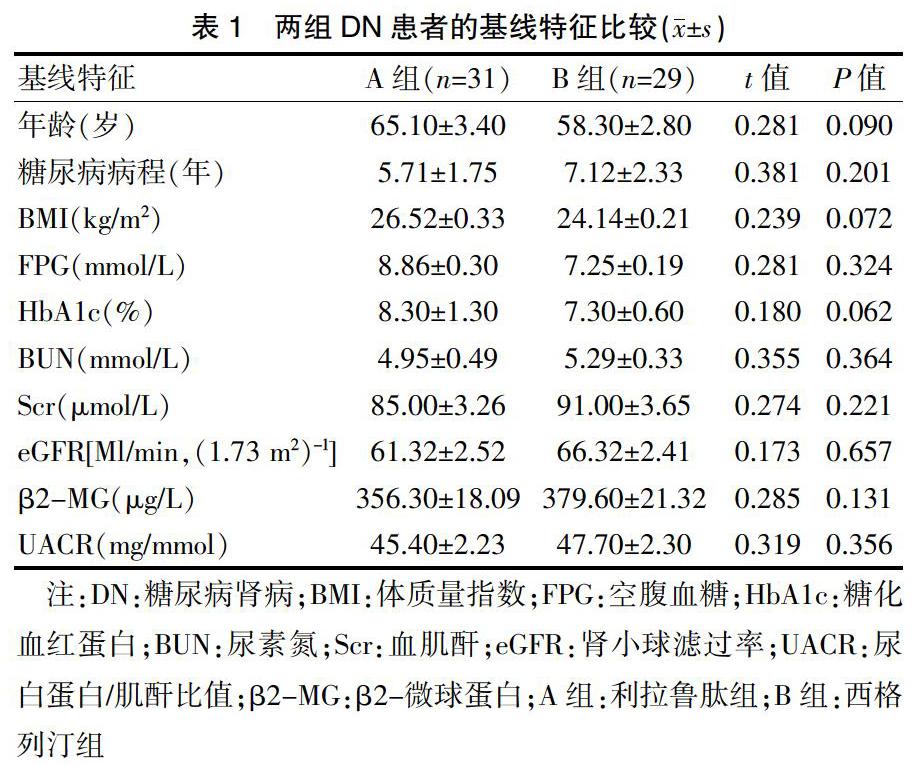
[摘要] 目的 觀察利拉鲁肽对2型糖尿病肾病(DN)患者肠道菌群的影响。 方法 选取2017年3月~2019年6月在本院就诊的DN患者60例为研究对象,随机分为两组,A组使用西格列汀片口服,B组使用利拉鲁肽针皮下注射。治疗前检测血清空腹血糖(FPG)、糖化血红蛋白(HbA1c)、尿白蛋白/肌酐比值(UACR)、β2-微球蛋白(β2-MG)等。治疗后检测粪便肠道菌群双歧杆菌、普雷沃菌、乳杆菌和肠杆菌的数量。采用Pearson相关性分析分析DN肠道菌群与微量白蛋白尿指标的相关性。 结果 (1)治疗前两组患者FPG、HbA1c、UACR,β2-MG比较,差异无统计学意义(P>0.05)。(2)治疗6个月后,B组双歧杆菌和普雷沃菌的菌落数显著高于A组,A组肠杆菌菌落数高于B组,差异有统计学意义(P<0.05)。(3)B组的β2-微球蛋白和尿白蛋白肌酐比值较A组均明显下降,差异有统计学意义(P<0.05)。(4)双歧杆菌与β2-MG、UACR呈负相关(r=-0.437.-0.612)。普雷沃菌与β2-MG、UACR呈负相关(r=-0.488.-0.435)。而肠杆菌与β2-MG、UACR呈正相关(r=0.650.0.679),以上数值差异均有统计学意义(P<0.05)。 结论 利拉鲁肽通过增加糖尿病肾病患者肠道菌群益生菌的数量,改善微量白蛋白尿,最终起到额外保护肾脏的作用。
[关键词] 糖尿病肾病;2型糖尿病;肠道菌群;微量白蛋白尿
[中图分类号] R581.2;R692 [文献标识码] B [文章编号] 1673-9701(2020)27-0049-05
[Abstract] Objective To observe the effect of liraglutide on intestinal microflora in the patients with type 2 diabetic nephropathy(DN). Methods A total of 60 patients with DN who were treated in our hospital from March 2017 to June 2019 were selected as the study subjects. The patients were randomly divided into two groups. Group A was given sitagliptin tablets for oral administration, and group B was given liraglutide subcutaneous injection. Before treatment, serum fasting blood glucose (FPG), glycated hemoglobin (HbA1C), urine albumin/creatinine ratio (UACR), β2-microglobulin (β2-MG) and other indicators were measured. After treatment, the number of fecal intestinal microflora such as Bifidobacterium, Prevotella, Lactobacillus and Enterobacteriaceae was detected. Pearson correlation analysis was used to analyze the correlation between DN intestinal microflora and microalbuminuria index. Results (1) Before treatment, FPG, HbA1C, UACR, β2-MG and other indicators were compared between the two groups, and the difference was not statistically significant (P>0.05). (2) After 6 months of treatment, the number of colonies of Bifidobacterium and Prevotella in group B were significantly higher than that in group A, and the number of enterobacteriaceae in group A was higher than that in group B, the differences were statistically significant(P<0.05). (3)The ratio of β2-microglobulin and urinary albumin creatinine in group B was significantly lower than that in group A, and the difference was statistically significant(P<0.05). (4)Bifidobacterium was negatively correlated with β2-MG and UACR(r=-0.437, -0.612). Prevotella was negatively correlated with β2-MG and UACR(r=-0.488, -0.435). Enterobacteriaceae was positively correlated with β2-MG and UACR(r=0.650, 0.679). The differences of all the above values were statistically significant(P<0.05). Conclusion Liraglutide can improve the microalbuminuria by increasing the number of probiotics in the intestinal microflora of patients with diabetic nephropathy, and finally play an additional role in protecting the kidneys.
[Key words] Diabetic nephropathy; Type 2 diabetes; Intestinal microflora; Microalbuminuria
生活方式的变化和人口老龄化加速糖尿病的蔓延。据统计全球糖尿病患病率为8.8%,我国成人糖尿病患病率已高达10.9%[1]。糖尿病的主要危害来自并发症,给社会带来巨大的经济负担。而糖尿病肾病(Diabetic nephropathy,DN)是严重糖尿病微血管并发症之一,以尿蛋白的升高和肾小球滤过率下降为主要特点。在我国糖尿病患者中有20%~40%进展为糖尿病肾病,这将是终末期肾病的主要原因[2-3]。
胰高血糖素样肽1受体激动剂(Glucagon like peptide-1,GLP-1)临床上广泛用于治疗2型糖尿病,使胃肠道成为治疗糖尿病的潜在靶点[4-5]。而胃肠道菌群失调与2型糖尿病肾病的严重程度加重有关[6-7],但是目前胰高血糖素样肽1受体激动剂与肠道菌群之间的相互作用尚处于研究阶段。
全球多中心临床试验LIRA-RENAL研究结果表明,利拉鲁肽除了有效控制血糖,还能减少持续性大量白蛋白尿,从而延缓肾功能衰竭的发生[8],但利拉鲁肽改善糖尿病肾病的具体作用机制目前尚不明确。本课题组从2017~2019年观察分析皮下注射利拉鲁肽对糖尿病肾病患者的肠道菌群和微量白蛋白尿的变化,并分析肠道菌群和微量白蛋白尿,旨在为利拉鲁肽是否通过调节肠道菌群改善微量白蛋白尿,为深入探讨糖尿病肾病的发病机制提供理论依据。现报道如下。
1 资料与方法
1.1 一般资料
选取2017年3月~2019年6月在湖州市第一人民医院内分泌科就诊的2型糖尿病合并肾并发症患者作为研究对象,其中男35例,女25例。2型糖尿病诊断均符合1999年世界卫生组织(WHO)诊断标准。
纳入标准:符合1999年WHO的2型糖尿病(Type 2 Diabetes,T2DM)的临床诊断[9];微量白蛋白尿:尿白蛋白/肌酐比值(UACR)30~300 mg/g; 肾小球滤过率eGFR≥60[mL/min,(1.73 m2)-1][1];进入研究前6个月内均未使用过抗生素、乳果糖、微生物活菌制剂等,患者均使用口服降糖药物,未使用胰岛素治疗。
排除标准:胃肠道疾病;重度肝肾功能不全;急性感染;甲状腺疾病;胰腺疾病;1 型糖尿病;继发性糖尿病;恶性肿瘤;自身免疫性疾病[7]。
分组方法:将符合纳入标准的患者,根据随机数字表随机分为两组。A组31例给予西格列汀控制血糖(100 mg/d,每天1次,口服,默沙东中国制药有限公司),B组29例予利拉鲁肽针(1.2 mg/d,每天1次,皮下注射,诺和诺德中国制药有限公司)。
本研究经湖州市第一人民医院医学伦理委员会批准,所有受试者均签署知情同意书。
两组DN患者基线资料的比较:A组和B組两组患者的年龄、体质量指数(BMI)、FPG、HbA1C、TG、TC、尿白蛋白/肌酐比值(UACR),β2-微球蛋白(β2-MG)、eGFR等一般资料比较,差异无统计学意义(P>0.05)。见表1。
1.2 方法
将签署知情同意书并且符合纳入标准的患者,根据随机数字表随机分为两组。A组31例予西格列汀片(100 mg/片,默沙东中国制药有限公司)口服,剂量为每天1次,1次1片,疗程为6个月。B组29例予利拉鲁肽针(18 mg/支,诺和诺德中国制药有限公司)皮下注射,剂量为每天1次,每次1.2 mg,疗程为6个月。
1.3 观察指标
血清学指标检测:治疗前后分别取两组患者清晨空腹静脉血,检测2型糖尿病肾病相关指标。测定空腹血糖(FPG)、糖化血红蛋白(HbA1c)、血清肌酐(Scr)、尿素氮(BNU)、肾小球滤过率(eGFR)等。血清学指标采用日立全生化分析仪测定。
微量白蛋白尿指标检测:留取晨间尿检测微量白蛋白尿指标:UACR,β2-微球蛋白(β2-MG)。
肠道菌群指标检测:治疗前后分别留取粪便标本,用无菌匙采集粪便标本,放入装有8 mL粪便DNA稳定剂的预标记管中混合。立即在-80℃保存直到提取DNA,使用粪便基因组提取试剂盒。通过16S rRNA基因测序分析粪便样品普雷沃氏菌、乳杆菌、双歧杆菌和肠杆菌的菌落数量。通过对16SrRNA V3-V4 区进行扩增。通用引物序列为338F5'-ACTCCTACGG-GAGGCAGCA-3'和806R 5'-GGACTACHVGGGT-WTCTAAT-3'[7]。PCR 反应条件为:95℃预变性2 min;95℃变性30 s;55℃退火30 s;72℃延伸45 s;25 个循环;72℃后保温10 min,于4℃保存。反应结束后用2%琼脂糖凝胶电泳检测PCR 产物。用Bio-rad IQ5 System 软件进行分析,测得粪便样品中普雷沃氏菌、乳杆菌、双歧杆菌和肠杆菌的菌落数量。
1.4 统计学方法
采用SPSS17.0统计学软件进行统计学分析,计量资料以均数±标准差(x±s)表示,组间比较采用独立样本t检验。肠道菌群与微量蛋白尿指标的相关关系采用Pearson 相关性分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 治疗后两组患者糖尿病肾病指标比较
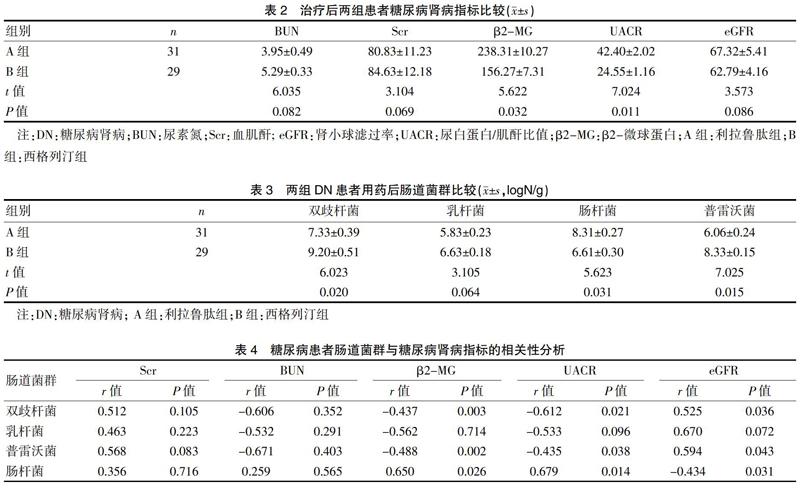
治疗6个后,西格列汀组与利拉鲁肽组相比,两组血尿素氮、血肌酐和肾小球滤过率数值比较,差异无统计学意义(P>0.05)。利拉鲁肽组的β2-微球蛋白[(156.27±7.31) μg/L vs (238.31±10.27) μg/L]和尿白蛋白肌酐比值[(24.55±1.16) mg/mmol vs (42.40±2.02) mg/mmol]较西格列汀组明显下降,差异有统计学意义(P<0.05)。见表2。
2.2 治疗后两组患者肠道菌群数量的比较
利拉鲁肽组(B组)双歧杆菌[(9.20±0.51) logN/g vs (7.33±0.39)logN/g]和普雷沃菌[(8.33±0.15)logN/g vs (6.06±0.24) logN/g]的菌落数显著高于西格列汀组,尽管利拉鲁肽组乳杆菌水平高于西格列汀组[(6.63±0.18) logN/g vs (5.83±0.23) logN/g],但两者比较,差异无统计学意义(P>0.05)。值得注意的是,西格列汀组肠杆菌落数高于利拉鲁肽组[(8.31±0.27) logN/g vs (6.61±0.30) logN/g]。见表3。
2.3 治疗后糖尿病患者肠道菌群与糖尿病肾病指标的相关性分析
本研究分析四种肠道菌群数量与糖尿病肾病各个指标的相关性,结果显示,双歧杆菌与β2-MG、UACR呈负相关(r=-0.437.-0.612),双歧杆菌、普雷沃菌与eGFR呈正相关(r=0.525.0.594)。普雷沃菌与β2-MG、UACR呈负相关(r=-0.488.-0.435)。而肠杆菌与eGFR呈负相关(r=-0.434),肠杆菌与β2-MG、UACR呈正相关(r=0.650,0.679),以上数值差异有统计学意义(P<0.05)。见表4。
3 讨论
近年来研究证实GLP-1受体激动剂如利拉鲁肽,具有降低血糖,减轻体重,改善B细胞功能及低血糖安全性等临床优势,且可以显著降低T2DM患者的心血管事件和慢性肾病的发生风险。
既往糖尿病肾病研究结果显示,GLP-1受体激动剂可以抑制晚期糖基化终末期产物来保护肾小管上皮细胞及肾功能。近期研究发现GLP-1受体激动剂可以显著降低尿白蛋白和改善肾脏病理改变,GLP-1的肾保护作用可能通过GLP-1受体-AMPK-mTOR-自噬-ROS通路来发挥作用,但是GLP-1受体激动剂利拉鲁肽是否通过改善糖尿病肾病患者的肠道菌群,从而发挥肾保护作用的研究甚少。
人体肠道益生菌有助于维持机体糖脂代谢平衡,从而维护人体健康。其机制在于肠道菌群通过代谢产物、菌体蛋白及其活力影响人体的自身免疫、内分泌代谢、肿瘤等多个方面,与疾病发生密切相关[10]。但是饮食结构改变、糖脂代谢失衡、抗生素的应用及肠道功能紊乱等诸多因素,均会影响肠道菌群的分布数量、代谢活动的变化,导致肠道菌群失衡从而引起相关疾病发生[11-12]。
糖尿病肾病的相关研究表明肠道微生物的种类和数量均发生不同程度的改变,双歧杆菌、嗜酸乳杆菌等益生菌的相对丰度降低,粪肠球菌等致病菌数量增加,炎症指标也相应增加,证实糖尿病肾病患者肠道菌群比例失调[13-14]。益生菌的减少和致病菌的增加导致体内炎症状态恶化,最终加重了2型糖尿病肾病的发生发展[15-16]。
特定饮食和药物干预能够改变肠道菌群的结构,并达到治疗的效果。研究表明,高脂飲食可显著降低小鼠肠道菌群的多样性,进食高纤维类食物可以增加肠道菌群的多样性[17-18]。二甲双胍处理高脂饮食小鼠,可有效增加肠道中黏蛋白降解细菌阿尔曼菌、普雷沃菌相对丰度,改善糖耐量异常[19-21]。LEADER临床试验数据表明利拉鲁肽可以保护2型糖尿病患者的糖尿病肾病。与安慰剂相比,利拉鲁肽可以减少持续性大量白蛋白尿的新发生率(HR 0.74,95%CI:0.60~0.91,P=0.004)[8]。
本研究应用16S rRNA基因测序技术分析,早期糖尿病肾病患者分别使用利拉鲁肽和西格列汀降糖治疗后,两组微量白蛋白尿指标和肠道菌群的相关性。结果显示利拉鲁肽组β2-微球蛋白和尿白蛋白肌酐比值数值,较西格列汀组明显下降(P<0.05)。利拉鲁肽组双歧杆菌和普雷沃菌的数量较西格列汀组升高,原因在于GLP-1类药物能够改善胰岛素抵抗,临床上T2DM患者存在不同程度的胰岛素抵抗。尽管利拉鲁肽组乳杆菌水平高于西格列汀组,但两者相比无统计学差异。
综上所述,2型糖尿病DN患者常伴随肠道菌群失调,而肠道菌群紊乱又可以加重患者微量白蛋白尿的出现。本研究通过观察DN患者使用GLP-1受体激动剂利拉鲁肽和DPPⅣ抑制剂西格列汀半年,从而分析DN患者肠道菌群与微量白蛋白尿的相关性,希望能够通过调控糖尿病肾病患者的肠道菌群,以微生物学方法改善DN患者血糖和减少微量白蛋白尿,延缓糖尿病肾病的发生发展,为深入探讨糖尿病肾病的发病机制提供理论依据。
[参考文献]
[1] 中华医学会糖尿病学分会.中国2型糖尿病防治指南(2017年版)[J].中华糖尿病杂志,2018,10(1):4-67.
[2] Wang Z,Saha S,Van Horn S,et al. Gut microbiome differences between metformin-and liraglutide-treated T2DM subjects[J]. Endocrinology,Diabetes & Metabolism,2018, 1(1):e00009.
[3] Moustafa PE,Abdelkader NF,El Awdan SA,et al. Liraglutide ameliorated peripheral neuropathy in diabetic rats:Involvement of oxidative stress,inflammation and extracellular matrix remodeling[J]. Journal of Neurochemistry,2018,146(2):173-185.
[4] 禤立平,徐敏,刘瑞欣,等.肠道菌群与2型糖尿病研究现状及进展,2016,32(12): 1041-1042.
[5] 王勤,楊亦彬. 肠道菌群失调对糖尿病及糖尿病肾病影响的研究进展[J]. 医学综述,2019,3:530-534.
[6] Grasset E,Burcelin R. The gut microbiota to the brain axis in the metabolic control[J]. Reviews in Endocrine & Metabolic Disorders,2019,20(4):427-430.
[7] 李雷,杨云梅,吴月,老年2型糖尿病患者肠道菌群多样性及其炎症因子与胰岛素抵抗的相关性研究[J]. 中华危重症医学杂志(电子版),2018,5:316-321.
[8] Davies MJ,Bain SC,Atkin SL,et al,Efficacy and Safety of Liraglutide Versus Placebo as Add-on to Glucose-Lowering Therapy in Patients With Type 2 Diabetes and Moderate Renal Impairment(LIRA-RENAL):A Randomized Clinical Trial[J]. Diabetes Care,2016,39(2):222-230.
[9] Alberti KG,Zimmer PZ,Dedinition,et al,diagnosis and classification of diabetes mellitus and its complications,Part1:Diagnosis and classification of diabetes mellitus provisional report pf a WHO consultation[J]. Diabet Med,1998,15(7):539-553.
[10] Farmer AD,Pedersen AG,Brock B,et al,Type 1 diabetic patients with peripheral neuropathy have pan-enteric prolongation of gastrointestinal transit times and an altered caecal pH profile[J]. Diabetologia,2017,60(4):709-718.
[11] Nyavor Y,Estill R,Edwards H,et al,Intestinal nerve cell injury occurs prior to insulin resistance in female mice ingesting a high-fat diet[J]. Cell and Tissue Research, 2019,376(3):325-340.
[12] Pang B,Zhao LH,Zhou Q,et al.Application of berberine on treating type 2 diabetes mellitus[J]. International Journal of Endocrinology,2015,2015:905749.
[13] Wang L,Li P,Tang Z,et al.Structural modulation of the gut microbiota and the relationship with body weight: compared evaluation of liraglutide and saxagliptin treatment[J]. Scientific Reports,2016,6:33251.
[14] Yarandi SS,Srinivasan S. Diabetic gastrointestinal motility disorders and the role of enteric nervous system:current status and future directions,neurogastroenterology and motility[J]. The official Journal of the European Gastrointestinal Motility Society,2014,26(5):611-624.
[15] Hocher B,Tsuprykov O. Diabetic nephropathy:Renoprotective effects of GLP1R agonists and SGLT2 inhibitors[J].Nature Reviews Nephrology,2017,13(12):728-730.
[16] Zobel EH,Von Scholten BJ,Goldman B,et al,pleiotropic effects of liraglutide in patients with type 2 diabetes and moderate renal impairment:Individual effects of treatment[J].Diabetes,Obesity & Metabolism,2019,21(5):1261-1265.
[17] Tsai SF,Chen CH.Management of diabetes mellitus in normal renal function,renal dysfunction and renal transplant recipients,focusing on glucagon-like peptide-1 agonist:A review based upon current evidence[J].International Journal of Molecular Sciences,2019,20(13):3152.
[18] 王志斌,信珊珊,丁丽娜,等.降糖药物对肠道菌群结构组成的影响[J]. 现代预防医学,2018,12:2145-2148.
[19] Postler TS,Ghosh S. Understanding the holobiont:How microbial metabolites affect human health and shape the immune system[J]. Cell Metabolism,2017,26(1):110-130.
[20] Moreira GV,Azevedo FF,Ribeiro LM,et al,Liraglutide modulates gut microbiota and reduces NAFLD in obese mice[J]. The Journal of Nutritional Biochemistry,2018,62:143-154.
[21] Meijers B,Jouret F,Evenepoel P. Linking gut microbiota to cardiovascular disease and hypertension: Lessons from chronic kidney disease[J]. Pharmacological Research,2018, 133:101-107.
(收稿日期:2020-02-01)
