肥胖对男性不育症患者精液质量与精子DNA完整性的影响
2020-11-30吴骏贾占东冯奕郑武崔云
吴骏 贾占东 冯奕 郑武 崔云

[摘要] 目的 探討肥胖对男性不育症患者精液质量与精子DNA完整性的影响。 方法 选择2018年2月~2019年6月就诊于本院男科门诊的男性不育症患者93例;根据患者BMI值分组,18.5 kg/m2≤BMI<24 kg/m2为正常体质组(n=50),年龄(32.60±3.95)岁,BMI(21.18±1.44)kg/m2;BMI≥28 kg/m2为肥胖体质组(n=43),年龄(32.23±5.03)岁,BMI(29.60±1.27)kg/m2。比较两组患者精子浓度、精液量、精液pH值、PR值、NP值、正常精子百分率及DFI值。结果 肥胖体质组与正常体质组精液量比较,采用独立样本t检验,差异无统计学意义(P=0.065,P>0.05);精子浓度降低[(40.50±23.80)×106/mL,(53.27±35.47)×106/mL],差异有统计学意义(P=0.048,P<0.05);PR降低[(20.62±7.86)%,(24.76±9.04)%],差异有统计学意义(P=0.021,<0.05);正常精子百分率比较差异无统计学意义(P=0.080,P>0.05);DFI值升高[(19.21±6.68)%,(16.20±5.73)%],差异有统计学意义(P=0.022,P<0.05)。经Mann-Whitney U检验,精液pH值降低[7.3(7.3,7.5),7.3(7.2,7.4)],差异有统计学意义(P=0.006,P<0.01);NP值比较,差异无统计学意义(P=0.416,P>0.05)。经Pearson相关性分析,患者的BMI值与精液量、精子浓度呈负相关(P<0.05),与DFI值呈正相关(P<0.05);精液量与PR呈正相关(P<0.05);精子浓度值与PR呈显著负相关(P<0.01);PR与正常精子百分率呈正相关(P<0.05)。 结论 肥胖可降低男性精液质量,加重精子DNA损伤,是男性生育能力受损的危险因素。
[关键词] 肥胖;男性不育症;精液质量;精子DNA完整性
[中图分类号] R446.1 [文献标识码] A [文章编号] 1673-9701(2020)27-0025-04
[Abstract] Objective To explore the effect of obesity on semen quality and sperm DNA integrity of male patients with infertility. Methods A total of 93 male patients with infertility treated in the outpatient service of the andrology department of our hospital from February 2018 to June 2019 were selected. According to their BMI value, these patients were divided into two groups. In the normal constitution group(n=50), 18.5 kg/m2≤BMI<24 kg/m2, (32.60±3.95) years old, and the BMI was(21.18±1.44) kg/m2; in the obesity constitution group(n=43), BMI≥28 kg/m2, (32.23±5.03) years old, and the BMI was(29.60±1.27) kg/m2. The sperm concentration, semen volume, semen pH value, PR value and NP value, percentage of normal sperm and DFI value of the two groups of patients were observed and compared. Results According to independent samples t-test, there was no statistical difference in semen volume between the obesity constitution group and the normal constitution group(P=0.065, >0.05). Compared with that of the normal constitution group, the sperm concentration of the obesity constitution group was lower([40.50±23.80]×106/mL, [53.27±35.47]×106/mL), and the differences were statistically significant(P=0.048, P<0.05); the PR value was smaller([20.62±7.86]%, [24.76±9.04]%), and the differences were statistically significant(P=0.021, P<0.05); there was no statistical difference in the percentage of normal sperm(P=0.080, P>0.05); the DFI value was greater([19.21±6.68]%, [16.20±5.73]%), and the differences were statistically significant(P=0.022, P<0.05). According to Mann-Whitney U test, the semen pH value of the obesity constitution group was smaller(7.3[7.3, 7.5], 7.3[7.2, 7.4]), with significant statistical differences(P=0.006, P<0.01); there was no statistical difference in NP value(P=0.416, P>0.05). According to Pearson correlation analysis, the patients' BMI value was negatively correlated with semen volume and sperm concentration(P<0.05) and positively correlated with DFI value(P<0.05); semen volume was positively correlated with PR(P<0.05); the value of sperm concentration was significantly negatively correlated with PR(P<0.01); PR was positively correlated with the percentage of normal sperm(P<0.05). Conclusion Obesity may lower the quality of men's semen and aggravate the damage to sperm DNA. It is a risk factor for impaired male fertility.
[Key words] Obesity; Male infertility; Semen quality; Sperm DNA integrity
隨着我国物质生活水平的提高,肥胖患者人数逐年增多。《中国居民营养与慢性病状况报告(2015)》显示,全国18岁及以上成人超重率为30.1%,肥胖率为11.9%,并有逐年增多的趋势[1]。肥胖不但与代谢综合征、糖尿病、心血管疾病等相关,还可直接或间接地对男性生育能力产生影响。随着二胎政策放开,我国育龄男性生育需求剧增。在生育能力的评估上,精子DNA的完整性对妊娠的结局具有指导意义;因为精子的DNA不但与精子的活力、形态功能密切相关,而且全程参与受精卵的分裂及胚胎的发育[2]。因此,我们通过检测患者的精液常规、精子形态及DNA完整性,比较肥胖体质与正常体质患者之间的差异,探讨肥胖对男性生育能力的影响机制,为临床诊治提供思路与方法,现报道如下。
1 资料与方法
1.1 一般资料
所有病例均来自于2018年2月~2019年6月在本院男科门诊就诊男性不育症患者,共93例,其中正常体质组患者50例,平均年龄(32.60±3.95)岁,体质量指数(Body mass index,BMI)(21.18±1.44)kg/m2;肥胖体质患者43例,平均年龄(32.23±5.03)岁,BMI(29.60±1.27)kg/m2,两组的年龄、BMI比较,差异无统计学意义(P>0.05),具有可比性。
1.2 标准
1.2.1 诊断标准 (1)西医诊断标准:《男性不育症中西医结合诊疗指南》2015版[3]中规定,夫妇未采取任何避孕措施,正常规律性生活1年以上,由于男方因素造成女方不育者,称为男性不育。(2)肥胖诊断标准:根据中国超重/肥胖医学营养治疗专家共识(2016年版)[4]中规定,BMI为体重/身高2,BMI≥28 kg/m2为肥胖。
1.2.2 纳入标准 (1)符合男性不育症诊断标准;(2)符合肥胖诊断标准;(3)通过医院医学伦理委员会审核,不违背医学伦理要求,患者知情同意并自愿加入。
1.2.3 排除标准 (1)合并先天遗传性疾病或其他器官系统慢性疾病,如卡尔曼综合征、XXY综合征、高血压、糖尿病等;(2)曾有睾丸、精索外伤手术史;(3)合并泌尿系统感染、梗阻;(4)合并精神系统疾病;(5)睾丸萎缩、生殖道畸形;(6)接触理化性质危险因素,可损伤生育能力并处于作用期内;(7)3个月内接受过男性不育症治疗者。
1.2.4 剔除标准 依从性差不能配合按规定完成检查方案者。
1.3 观察指标
1.3.1 标本采集 采集精液前禁欲3~5 d,排空小便,洗净双手,手淫法采集全部精液于干燥消毒的标准容器内,置37℃多维混匀恒温箱,观察精液液化时间,待充分液化后行精液常规检查及DNA完整性检查。。
1.3.2 精液常规[WHO人类精液实验室检验手册(第5版)[5]] 精子浓度(≥15×106/mL)、精液量(≥1.5 mL)、精液pH值(≥7.2)、前向运动精子百分率(Progressive motility rate,PR)(≥32%)、非前向运动精子百分率(Non-progressive motility rate,NP)(≥8%)、正常精子百分率(≥4%)。
1.3.3 双尾彗星实验方法测定精子DNA碎片指数[6] (DNA fragmentation index,DFI) 正常≤23%。
1.4 统计学处理
以SPSS13.0统计学软件对收集的数据进行分析,以K-S检验检测资料的正态性,正态分布计量资料以(x±s)表示,非正态分布计量资料以中位数M(P25,P75)表示,两组间正态分布资料采用t检验,非正态分布资料采用Mann-Whitney U检验;计数资料采用χ2检验进行组间比较。P<0.05为差异有统计学意义,P<0.01为差异有高度统计学意义。
2 结果
2.1 两组患者精液参数及DFI值比较
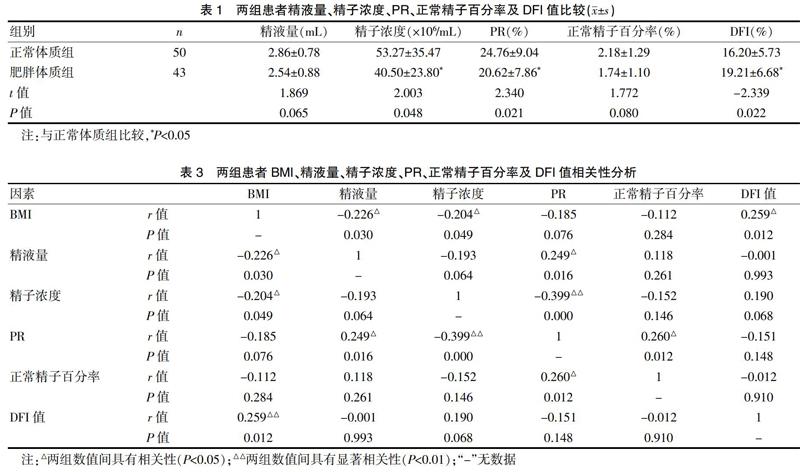
肥胖体质组与正常体质组精液量比较,经独立样本t检验,差异无统计学意义(P=0.065,P>0.05);精子浓度降低[(40.50±23.80)×106/mL,(53.27±35.47)×106/mL],差异有统计学意义(P=0.048,P<0.05);前向运动精子百分率降低[(20.62±7.86)%,(24.76±9.04)%],差异有统计学意义(P=0.021,P<0.05);正常精子百分率差异无统计学意义(P=0.080,P>0.05);精子DNA碎片指数升高[(19.21±6.68)%,(16.20±5.73)%],差异有统计学意义(P=0.022,P<0.05)。见表1。
2.2 两组患者精液pH值、NP比较
经Mann-Whitney U检验,精液pH值降低[7.3(7.3, 7.5),7.3(7.2,7.4)],差异有统计学意义(P=0.006,P<0.01);非前向运动精子百分率比较,差异无统计学意义(P=0.416,>0.05)。见表2。
2.3 两组相关性分析
经Pearson相关性分析,患者的BMI值与精液量、精子浓度呈负相关(P<0.05),与DFI值呈正相关(P<0.05);精液量与PR呈正相关(P<0.05);精子浓度值与PR呈显著负相关(P<0.01);PR与正常精子百分率呈正相关(P<0.05)。见表3。
3 讨论
肥胖是一种日益流行的疾病,也是生殖年龄男性的一个常见问题,肥胖对男性生殖的影响及其中的机制是目前男科学研究的热点。男性肥胖定义为体脂率超过25%,并且BMI超过28 kg/m2,BMI是肥胖的主要指标。BMI高的男性比正常体重的男性患不育症的风险高,通过对52 395名农民进行调查,其中有1329名患有与BMI相关的不育症,BMI均高于临界值3个单位[7]。肥胖症会引起性发育迟缓[8];肥胖青少年的性发育明显落后于同龄的正常体重青少年,其阴茎的自然长度和睾丸的平均容积均小于后者[9];肥胖人群中勃起功能障碍的患者是正常体重人群的1.3倍,过少的性生活次数也是不育的重要因素[10-11];肥胖患者常合并睡眠-呼吸暂停综合征(Sleep apnea syndrome,SAS),可影响夜间睾酮的正常分泌,睾酮水平随SAS的严重程度呈比例降低,最终影响精子的生成,表现为男性生殖功能低下[12];另外,高血脂对精子功能有不利影响,高胆固醇、高磷脂质常导致精子顶体及头端结构不完整[13];高血糖可使精子的氧化应激反应增加,进而损伤精子DNA完整性,最终引起生育力下降[14]。肥胖通过以上因素直接或间接地降低男性生育能力。
精液質量是男性生育能力的客观评价因素。本研究证实肥胖体质较正常体质不育患者,精液pH值降低,精子浓度降低,前向运动精子百分率降低;而非前向运动精子百分率、正常精子百分率两组之间比较,差异无统计学意义(P>0.05)。苟江等[15]就BMI对精子质量及性激素水平的影响进行Meta分析,发现对于超重人群,FSH、LH水平可能与BMI有一定关系,而对于肥胖人群,BMI的增高可能影响精子浓度、前向运动精子、总活力、LH水平,从而影响生育能力。多项研究[16-17]发现并认为随着BMI的升高,男性生殖激素及精浆中氧化应激状态的变化,表现为与精液质量的相关性,可能是肥胖男性不育的影响因素。而彭媛红等[18]通过探究高脂饮食诱导的肥胖引起C57BL/6小鼠精子线粒体损伤及活动力低下的作用机制,发现肥胖能够引起精子线粒体功能损伤,从而导致精子活动力及前向运动精子百分数低下,最终损伤雄性的生殖功能。
本研究还发现肥胖可加重不育症患者精子DNA损伤。精子DNA完整性是正常受精及父系遗传信息传递给子代的先决条件,轻度精子DNA的损伤并不影响卵子受精,而重度精子DNA损伤,超出了卵母细胞和胚胎的DNA修复能力时,就会影响受精后胚胎的发育,导致胚胎DNA碎片增多,阻滞卵裂球发育,降低囊胚形成率和着床率[19]。目前,许多基于人和动物的实验研究均表明,肥胖症与精子DNA损伤的增加密切相关。曾有研究者使用染色质结构试验测定染色质的完整性,发现超重和肥胖(BMI≥25 kg/m2)的男性与体重正常的男性比较,其精子损伤比例明显增高[20]。Dupont等[21]也发现男性肥胖症患者精子DNA损伤的发生率较正常男性增高,BMI值的增加与线粒体活性和前向运动精子数的降低及DNA断裂的增加有关。Chavarro等[22]通过检测483例不育门诊男性患者的精子DNA完整性与血清生殖激素水平来确定BMI与精液质量的相关性,发现BMI≥35 kg/m2的患者精子DNA损伤率明显升高,而在BMI<35 kg/m2的患者中DNA损伤率与体重不相关。
肥胖对DFI的影响主要与阴囊温度升高及睾丸氧化应激(Oxidative stress,OS)有关。阴囊温度升高不但会影响成熟的精子,导致小鼠的精子计数降低、睾丸重量减轻和精子受孕能力下降,还会影响精母细胞和早期精子,引起细胞凋亡和自噬,DNA损伤和活性氧(Reactive oxygen species,ROS)的生成等[23]。精液的ROS主要来源于精液巨噬细胞,精子在遭受氧化损伤的过程中,精子DNA缺乏体细胞DNA的修复机制,所以精子DNA损伤后的修复能力较差。肥胖患者常出现OS增加[24]。如果机体内ROS产生过多,超出精子有限的抗氧化防御水平,就会诱发精子DNA氧化应激损伤。精子质膜富含不饱和脂肪酸,当精子核DNA发生氧化应激时,其可与ROS清除酶反应,质膜的流动性和完整性受到破坏,最终导致精子核DNA损伤[25]。
综上所述,本研究证实肥胖体质较正常体质不育患者精液质量降低,精子DNA损伤程度增高。肥胖症对精子DNA的损伤是导致男性受精障碍和流产等较为严重后果的重要因素,其中涉及到多种机制,给临床的诊治带来一定的难度。减肥或其他药物能否提高男性生育能力,值得进行进一步的临床与实验研究及探索。
[参考文献]
[1] 顾景范.《中国居民营养与慢性病状况报告(2015)》解读[J].营养学报,2016,38(6):525-529.
[2] 熊承良,商学军,刘继红.人类精子学[M].北京:人民卫生出版社,2013:514-516.
[3] 张敏建,郭军,陈磊,等.男性不育症中西医结合诊疗指南(试行版)[J].中国中西医结合杂志,2015,(9):1034-1038.
[4] 中国超重/肥胖医学营养专家共识编写委员会.中国超重/肥胖医学营养治疗专家共识(2016年版)[J].糖尿病天地(临床),2016,10(9):395-398.
[5] World Health Organization.WHO laboratory manual for the examination and processing of human semen[M].2010:7-113.
[6] 陈建伟,张晓霞,崔云,等.双尾彗星实验检测精子DNA完整性的方法学建立[J].检验医学,2012,27(1):21-25.
[7] ?譒kurla M,Rybá R.Obesity and reduced fertility of men. Obezita a sní?觩ení plodnosti mu?觩u[J].Ceska Gynekol,2018, 83(3):212-217.
[8] Lee JM,Kaciroti N,Appugliese D,et al. Body mass index and timing of pubertal initiation in boys[J].Arch Pediatr Adolesc Med,2010,164(2):139-144.
[9] Shalitin S,Kiess W.Putative effects of obesity on linear growth and puberty?[J].Horm Res Paediatr,2017,88(1):101-110.
[10] Rowland DL,McNabney SM,Mann AR. Sexual function,obesity,and weight loss in men and women[J].Sex Med Rev,2017,5(3):323-338.
[11] Rastrelli G,Lotti F,Reisman Y,et al. Metabolically healthy and unhealthy obesity in erectile dysfunction and male infertility[J].Expert Rev Endocrinol Metab,2019,14(5):321-334.
[12] Hammoud AO,Carrell DT,Gibson M,et al. Updates on the relation of weight excess and reproductive function in men:Sleep apnea as a new area of interest[J]. Asian J Androl,2012,14(1):77-81.
[13] Schisterman EF,Mumford SL,Browne RW,et al. Lipid concentrations and couple fecundity:The LIFE study[J]. J Clin Endocrinol Metab,2014,99(8):2786-2794.
[14] Agbaje IM,McVicar CM,Schock BC,et al.Increased concentrations of the oxidative DNA adduct 7,8-dihydro-8-oxo-2-deoxyguanosine in the germ-line of men with type 1 diabetes[J]. Reprod Biomed Online,2008,16(3):401-409.
[15] 茍江,赵军,赵静,等.男性体质指数对精子质量及性激素水平影响的Meta分析[J].现代泌尿外科杂志,2019, 24(6):461-466.
[16] 韩瑞钰,马静,马婧,等.肥胖男性生殖激素、精浆氧化应激与精液质量的关系研究[J].中华男科学杂志,2018, 24(5):419-424.
[17] Amjad S,Baig M,Zahid N,et al. Association between leptin,obesity,hormonal interplay and male infertility[J].Andrologia,2019,51(1):e13147.
[18] 彭媛红,敬佳,胡燕琴,等.高脂饮食诱导的肥胖对小鼠精子线粒体及活动力损伤的机制研究[J].中国男科学杂志,2019,33(3):3-9.
[19] Sivanarayana T,Ravi Krishna C,Jaya Prakash G,et al. Sperm DNA fragmentation assay by sperm chromatin dispersion (SCD):Correlation between DNA fragmentation and outcome of intracytoplasmic sperm injection[J].Reprod Med Biol,2013,13(2):87-94.
[20] Bellastella G,Menafra D,Puliani G,et al. How much does obesity affect the male reproductive function? [J].Int J Obes Suppl,2019,9(1):50-64.
[21] Dupont C,Faure C,Sermondade N,et al. Obesity leads to higher risk of sperm DNA damage in infertile patients[J]. Asian J Androl,2013,15(5):622-625.
[22] Chavarro JE,Toth TL,Wright DL,et al. Body mass index in relation to semen quality,sperm DNA integrity,and serum reproductive hormone levels among men attending an infertility clinic[J]. Fertil Steril,2010,93(7):2222-31.
[23] Ilacqua A,Izzo G,Emerenziani GP,et al. Lifestyle and fertility:The influence of stress and quality of life on male fertility[J]. Reprod Biol Endocrinol,2018,16(1):115.
[24] Darbandi M,Darbandi S,Agarwal A,et al. Reactive oxygen species and male reproductive hormones[J].Reprod Biol Endocrinol,2018,16(1):87.
[25] Venkatesh S,Deecaraman M,Kumar R,et al. Role of reactive oxygen species in the pathogenesis of mitochondrial DNA (mtDNA) mutations in male infertility[J]. Indian J Med Res,2009,129(2):127-137.
(收稿日期:2020-04-13)
