人参皂苷Rg3调控lncRNA-LINP1抑制胃癌细胞生长的作用机制
2020-11-27徐惠亮郝双影
唐 立,徐惠亮,郝双影
0 引 言
胃癌是一种常见癌症,全球每年新发病例数超过10万,约有738 000多人死于胃癌[1]。目前,已有多种治疗策略可用于治疗胃癌患者,例如化学疗法、放射疗法或两者结合。尽管早期胃癌的治疗已有进展,但预后仍然很差,并且有很多患者死于胃癌复发[2-3]。
近年来,天然产物化合物由于其有显著的抗癌效果和较小的不良反应,越来越被研究者重视[4]。人参皂苷Rg3是一种从人参中提取出来的二醇类三萜皂苷,具有诱导细胞凋亡、增殖和迁移的能力[5-6]。其中Rg3表现出对肿瘤细胞增殖、转移的抑制,并且能诱导肿瘤细胞凋亡。非编码lncRNA-LINP1 ( lncRNA-LINP1) 是一种长度≥200 nt的RNA,在肿瘤细胞增殖与迁移过程中扮演重要角色[7]。研究发现lncRNA-LINP1参与胃癌细胞浸润、转移过程[8-9],但是关于其作用的具体机制鲜有报道。本研究旨在探究人参皂苷Rg3通过调控lncRNA-LINP1表达,从而抑制胃癌细胞生长的机制。
1 材料与方法
1.1 材料人胃癌细胞株SNU-1细胞购自中国典型培养物保藏中心(武汉大学保藏中心),人参皂苷Rg3购自乐嘉生物科技公司,胎牛血清和DMEM培养基购自广州生物硕恒科技有限公司,Annexin V FITC/PI细胞凋亡试剂盒购自南京卡米洛生物工程有限公司。
1.2细胞分组与处理在含10%胎牛血清的DMEM培养基中培养人胃癌细胞SNU-1,培养箱参数设为是37 ℃,5%CO2。根据人参皂苷Rg处理浓度[10]分为:对照组(0 μmol/L人参皂苷Rg3)、低剂量组(0.03 μmol/L人参皂苷Rg3)、中等剂量组(0.06 μmol/L人参皂苷Rg3)和高剂量组(0.09 μmol/L人参皂苷Rg3),DMSO终浓度<0.1%。
1.3采用MTT法检测细胞增殖各组SNU-1细胞种植在96 孔板中,种植密度设为6 ×103个细胞/孔。各组细胞分别处理24 h、48 h和72 h后,每孔中加入28 μL 0.5 mg/mL MTT溶液,然后继续培养6 h。培养完成后,震荡8 min,于450 nm波长处用酶标仪检测吸光度值,从而得到增殖抑制率,计算公式如下:
增殖抑制率=(1-实验组吸光度值/对照组吸光度值)×100%
1.4采用Annexin-FITC双染法检测细胞凋亡药物处理细胞48 h后,使用不含EDTA的胰蛋白酶进行消化,PBS清洗2次后,每组收集105个细胞轻轻吹打重悬,加入10 μL Annexin-FITC和10 μL PI,使用流式细胞仪测出各组细胞的凋亡率。细胞凋亡率计算公式如下:
细胞凋亡率=(UR象限细胞数+LR象限细胞数)/细胞总数×100%
1.5采用细胞划痕实验检测细胞迁移将各组细胞接种在6孔培养板中,浓度为 106个/孔,处理48 h,使用无菌枪头在培养皿中均匀划痕,然后使用PBS(1×)洗涤细胞4次,将各组细胞加入培养基后拍照记录,此时定义时间为0 h时各组细胞的迁移状况。继续放置在培养箱中,24 h后显微镜下观察并且拍照记录。
1.6采用RT-PCR检测lncRNA-LINP1表达水平分别将各组细胞处理24 h、48 h、72 h后,收集各组细胞,使用Trizol法提取总RNA。以β-actin作为内参,采用RT-PCR检测lncRNA-LINP1在各组细胞中表达水平。使用引物(5′- 3′):lncRNA-LINP1上游引物为:GTCTCCTAGACTCTGGGT,下游引物为:TAAAATGTTGAGAACGAC;β-actin上游引物:ACGAGACCIACCTTCAACTCCATC;下游引物:TAGAAGCATTTGCGGTGGACGA。上述实验重复6次。
2 结 果
2.1 人参皂苷Rg3抑制lncRNA-LINP1的表达低剂量组、中等剂量组和高剂量组lncRNA-LINP1的表达水平明显低于对照组(P<0.05),高剂量组lncRNA-LINP1的表达水平明显低于低剂量组和中等剂量组(P<0.05)。见图1。

与同时间点对照组比较,*P<0.05;与同时间点低剂量组比较,#P<0.05;与同时间点中等剂量组比较,△P<0.05
2.2人参皂苷Rg3抑制胃癌细胞增殖处理后24 h、48 h、72 h,高剂量组癌细胞增殖能力最弱,增殖抑制率高于低剂量组和中等剂量组(P<0.05),见表1。
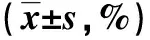
表 1 各组不同时间点的SNU-1细胞增殖抑制率
2.3人参皂苷Rg3促进胃癌细胞的凋亡低剂量组、中等剂量组、高剂量组细胞凋亡率[(4.56±0.92)%、(8.77±0.98)%、(15.06±2.42)%]明显高于对照组[(2.43±0.74)%],差异有统计学意义(P<0.05) ;且随着人参皂苷Rg3 浓度增加,细胞凋亡率上升(P<0.05)。见图2。
2.4人参皂苷Rg3抑制胃癌细胞迁移细胞划痕实验结果显示,不同浓度人参皂苷Rg3处理48h后,低剂量组、中等剂量组和高剂量组细胞的迁移距离均明显小于对照组,且随着人参皂苷Rg3浓度增加,细胞迁移距离缩短。见图3。

图 2 人参皂苷Rg3对胃癌细胞凋亡的影响

a:对照组; b:低剂量组; c:中等剂量组; d:高剂量组
3 讨 论
目前普遍认为细胞的恶性增殖是癌症发生的必要环节,近年来对胃癌的研究发现,lncRNA调控基因的表达量[11],进一步影响细胞分化[12]及凋亡[13]。从人参皂苷中分离出Rg3,近来研究表明人参皂苷Rg3可显著抑制肺癌细胞[14]、人骨髓瘤细胞[15]、结肠癌癌细胞生长[16],但尚无研究表明人参皂苷Rg3对胃癌的治疗作用。本研究利用MTT法检测不同浓度、不同时间人参皂苷Rg3对SNU-1细胞增殖的影响,发现人参皂苷Rg3能明显抑制SNU-1细胞增殖,且抑制作用随着浓度的升高而增加;进一步我们利用流式细胞技术检测人参皂苷Rg3对SNU-1细胞凋亡的影响,人参皂苷Rg3处理48 h后能显著诱导SNU-1细胞凋亡,且与作用浓度呈正相关;此外,细胞迁移实验表明,不同浓度人参皂苷Rg3处理48 h后,SUN-1细胞迁移的距离明显缩短,对照组最长,高剂量组最短;同时,本研究检测了人参皂苷Rg3对胃癌细胞系lncRNA-LINP1表达的影响,阐述了人参皂苷Rg3对lncRNA-LINP1表达的抑制作用,这种抑制作用与药物浓度呈正比。这些结果表明,人参皂苷Rg3可显著促进胃癌细胞凋亡,抑制胃癌细胞增殖迁移,这种作用可能与lncRNA-LINP1相关,这将为利用人参皂苷Rg3 治疗胃癌提供可靠参考。
lncRNA-LINP1存在于细胞核中,它主要参与染色体修饰、转录沉默、转录激活等重要生理功能。研究发现,lncRNA-LINP1在骨肉瘤组织中表达升高,如果对lncRNA-LINP1进行抑制,癌细胞的增殖和侵袭能力会明显下降。此外,在胰腺癌中,过表达的lncRNA-LINP1使得癌细胞的迁移和侵袭能力显著升高[6,17]。近期研究表明,lncRNA-LINP1在肝癌组织中的表达上调,并且lncRNA-LINP1的表达水平与肝癌患者不良预后密切相关,但目前关于其在胃癌中参与的分子机制、药物敏感性却鲜有探究[17]。本研究显示,处理后24 h、48 h、72 h对照组中lncRNA-LINP1的表达水平、细胞增殖指数都高于人参皂苷Rg3处理组,而高剂量组是各组中胃癌细胞受抑制最明显的实验组,说明人参皂苷Rg3能抑制胃癌细胞增殖,而且抑制能力与使用人参皂苷Rg3的剂量显著相关。
综上所述,本次实验发现了人参皂苷Rg3能抑制胃癌细胞增殖及迁移,促进胃癌细胞凋亡,且这种作用可能与调控lncRNA-LINP1的表达相关,这为治疗胃癌提供了新的药物选择。
