FOXQ1基因调控甲状腺乳头癌TPC-1细胞上皮-间质转化的机制研究
2020-11-27刘春辉曹文斌王晓涛陈建立王长友张国志
刘春辉,钟 烨,曹文斌,王晓涛,陈建立,王长友,田 炜,张国志
0 引 言
甲状腺癌是最常见的头颈部的恶性肿瘤,它主要包括甲状腺乳头状癌(papillary thyroid carcinoma,PTC),甲状腺髓样癌,甲状腺未分化癌,甲状腺滤泡状癌。PTC是甲状腺肿瘤中最常见的病理类型,其发病率约占甲状腺癌的80%以上,主要好发于女性和儿童[1]。手术切除是最常采用的治疗方法,但是部分患者可出现喉返神经损伤和窒息等严重并发症,尤其是老人和儿童预后生活质量明显下降。因此,近年来有关基因的靶向治疗成为了研究的热点。研究表明,PTC发生发展是由于多个癌基因的参与及其它各种因素共同导致的结果[2-3]。叉头框基因家族主要有FOXA、FOXB~FOXQ等亚家族成员,它是一类功能广泛且从酵母到人类都广泛存在的转录因子,具有高度保守的叉头DNA结构域[4-5]。叉头框Q1(Forkhead box Q1 ,FOXQ1)是FOX家族中重要的成员,该基因自身特定的DNA结构域与目的基因结合,通过启动转录来调控特定蛋白的表达水平,从而在肿瘤的发生发展中有着重要的作用[6-7]。研究表明,FOXQ1在膀胱癌、肝癌和结直肠癌等多种肿瘤中存在异常的高表达,调控着肿瘤细胞侵袭和转移能力,尤其在肿瘤的上皮-间质转化(epithelial-mesenchymal transition,EMT)的过程中扮演着重要的角色[8-11]。而FOXQ1对甲状腺乳头状癌细胞中EMT的调控作用以及与TGF-β1之间的关系尚有待于进一步的研究。本研究利用小干扰RNA技术沉默TPC-1细胞中FOXQ1基因后,观察细胞EMT的变化,探讨该基因是否参与TGF-β1调控TPC-1细胞的上皮间质转化。
1 材料与方法
1.1 材料人甲状腺乳头状癌TPC-1 细胞由天津医科大学基础医学院馈赠,FOXQ1-siRNA、无意义序列RAN(苏州吉玛基因有限公司),lipofectamineTM2000和FOXQ1、E-Cadherin、N-Cadherin和Vimentin引物(美国 Invitrogen公司),RNA提取试剂盒、SYBR Green qPCR Master Mix和反转录试剂盒(日本TaKaRa公司),DMEM培养基和胎牛血清(美国Gibco公司),兔抗人FOXQ1多克隆抗体(英国Abcam公司),单克隆抗体E-Cadherin、N-Cadherin和Vimentin(美国CST公司),TGF-β1粉剂(美国sigma 公司)。高分辨率倒置荧光显微镜(日本OLYMPUS公司),AI600化学发光成像仪(美国GE公司),qRT-PCR仪器(中国香港Gene Company Iimited公司)。
1.2细胞培养人甲状腺乳头状癌TPC-1细胞用10%~15%胎牛血清的DMEM(高糖)培养基,在5% CO2、37 ℃恒温的细胞孵育箱中常规培养。
1.3细胞转染将生长状态良好且传代次数在5代以内的细胞用胰酶消化制备成单细胞悬液(密度为3×105/mL)。首先随机将细胞分为空白对照组、阴性对照组和干扰组;然后按照lipofectamineTM2000说明书依次进行转染,每组设置3个复孔,空白对照组加入等量的磷酸盐缓冲液(PBS),阴性对照组加入lipofectamineTM2000和带有荧光标记的NC-siRNA,干扰组中加入转染试剂lipofectamineTM2000和FOXQ1-siRNA,置于37 ℃细胞孵育箱中常规培养。6 h后换液,PBS冲洗3遍。收集mRNA和蛋白用于后续实验。
1.4细胞中mRNA相对表达量的检测采用qRT-PCR法。首先提取TPC-1细胞总的RNA,待逆转录成cDNA后,利用qRT-PCR仪器进行PCR扩增,其中各引物序列分别为:FOXQ1-F:5'-ATTTCTTGCTATTGACCGATGC-3', FOXQ1-R:5'- CCCAAGGAGACCACAGTTAGAG-3'。 E-cadherin-F:5'- TGGCTTCCCTCTTTCATCTCC-3',E-cadherin-R:5'- CGTGAAGGTTTGCCAGTGTGA-3'。N-cadherin-F:5'- CCTGGCGTTCTTTATCCCG-3',N-cadherin-R:5'- CGTGAAGGTTTGCCAGTGTGA-3'。Vimentin-F:5'- TCAATGTTAAGATGGCCCTTG-3',Vimentin-R:5'- TGAGTGGGTATCAACCAGAGG-3'。PCR扩增的反应条件: 预变性95 ℃ 50 s,变性95 ℃ 5 s, 退火60 ℃ 30s,延伸72 ℃ 40 s,共40个循环。计算mRNA相对表达水平。每组设置3个复孔,实验重复 3次。
1.5细胞中蛋白相对表达量的检测采用蛋白免疫印迹法。转染成功后,首先提取细胞总蛋白,利用BCA法检测各组蛋白的浓度,蛋白变性后置于-80 ℃长期保持。蛋白量上样后SDS-PAGE蛋白电泳并转膜(90V,50 min),脱脂奶粉封闭1 h,加入一抗FOXQ1(1∶500)、E-cadherin(1∶1000)、N-cadherin(1∶1000)、 Vimentin(1∶1000)、GAPDH(1∶1000)。在室温下孵育8 h以上,再次洗膜3次,加入二抗室温下孵育2 h,充分洗膜后ECL荧光显色并采集图像。以GAPDH为内参,利用Image J软件分析灰度值。实验重复3次。
1.6细胞黏附能力的检测采用浓度为5 μg/mL人纤维蛋白粘连蛋白(FN)100 μL均匀铺于96孔板后,放入37 ℃恒温细胞培养箱中4 h,然后用2%BSA (Albumin Bovine V)封闭1 h,4℃过夜。取处于对数生长期的各组TPC-1细胞,调整细胞密度为3×104/mL,每孔取100 μL的细胞悬液均匀接种于96孔板。细胞培养箱中孵育1 h,弃培养基,用PBS冲洗3遍,每孔加入10 μL MTT(5 mg/mL)溶液,37 ℃恒温箱中继续反应4 h,吸净96孔板内的液体,每孔加入100 μL二甲基亚砜(DMSO),37 ℃恒温箱中震荡反应15 min,用酶标仪在490 nm测量每孔吸光度(即A值),A值代表细胞黏附数。每组设置3个复孔,实验重复3次。细胞黏附率计算公式为:
细胞黏附数=阴性对照组或干扰组/空白对照组×100%
1.7TGF-β1诱导TPC-1细胞取对数生长期的细胞接种于6孔板中常规培养,分别加入TGF-β1(终质量浓度5 ng/mL)的培养48 h后,然后提取各组细胞总的蛋白,Western blot法分别检测 TGF-β1诱导前后细胞中蛋白的相对表达水平。
1.8细胞侵袭、迁移能力的检测
1.8.1 细胞迁移能力检测采用Transwell小室迁移试验。转染24 h后,取各组处于对数生长期的TPC-1细胞,胰酶消化后用1%FBS培养基制备成单细胞悬液。取200 μL细胞悬液(2×105/mL)均匀接种于上室内,在下室中加入10%~15%FBS DMEM培养基(600 μL/孔)。将Transwell小室放入37 ℃恒温细胞箱中常规培养36 h。弃培养基,清除上室内未穿膜的细胞,PBS冲洗3遍,细胞固定后用苏木精染色,在倒置显微镜下观察,随机选取10个视野/组,计算小室膜细胞数的平均值。实验重复3次。
1.8.2细胞侵袭能力检测采用Transwell小室侵袭试验。首先用预冷的无血清DMEM培养基将Matrigel基质胶稀释,每孔取40 μL稀释液(浓度为50 mg/L)均匀铺于Transwell小室面,37 ℃恒温孵育箱1 h后,紫外线照射下过夜。其余的步骤同细胞迁移实验。实验重复3次。
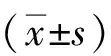
2 结 果
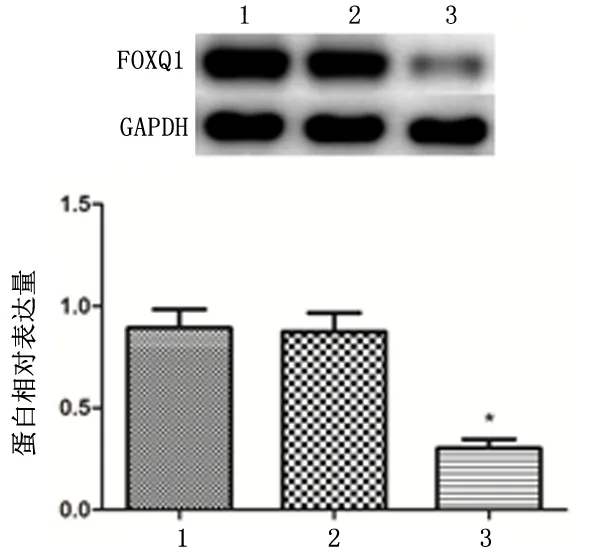
2.1 小干扰RNA转染TPC-1细胞的干扰效果与空白对照组和NC-siRNA组相比,FOXQ1-siRNA组的FOXQ1的mRNA和蛋白表达量均明显降低(P<0.01);而空白对照组和NC-siRNA组的mRNA和蛋白表达量之间的差异无统计学意义(P>0.05)。见图1、图2。
2.2细胞黏附能力的变化FOXQ1-siRNA组细胞的黏附能力较空白对照组和NC-siRNA组明显降低(P<0.05);空白对照组和NC-siRNA组之间差异无统计学差异(P>0.05)。见图3。

1:空白对照组; 2:NC-siRNA组; 3:FOXQ1-siRNA组
1:空白对照组; 2:NC-siRNA组; 3:FOXQ1-siRNA组

1:空白对照组; 2:NC-siRNA组; 3:FOXQ1-siRNA组
2.3细胞E-cadherin、N-cadherin、Vimentin的表达水平的变化FOXQ1-siRNA组E-cadherin 的mRNA和蛋白的相对表达量较空白对照组和NC-siRNA组明显升高(P<0.001),而空白对照组与FOXQ1-siRNA组之间差异无统计学意义(P>0.05);FOXQ1-siRNA组中N-cadherin和Vimentin的mRNA和蛋白表达量较其他两组明显降低(P<0.01),而空白对照组与FOXQ1-siRNA组之间差异无统计学意义(P>0.05)。见图4、图5。

与空白对照组和NC-siRNA组比较,*P<0.05

1:空白对照组; 2:NC-siRNA组; 3:FOXQ1-siRNA组
2.4TGF-β1对FOXQ1和EMT蛋白的影响Western blot检测结果示,细胞内E-cadherin、N-cadherin、Vimentin、FOXQ1蛋白48 h的相对表达量较0 h均明显增加(P<0.05)。见图6。
2.5细胞的侵袭、迁移能力的变化与NC-siRNA组相比,NC-siRNA+TGF-β1组中细胞穿透数明显增多;而TGF-β1+FOXQ1-siRNA组细胞穿透数较NC-siRNA+TGF-β1组明显减少(P<0.01);表明FOXQ1-siRNA转染成功转染细胞后可明显抑制TGF-β1诱导的细胞侵袭和迁移能力。见表1。

图 6 TGF-β1诱导48 h各组蛋白相对表达量
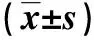
表 1 细胞迁移和侵袭的变化
2.6沉默FOXQ1基因后可逆转TGF-β1诱导的上皮间质化Western blot结果所示,与NC-siRNA组相比,TGF-β1诱导TPC-1细胞后NC-siRNA+TGF-β1组细胞内E-cadherin明显降低,而N-cadherin、Vimentin、FOXQ1蛋白的相对表达量均明显增加(P<0.05);沉默FOXQ1基因后,与NC-siRNA+TGF-β1组相比,FOXQ1-siRNA+ TGF-β1组细胞中E-cadherin蛋白的相对表达上调,而N-cadherin、Vimentin、FOXQ1蛋白的相对表达量均明显降低(P<0.05);表明FOXQ1-siRNA可逆转TGF-β1诱导的EMT。见图7。

1:NC-siRNA组; 2:NC-siRNA+TGF-β1组; 3:FOXQ1-siRNA+TGF-β1组
3 讨 论
近年来研究表明,FOXQ1基因在PTC组织中呈现高表达,与淋巴结转移密切相关;转录因子FOXQ1可参与调控肿瘤的上皮-间质转化(epithelial-mesenchymal transitions,EMT)的发生、细胞增殖以及肿瘤微环境等多种生物学功能,与肿瘤疾病的发生发展密切相关,因此有关FOXQ1基因的靶向治疗成为了该领域研究的热点[12-13]。肿瘤EMT的发生可使上皮细胞转化成间质表型细胞,从而使肿瘤获得侵袭和局部癌症转移的能力,它贯穿于整个肿瘤的恶性演变过程,且伴随着E-cadherin降低或者丢失,N-cadherin和Vimentin的异常高表达,以及肿瘤细胞的黏附能力增强[14]。FOXQ1在乳腺癌、胃癌和肺癌等许多肿瘤中表达上调,与肿瘤的浸润能力及淋巴结的转移密切相关,它可通过改变锌指E-盒结合同源异形盒2和Twist蛋白的表达水平介导肿瘤EMT的发生[15-17]。
小干扰RAN是一种干扰基因表达的技术,它可以阻断特定基因,而不影响正常等位基因的功能;小干扰RAN具有高序列特异性、高稳定性和高效率的特征,可精准地阻断目的基因的表达[18-19]。研究表明,在PTC组织FOXQ1的表达水平明显高于甲状腺正常组织,该基因的异常表达与淋巴结转移和肿瘤的分期有着密切的关系[20]。在PTC中,细胞EMT可以通过上皮-间质化的关键因子ZEB1基因来促进肿瘤细胞的恶性发展,从而使细胞获得侵袭转移的能力[21]。本研究通过小干扰RNA瞬时转染甲状腺乳头癌TPC-1细胞,结果发现FOXQ1-siRNA成功沉默细胞FOXQ1基因的表达,同时伴有上皮标志物E-cadherin的蛋白和mRNA相对表达量明显升高,间质标志物Vimentin和N-cadherin的蛋白和mRNA的相对表达量降低,表明沉默FOXQ1基因后可逆转TPC-1细胞EMT。
研究发现,TGF-β1信号通路肿瘤细胞EMT的关键通路[22]。在结直肠癌中,TGF-β1可以诱导FOXQ1蛋白的高表达,以及E-cadherin的蛋白表达水平降低,Vimentin和N-cadherin的蛋白表达水平升高,并且可以促进肿瘤细胞的侵袭迁移能力;沉默FOXQ1基因后阻断了TGF-β1信号通路,从而有效地抑制了肿瘤EMT和侵袭迁移能力,证实FOXQ1是TGF-β1信号通路的下游重要靶基因[9]。Zhang等[23]研究发现在乳腺癌中,TGF-β1对肿瘤细胞EMT诱导作用可通过沉默FOXQ1基因达到阻断的目的,且沉默该基因后可抑制TGF-β1诱导的侵袭及转移能力。因此我们进一步研究发现,在PTC中TGF-β1可诱导上皮标志物E-cadherin的蛋白表达水平升高,间质标志物Vimentin和N-cadherin的蛋白相对表达量降低,以及促进肿瘤细胞侵袭能力;沉默FOXQ1基因后可逆转TGF-β1诱导的EMT和侵袭迁移能力。这与Zhu等[8]在膀胱癌中靶向沉默FOXQ1基因可抑制或者部分抑制TGF-β1促进上皮间质转化的作用的结果相一致。
总之,沉默甲状腺乳头癌TPC-1细胞中FOXQ1基因后可逆转肿瘤细胞的EMT,并且FOXQ1基因可阻断或者部分阻断TGF-β1促进甲状腺乳头癌TPC-1细胞上皮-间质转化的作用,FOXQ11基因有望成为PTC患者生物学治疗的新靶标,从而为临床上基因联合靶向治疗提供理论依据。但FOXQ1基因与TGF-β1信号通路之间具体的机制尚有待于进一步深入的研究。
