类风湿关节炎患者滑膜组织自身抗原及瓜氨酸化修饰的质谱鉴定*
2020-11-26管晓龙李晓军许晓红
管晓龙,周 莹,殷 茵,刘 菲,李晓军,虞 伟,许晓红△
(1.安徽医科大学附属妇幼保健院/安徽省妇幼保健院检验科,安徽合肥 230001;2.东部战区总医院中心实验室,江苏南京 210002;3.安徽医科大学第二附属医院检验科,安徽合肥 230601)
类风湿关节炎(RA)是一种以滑膜慢性炎性反应、软骨畸形、骨质损伤、多种自身抗体产生及多器官功能障碍为特征的全身免疫性疾病[1]。瓜氨酸化作为一种经典的翻译后修饰,其诱导产生的抗瓜氨酸化蛋白抗体可出现在约70%的RA患者体内,并且与疾病的进展密切相关[2-5]。目前,已有少数抗瓜氨酸化蛋白抗体应用于RA的实验室诊断,如抗环瓜氨酸肽(CCP)抗体,但由于灵敏度较低,导致部分患者漏诊[2,5]。近年来,RA瓜氨酸蛋白质组学研究成为热点,CHANG等[6]将10例RA患者滑膜组织蛋白提取物进行合并,利用二维凝胶印迹、免疫共沉淀、质谱技术,鉴定出7种瓜氨酸化抗原,包括α-1-抗胰蛋白酶、纤维蛋白原、角蛋白84和波形蛋白等。VAN BEERS等[7]先用凝胶电泳将RA患者滑膜液进行分馏、转染,再使用多种抗体对其中的瓜氨酸蛋白进行标记,将其中2份富含多种瓜氨酸多肽的滑膜液进行质谱分析,共鉴定出53条瓜氨酸多肽,血清学验证后发现了3种新的自身抗原,分别是载脂蛋白E、髓核分化抗原、β-肌动蛋白,并提出只有少数瓜氨酸蛋白具有免疫原性。WANG等[8]采用类似的技术路线,利用基质辅助串联时间飞行质谱在RA患者滑膜液中发现182种瓜氨酸肽段碎片,但未进行大样本血清学验证。目前的技术手段仅鉴定到部分瓜氨酸抗原,特别是抗CCP抗体(-)RA患者的瓜氨酸蛋白谱尚不十分清楚。因此,本研究主要借助免疫蛋白质组学技术,以揭示RA特别是抗CCP抗体(-)患者滑膜的蛋白谱,为后续筛选相关生物标志物提供理论基础。
1 资料与方法
1.1一般资料 选择2013年1月至2016年1月收治的RA患者55例纳入RA组,其中抗CCP抗体(+)RA组41例,抗CCP抗体(-)RA组14例,选择同期系统性红斑狼疮(SLE)患者、健康体检人群各41例分别纳入SLE组及健康对照组。
1.2仪器与试剂 电泳仪购自BIO-RAD公司,超声细胞粉碎机购自美国Sonics公司,高效液相色谱质谱联用仪购自美国Thermo-Fisher公司。磷酸盐缓冲液、硼酸缓冲液、聚乙二醇6000购自美国Sigma公司,琼脂糖珠protein A购自美国GE Healthcare公司,胰蛋白酶购自美国Promega公司,蛋白酶抑制剂、组织蛋白裂解液购自美国Thermo-Fisher公司。
1.3方法
1.3.1标本采集 留取抗CCP抗体(+)、抗CCP抗体(-)RA患者滑膜组织,骨性关节炎及创伤性关节炎患者手术切除的滑膜组织标本各1份。采集所有研究对象血液标本,分离血清。
1.3.2分离血清中IgG-γ球蛋白 (1)先将各组研究对象的血清标本分别等量混合,各取0.1 mL混合血清加入0.2 mL硼酸缓冲液混匀,之后每管加入0.3 mL聚乙二醇6000,析出沉淀后放入冰箱4 ℃过夜;(2)另取4个EP管,离心后各取0.6 mL血清上清液,每管缓慢加入0.6 mL饱和硫酸铵溶液,静置30 min后离心;(3)沉淀物用46%饱和硫酸铵洗涤后离心,然后溶解于50 μL磷酸盐缓冲液备用。
1.3.3提取滑膜组织蛋白组分 分别称取20 mg滑膜组织放于EP管中,每管加入500 μL组织蛋白裂解液和50 μL蛋白酶抑制剂,剪碎后再用超声细胞粉碎机粉碎,离心后取上清液备用(均在冰上操作)。
1.3.4免疫共沉淀 (1)先取3 μL血清IgG-γ球蛋白和40 μL琼脂糖珠protein A相结合,NP-40裂解液洗涤后弃去上清液;(2)再分别加入200 μg滑膜蛋白提取液混匀后静置2 h,离心后弃上清液。
1.3.5蛋白质胶内酶解 (1)利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳将滑膜组织抗原成分进行分离,目标条带脱色至清晰后备用;(2)将每个目标条带切成6个大小适宜小胶条,加入脱色液后脱色至无色;(3)加入乙腈润洗后用真空离心浓缩仪进行脱水干燥,再加入500 μL纯水振荡洗涤后弃上清液;(4)加入NH4HCO3溶液振荡洗涤后弃上清液;(5)加入10 μL胰蛋白酶,胶条捣碎后37 ℃孵育过夜;(6)每管加入200 μL纯乙腈,静置离心后吸取溶液收集备用;(7)每管加入100 μL萃取液,孵育30 min后加入200 μL纯乙腈,静置离心后吸取上清液,将前后两次收集的上清液进行合并,其中轻链与重链两管合并,其余4管合并,真空冻干后备用。
1.3.6质谱鉴定 将标本冻干粉溶解于含5%甲醇及0.2%甲酸的溶液中,取20%含重链与轻链成分的溶液上样,取50%含其他组分的溶液上样,每份样品进行2个循环检测。样品进入C18色谱柱后进行分离,依次进入高效液相色谱质谱联用仪进行检测。再利用Mascot软件在美国国家生物技术信息中心(NCBI)参考序列数据库中进行检索匹配。
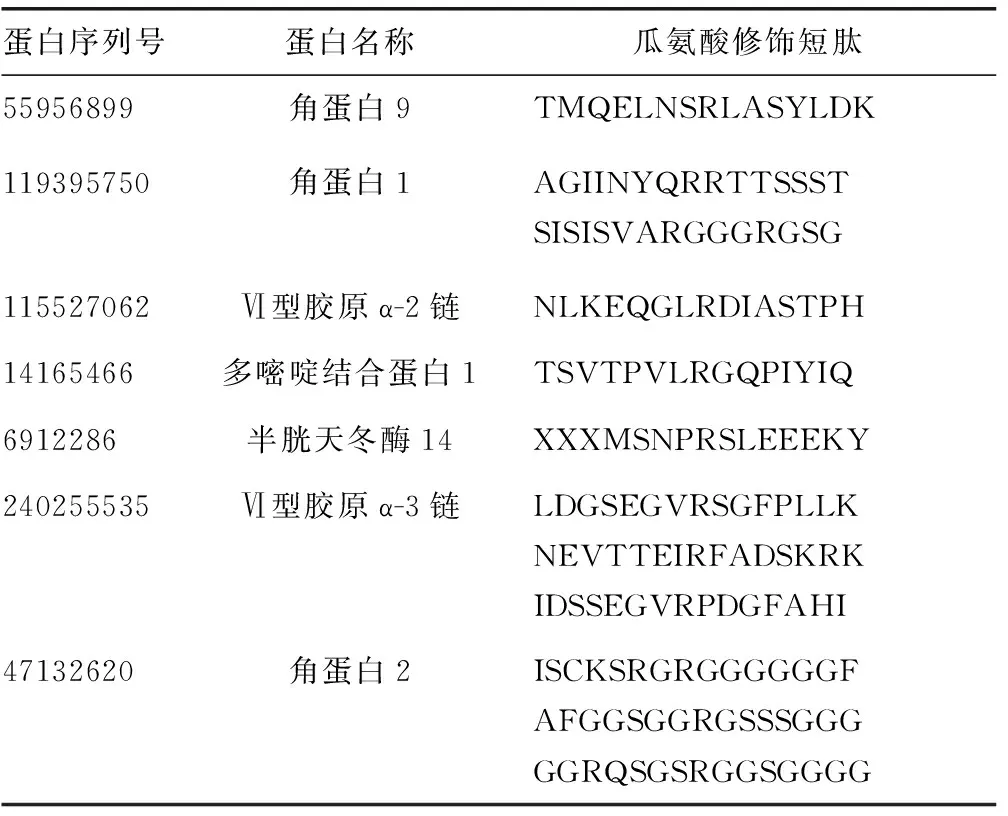
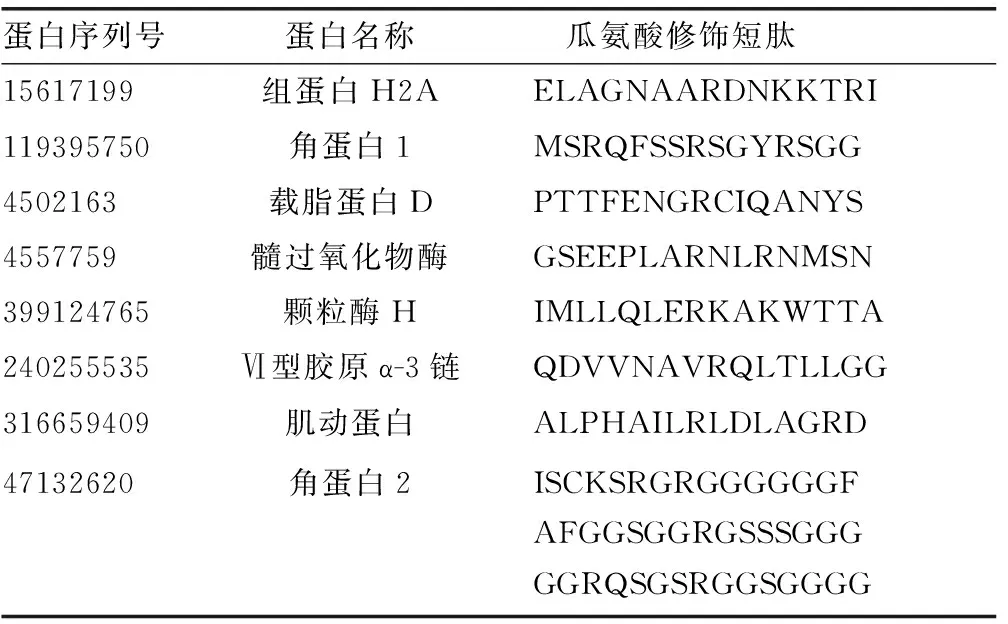
1.4统计学处理 蛋白筛选必须满足未卡离子分数值≥20,且特有肽段碎片个数≥1个。RA组蛋白FOT值>SLE组和健康对照组FOT值的3倍即判定为上调蛋白,FOT值 2.1RA滑膜总蛋白谱鉴定结果 利用质谱技术共鉴定出594种蛋白,其中抗CCP抗体(+)RA组鉴定出278种蛋白,抗CCP抗体(-)RA组鉴定出255种蛋白,SLE组鉴定出395种蛋白,健康对照组鉴定出191种蛋白。抗CCP抗体(+)RA组有125种上调蛋白,抗CCP抗体(-)RA组有87种上调蛋白;抗CCP抗体(+)RA组有18种下调蛋白,抗CCP抗体(-)RA组有40种下调蛋白。 仅在抗CCP抗体(+)RA组中特异表达的蛋白有60种,FOT值最高的前10种蛋白为角蛋白15、肌动蛋白、AATF蛋白、DNA结合蛋白5、Meckelin蛋白、中心体相关蛋白350、Ⅱ型肌醇3、G蛋白偶联受体、纤毛内转运蛋白81、纤维调节蛋白;而在抗CCP抗体(-)RA滑膜中特异表达蛋白有69种,FOT值最高的前10种蛋白为角蛋白31、角蛋白36、角蛋白19、角蛋白73、组蛋白H2B 1-K型、组蛋白H2A 3型、胰蛋白酶6、角蛋白83、过氧化物酶4型、黏蛋白样蛋白1。 2.2瓜氨酸修饰蛋白谱鉴定结果 RA组共鉴定出17种瓜氨酸修饰蛋白,其中抗CCP抗体(+)RA组有10种瓜氨酸化蛋白,包括半胱氨酸蛋白酶14、聚吡啶结合蛋白1、组蛋白H2A 2C型、角蛋白1、角蛋白2、Ⅵ胶原α-2链、角蛋白 9、角蛋白5、角蛋白10、Ⅵ胶原α-3链。抗CCP抗体(-)RA组有14种瓜氨酸化蛋白,包括载脂蛋白D、髓过氧化物酶、角蛋白16、角蛋白14、组蛋白H2A 3型、组蛋白 H2A 2-C型、角蛋白2、角蛋白 9、角蛋白1、角蛋白5、角蛋白10、Ⅵ胶原α-3链、肌动蛋白、颗粒酶H。 2.3瓜氨酸修饰短肽序列鉴定结果 取精氨酸及左右相邻7个氨基酸组成一条瓜氨酸短肽(共15个氨基酸序列),抗CCP抗体(+)RA组有12条瓜氨酸短肽过表达,抗CCP抗体(-)RA组有10条瓜氨酸短肽过表达,其中角蛋白2的3条瓜氨酸短肽在RA组中均表达上调,见表1、2。 表1 抗CCP抗体(+)RA组表达上调的瓜氨酸短肽序列 表2 抗CCP抗体(-)RA组表达上调的瓜氨酸短肽序列 本研究主要借助免疫蛋白质组学技术,利用混合血清分离的IgG-γ球蛋白从滑膜组织中结合抗原分子,揭示了RA患者滑膜组织的自身抗原表达谱。抗CCP抗体(+)RA组上调蛋白中,纤维调节蛋白是一种位于细胞外基质中富含亮氨酸的小分子蛋白多糖,该蛋白参与胶原纤维成熟、微血管形成、肿瘤发生发展、动脉粥样硬化等多种生理、病理过程[9]。纤维调节蛋白是关节软骨细胞外基质的重要组成部分,在幼儿、青少年的关节软骨中纤维调节蛋白含有较多硫酸角质素链,硫酸角质素链的数量会随着年龄的增长而减少,而在RA患者中硫酸角质素链的数量也减少,提示纤维调节蛋白可作为临床上RA潜在的治疗靶点[9]。 抗CCP抗体(-)RA组上调蛋白中,过氧化物酶4属于具有抗氧化功能的新蛋白家族成员,能通过调节过氧化氢信号传导、氧化蛋白折叠、干预氧化还原平衡等影响细胞的增殖,还可以通过清除细胞内及细胞外活性氧物质来发挥其对抗氧化应激损伤的保护作用[10-11]。CHANG 等[12]同样发现过氧化物酶4在RA患者滑膜组织、少数RA早期患者血浆中均发生过表达。过氧化物酶4在RA患者体内过表达的原因可能是由于随着病程的进展,加速的氧化应激反应刺激了内源性抗氧化剂蛋白保护滑膜组织免受氧化应激的损伤[13]。RA下调蛋白中,抗CCP抗体(+)RA组有18种蛋白表达下调,抗CCP抗体(-)RA组有40种蛋白表达下调,目前RA下调蛋白缺乏足够的临床研究,有待进一步探讨。 抗CCP抗体(-)RA患者体内同样存在瓜氨酸修饰的抗原,但只有少数瓜氨酸化蛋白具有抗体免疫原性,即与抗CCP抗体亲和性较低,所以现有市场上使用的第二代和第三代CCP试剂盒仍然具有一定的局限性。WANG等[8]在RA患者滑膜液中发现多种瓜氨酸修饰的角蛋白,角蛋白是一种与RA发病存在高相关性的抗原分子[3],本研究中RA患者体内表达上调的蛋白中也同样发现多种角蛋白亚型(如角蛋白1、2、9等)。抗角蛋白抗体(AKA,靶抗原:食道上皮前丝聚蛋白及其酸性异构体)、抗核周因子(APF,靶抗原:前丝聚蛋白去磷酸化产物)、抗丝聚蛋白抗体(AFA)等丝聚蛋白相关的自身抗体作为RA相关生物标志物虽具有较高特异度,但灵敏度较低[3]。角蛋白的亚型较多,本研究发现角蛋白2的3条瓜氨酸化短肽在抗CCP抗体(+)RA组及抗CCP抗体(-)RA组中均表达,能否成为改进RA辅助诊断的潜在生物标志物仍需进一步验证。 目前的研究依然存在一定的局限性,首先,可能会对滑膜组织中低丰度蛋白、与IgG亲和性较低的部分抗原漏检[14]。其次,与琼脂糖珠、免疫复合物结合的非特异性蛋白可能会被识别导致假阳性的产生。为了减少非特异性结合,本研究优化了实验操作期间的洗涤条件,并且采用了具有高度亲水性表面活性的琼脂糖珠,其对蛋白质的非特异性结合具有一定抵抗性。最后,目前RA组中仅鉴定出19条上调的瓜氨酸修饰短肽序列,其中Ⅵ型胶原短肽抗体用于RA的实验室诊断,灵敏度为65.52%,特异度为78.95%,其在抗CCP抗体(-)RA患者人群中受试者工作特征(ROC)曲线下面积可达到0.956[14],其余瓜氨酸短肽作为潜在的诊断标志物,尚未完成血清学验证。后续工作将进一步比较本研究中RA血清抗体结合反应滑膜组织的抗原谱,以及前期工作中分析的RA患者滑膜组织亲和纯化免疫复合物中抗原表达谱[15],两者之间的差异可有助于明确滑膜组织抗原谱的组成及其来源属性(游离沉积/原位沉积)。 抗CCP抗体(-)RA患者血清中同样存在瓜氨酸化抗原,且抗CCP抗体(+)RA患者有12条瓜氨酸短肽表达上调,抗CCP抗体(-)RA患者有10条瓜氨酸短肽表达上调,差异蛋白的鉴定为寻找RA新的生物标志物提供了理论依据。2 结 果
3 讨 论
4 结 论
