托烷司琼对H9C2心肌细胞缺氧/复氧损伤的保护作用与机制
2020-11-26龚兴瑞张雨飞田书宁
于 迪,龚兴瑞,吕 靖,张雨飞,田书宁,魏 琼,蒙 臣,李 清
0 引 言
缺血性心脏病(ischemic heart disease,IHD)是引起全球人口死亡的第1位因素,因此治疗缺血性心肌病带来的心肌损伤尤为重要[1]。而在治疗过程中,无法避免再灌注带来的心肌损伤,称为心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)[2-3]。托烷司琼是目前临床预防术后恶心、呕吐的常用药物,除传统的止吐作用外,托烷司琼还可通过调节α7烟碱乙酰胆碱受体(α7 nictinic acetylcholine receptor,α7nAchR)发挥抗炎疗效[4]。p38丝裂原活化蛋白激酶(p38 mitogen-acyivated protein kinase,p38 MAPK)是一种与细胞增殖、分化、炎症反应相关的重要信号通路,在MIRI中也扮演着重要角色[5]。MLA作为α7nAchR的竞争性拮抗剂,可通过抑制α7nAchR拮抗托烷司琼达到抗炎作用,而在心肌保护的作用机制中鲜有报道[6]。为此,本研究采用H9C2心肌细胞缺氧/复氧实验模拟心肌缺血再灌注损伤模型[7-8],观察托烷司琼是否通过激活α7nAchR在p38 MAPK信号通路对H9C2心肌细胞产生影响,为今后缺血性心肌病及其并发症的治疗提供新的理论依据和实验基础。
1 材料与方法
1.1 主要仪器和试剂二氧化碳细胞培养箱(Thermo Fisher,美国),酶标仪(上海仪涛,中国),低温高速离心机(Eppendorf,德国),荧光倒置显微镜(Leica,德国),DMEM高糖培养基(Hyclone,美国)。乳酸脱氢酶(LDH)试剂盒,购自南京建成生物工程研究所。TNF-α、IL-1β 的ELISA试剂盒,购自欣博盛有限公司。CCK-8细胞增殖检测试剂盒,购自东京生物科技有限公司。托烷司琼购自江苏瑞恒医药有限公司。MLA拮抗剂、兔抗鼠Cleaved caspase-3抗体、兔抗鼠GAPDH抗体,购自Cell Signaling Technology公司,鼠抗鼠p-p38抗体,购自Sigma,兔抗鼠p-pka抗体,辣根过氧物酶标记山羊抗兔和山羊抗鼠IgG二抗,均购自abcom。
1.2细胞培养与模型建立用来自ATCC公司H9C2胚胎大鼠心脏源性心室细胞,将细胞放置于二氧化碳细胞培养箱(37 ℃,5%CO2)中孵育,根据细胞状态更换新鲜培养基,待细胞生长至80% 时,利用胰蛋白酶消化进行传代与后续试验;缺氧/复氧模型建立:①将H9C2心肌细胞正常培养24至48 h,待细胞生长至80%,弃去旧培养液,加入无糖无血清培养基;②将细胞置于缺氧罐中(5%CO2+1%O2+94%N2混合气体)预充5 min,再将缺氧罐置于37 ℃培养箱环境中采取不同缺氧时间(6、12、24 h)处理;③经缺氧处理后的细胞从缺氧罐中取出,更换成含10%胎牛血清的DMEM高糖培养基,置于培养箱中37 ℃培养6 h,结果表明,缺氧12 h可引起H9C2心肌细胞存活率的明显下降,24 h细胞存活率过低,因此后续实验均采用缺氧12 h复氧6 h建立模型。
1.3确定托烷司琼的最适合浓度及细胞分组使用CCK-8法明确托烷司琼保护作用的最适合浓度,分别在H9C2心肌细胞缺氧前加入浓度1、10、100、1000 nmol/L的托烷司琼,托烷司琼在10 nmol/L时,细胞活力最佳,因此选择托烷司琼终浓度10 nmol/L进行后续实验。将培养好的H9C2心肌细胞分为正常组、溶剂对照组、缺氧/复氧组、托烷司琼组、MLA拮抗剂组、托烷司琼+MLA拮抗剂组6组:①正常组:不给予任何处理正常培养的H9C2心肌细胞;②溶剂对照组:H9C2心肌细胞加入10 nmol/L的托烷司琼,不做缺氧/复氧处理,正常培养18 h。③缺氧/复氧组:将H9C2心肌细胞进行缺氧12 h,复氧6 h处理;④托烷司琼组:H9C2心肌细胞缺氧前1h加入终浓度10 nmol/L的托烷司琼预处理,再进行缺氧/复氧处理;⑤MLA拮抗剂组:H9C2心肌细胞缺氧前2h加入终浓度10 nmol/L 的MLA拮抗剂预处理,再进行缺氧/复氧处理;⑥托烷司琼+MLA拮抗剂组:H9C2心肌细胞缺氧前2h加入终浓度10 nmol/L的 MLA拮抗剂,1h后给予终浓度10 nmol/L的托烷司琼,再进行缺氧/复氧处理。
1.4CCK-8 检测将H9C2心肌细胞消化重悬,细胞计数后,以每孔1×104个接种于96孔板,每组重复5个复孔,接种后培养24 h使细胞贴壁长至80%左右,按照不同分组处理后,弃去培养基在孔内加入含10%CCK-8反应液的100 μL培养基,立即放入培养箱孵育。1 h后用酶标仪检测各孔A值(450 nm波长下吸光度值)。
1.5乳酸脱氢酶(LDH)释放试验将H9C2心肌细胞消化重悬,细胞计数后,以3×105个接种于6孔板,培养48 h待细胞融合至80%左右,按照不同分组处理后,取细胞培养上清液,待严格按照LDH试剂盒说明操作,每组重复5个复孔,检测细胞中LDH活性。
1.6ELISA法检测按照上述方法不同分组处理后,取细胞培养上清液,待严格按照双抗体夹心ELISA法检测细胞中TNF-α、IL-1β浓度,每组重复5个复孔。
1.7细胞免疫荧光染色提前制作细胞爬片固定于12孔板培养皿内,待细胞消化重悬后,接种于12孔板培养细胞48 h,待细胞融合至80%左右,按照不同分组处理,采用Cleaved caspase-3抗体、DAPI 和荧光二抗孵育,荧光倒置显微镜观察托烷司琼预处理后缺氧/复氧心肌细胞细胞质中Cleaved caspase-3的表达情况。
1.8Western blot检测将H9C2心肌细胞消化重悬,细胞计数后,利用6孔板细胞培养皿培养细胞48 h,待细胞融合至80%左右按照不同分组处理后提取蛋白,将收集的蛋白样品分别加入12%SDS聚丙烯酰胺凝胶中进行电泳,聚偏氟乙烯膜转膜2 h,用5%脱脂牛奶封闭1 h 30 min后,将聚偏氟乙烯膜放置于抗体盒内4℃冰箱孵育过夜。第2天,用TBST洗涤后与相应的二抗在摇床上室温下孵育2 h,再次洗膜后进行显色。

2 结 果
2.1 ELISA法检测与正常组比较,缺氧/复氧组TNF-α、IL-1β和LDH浓度明显增加(P<0.01);与缺氧/复氧组比较,托烷司琼处理组 TNF-α、IL-1β和LDH浓度明显减少(P<0.05)。见图1。
2.2托烷司琼对p-p38、p-pka和Cleaved caspase-3蛋白表达的影响托烷司琼组较缺氧/复氧组p-p38、Cleaved caspase-3表达下调,p-pka表达水平升高(P<0.05)。见图2,表1。与正常组相比,缺氧/复氧组Cleaved caspase-3表达明显升高,而托烷司琼组Cleaved caspase-3表达降低(P<0.05)。见图3,表1。
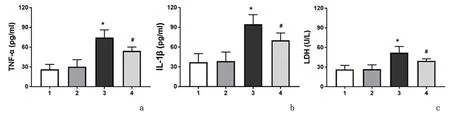
1:正常组;2:溶剂对照组;3:缺氧/复氧组;4:托烷司琼组

1:正常组;2:溶剂对照组;3:缺氧/复氧组;4:托烷司琼组

表 1 Tro预处理后蛋白相对表达量
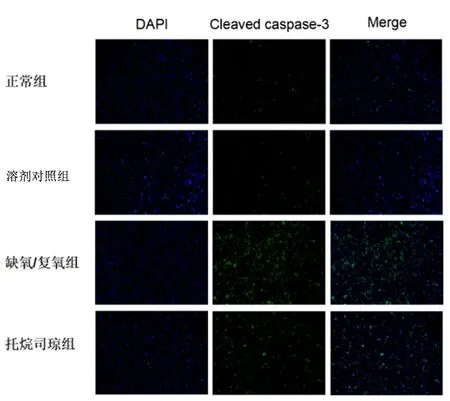
图 3 镜下观察各组心肌细胞Cleaved caspase-3细胞形态(免疫荧光染色 ×100)
2.3托烷司琼处理前预给MLA对p-p38和Cleaved caspase-3蛋白的影响与缺氧/复氧组比较,托烷司琼组p-p38和Cleaved caspase-3蛋白表达均降低(P<0.01); 与托烷司琼组相比,托烷司琼+MLA拮抗剂组p-p38和Cleaved caspase-3蛋白表达均升高(P<0.05)。见图4,表2。
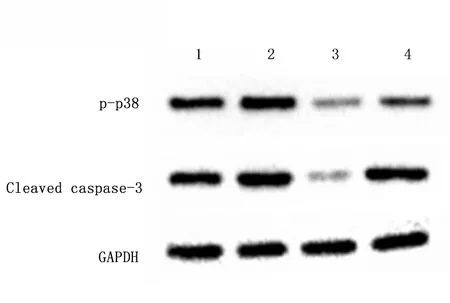
1:缺氧/复氧组;2:MLA拮抗剂组;3:托烷司琼组;4:托烷司琼+MLA拮抗剂组

表 2 Tro处理前预给MLA对p-p38和Cleaved caspase-3相对表达量
3 讨 论
在心肌缺血再灌注损伤中,心肌缺血会引起大量致炎因子释放,而再灌注是治疗心肌缺血的主要方式之一,但在改善血供的同时,也会进一步加重心肌损伤导致心功能下降[9-10]。因此,MIRI的治疗成为目前临床的研究热点,这对缺血性心肌病患者的预后与康复具有重要意义。H9C2心肌细胞是一种具有胚胎起源的大鼠左心室细胞,可代替原代心肌细胞作为模拟心肌缺血再灌注损伤的体外模型[11]。因此本文通过缺氧12 h复氧6 h成功建立H/R模型,观察托烷司琼预处理对H9C2心肌细胞的保护作用与机制。
本实验观察到H/R后细胞明显发生皱缩、变圆、大量死亡。CCK-8法检测在1~1000 nmol/L浓度的托烷司琼对心肌细胞存活率不产生影响,这与Asadi等[12]发现的结果一致,在1 pmol/L至1 μmol/L的托烷司琼浓度范围内孵育H9C2心肌细胞没有任何毒性作用。而在缺氧前给予不同剂量托烷司琼预处理发现在10、100 nmol/L浓度时细胞活性得到明显改善。并且10 nmol/L浓度托烷司琼预处理H/R可减少TNF-α、IL-1β、LHD释放,同时抑制Cleaved caspase-3表达水平。以往研究表明,在阿奇霉素诱导心肌毒性损伤中,托烷司琼可降低血清中心肌损伤指标,改善大鼠心电图与心肌收缩力的变化[13]。在脓毒症引起的心肌病中,托烷司琼也可通过抑制炎症反应调节大鼠心脏动作电位对心肌产生保护作用[14]。因此我们推测托烷司琼可抑制细胞炎症反应所导致的凋亡对H/R损伤起到心肌保护作用。
托烷司琼不仅作为一种5-羟色胺(5-hydroxytryptamine,5-HT)3受体拮抗剂,并且是一种选择性α7nAchR激动剂[15]。同时研究发现心肌细胞存在α7nAchR,通过激活α7nAchR可减轻心肌缺血再灌注损伤[16]。MLA作为一种α7nAchR的竞争性拮抗剂,可通过抑制α7nAchR拮抗托烷司琼对谷氨酸诱导的视网膜兴奋性毒性的改善,增加p38 MAPK磷酸化水平促进细胞凋亡[6],因此本文选择MLA作为托烷司琼的拮抗剂。蛋白激酶A(protein kinaseA,PKA)和p38 MAPK信号通路与MIRI有着密切的联系,研究发现激活PKA对心脏可产生保护作用,而再灌注早期产生大量的活性氧,可激活p38 MAPK表达增加,诱发细胞凋亡[17-18]。使用 p38 抑制剂 SB203580 预处理可通过降低氧化还原应激和细胞凋亡改善心肌缺血后大鼠心脏功能[19]。Aminzadeh发现托烷司琼可通过抑制p38 MAPK信号通路降低PC12细胞中炎性因子浓度,同时减少Casepase-3表达,进而减轻海马神经炎症反应,而这一效应与完全或部分激活α7nAchR有关[20]。我们的结果显示,10 nmol/L剂量托烷司琼H/R前预处理可降低p-p38、Cleaved caspase-3蛋白的表达,以及上调p-pka蛋白水平。而10nmol/L MLA明显阻断了10nmol/L剂量托烷司琼对p-p38、Cleaved caspase-3蛋白表达的抑制作用。说明托烷司琼可通过激活α7nAchR抑制p38 MAPK信号通路,发挥心肌保护作用。
综上所述,托烷司琼可通过激活α7nAchR抑制p38 MAPK信号通路,进而减轻H9C2心肌细胞缺氧/复氧产生的炎症反应,抑制细胞凋亡,最终产生心肌保护作用,这为临床治疗提供了新的理论依据。因此托烷司琼可能对心血管疾病特别是缺血性心肌病具有一定的治疗和预防效果,临床应用前景值得期待。
