原发性肝细胞肝癌微血管浸润分级的危险因素预测
2020-11-26刘永倩赵新湘
刘永倩,赵新湘
肝细胞癌(hepatocellular carcinoma,HCC)是成年人最常见的原发性肝癌,约占所有肝癌的80%,估计每年全球有78.2万新发病例[1],也是导致癌症相关死亡的第三大原因[2]。虽然肝癌的治疗方式在不断发展,但肝切除术仍是许多患者的首选治疗方法[3]。然而,由于肝切除术后的高复发率,HCC患者的远期生存率仍待提高。血管侵犯是导致HCC早期复发的危险因素。此外,伴有血管浸润的肝癌患者的复发也限制了后期各种治疗方法的运用,比如再次肝切除和射频消融(radiofrequency ablation,RFA),从而导致了较差的生存期[4]。
血管侵犯可分为大血管侵犯和微血管侵犯(microvascular invasion,MVI)[5]。常规影像学检查对大血管侵犯诊断及发现没有问题,但要发现MVI则很困难,目前MVI主要根据术后病理来诊断。如何在术前对HCC患者行MVI预测是目前研究的热点。但之前大多数研究并未将MVI的组织学特征进行细分,如癌栓对血管的侵犯程度、癌栓癌细胞数量、侵犯脉管数量、分布范围等,因为不同的组织学特征的临床病理特征不同[4,6],所以有必要对MVI进行分级,但目前关于MVI分级预测的研究相对较少,多局限于MIV阳性或阴性的预测。HCC患者在肝切除术前如能尽早地预测MVI分级的高低可更好有助于治疗方案的选择和预后的评估,因此本文对此进行研究。
材料与方法
1.一般资料
本研究纳入了昆明医科大学第二附属医院肝胆四个病区2013年9月-2015年11月肝切除术后的117例HCC患者,其中男98例(83.8%),女19例(16.2%),年龄35~82岁。排除标准:①术后30天内手术相关死亡;②手术切缘阳性;③大血管侵犯(影像学显示主要侵犯门静脉或肝静脉分支);④病例资料不完整;⑤肝功能C级。
2.定义
MVI定义为病理切片中发现微静脉内有成团的癌细胞且周围有明确的内皮细胞环绕,分为三个级别:M0为未发现MVI;M1为低危组(近癌旁肝组织中出现且不超过5个MVI);M2为高危组(近癌旁肝组织中出现或至少有6个MVI)。按照Edmondson病理分级,Ⅰ级为高分化,Ⅱ~Ⅲ级为中分化,Ⅳ级为低分化。
3.分组
记录患者的各项基线及临床指标(性别,年龄,AFP,有无乙型肝炎、病理活检肝硬化)、影像特征(肿瘤直径、数量、包膜)、病理(Edmondson分级)。将患者按照性别分为男、女两组;按年龄分为≤50岁,>50岁两组;按甲胎蛋白(AFP)水平分为<100ug/L、100~400ug/L、>400ug/L三组;按有无肝硬化分为无肝硬化组和有肝硬化组;按有无肝炎分为无肝炎组和有肝炎组;按癌灶直径分为≤4 cm和>4 cm两组;按癌灶包膜分为无包膜、包膜不完整、包膜完整三组;按肿瘤分化程度分为低、中、高分化三组。
4.统计学分析
采用SPSS 21.0进行统计分析,采用Kruskal-Wallis检验及Mann-Whitney检验进行单因素分析,对MVI级别三组患者的基线资料、临床病理指标及影像学参数进行组间比较;以肝癌并发MVI的三个级别作为因变量,将单因素分析中P<0.2的因素纳入多因素回归分析中作为自变量,构建有序多分类logistic回归模型,分析影响肝癌MVI级别的独立危险因素。绘制ROC曲线分析肿瘤直径范围预测MVI分级的效能。以P<0.05为差异有统计学意义。
结 果
1.肝癌MVI级别的单因素分析
三组患者在肿瘤直径、包膜方面差异有显著统计学意义(P<0.001,图1~3),在肿瘤Edmondson病理分级方面差异有统计学意义(P=0.037),MVI 2级患者中肿瘤直径>4 cm、无包膜及肿瘤低分化程度的比例明显高于MVI 0和MVI 1级患者中的比例(图3);三组在性别,年龄,AFP水平,有无肝炎、肝硬化,肿瘤数量上差异无统计学意义(P均>0.05,表1)。
2.肝癌MVI级别的有序多分类logistic回归分析
肿瘤直径(OR=0.195,P<0.001)、包膜(OR=6.772,P<0.001)及Edmondson分级(OR=5.720,P=0.040)为影响肝癌MVI级别的独立危险因素(均P<0.05,表2)。
3.确定最佳临界值
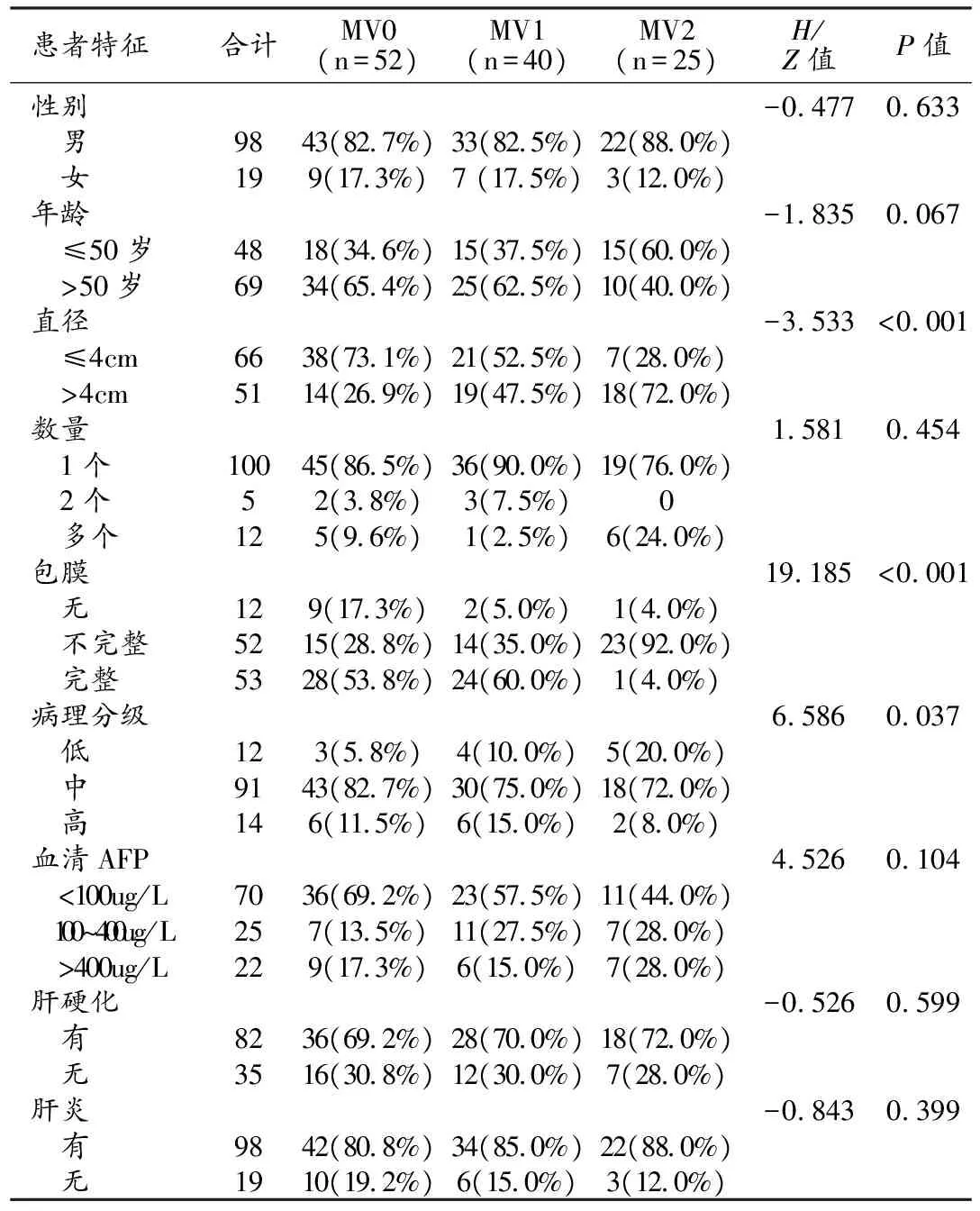
表1 三组患者临床基线资料比较 [例(百分比)]
根据肿瘤直径的预测效能绘制ROC曲线(图4),曲线下面积(area under the curve,AUC)为0.764,95%置信区间(95%CI)为0.656~0.872(P<0.001),AUC为0.70~0.90,即肿瘤直径预测MVI分级有中等的准确性,肿瘤直径预测MVI分级最佳临界值为3.9 cm,即直径>3.9 cm可预测为MVI 2级,此时敏感度为92.0%,特异度为48.9%。
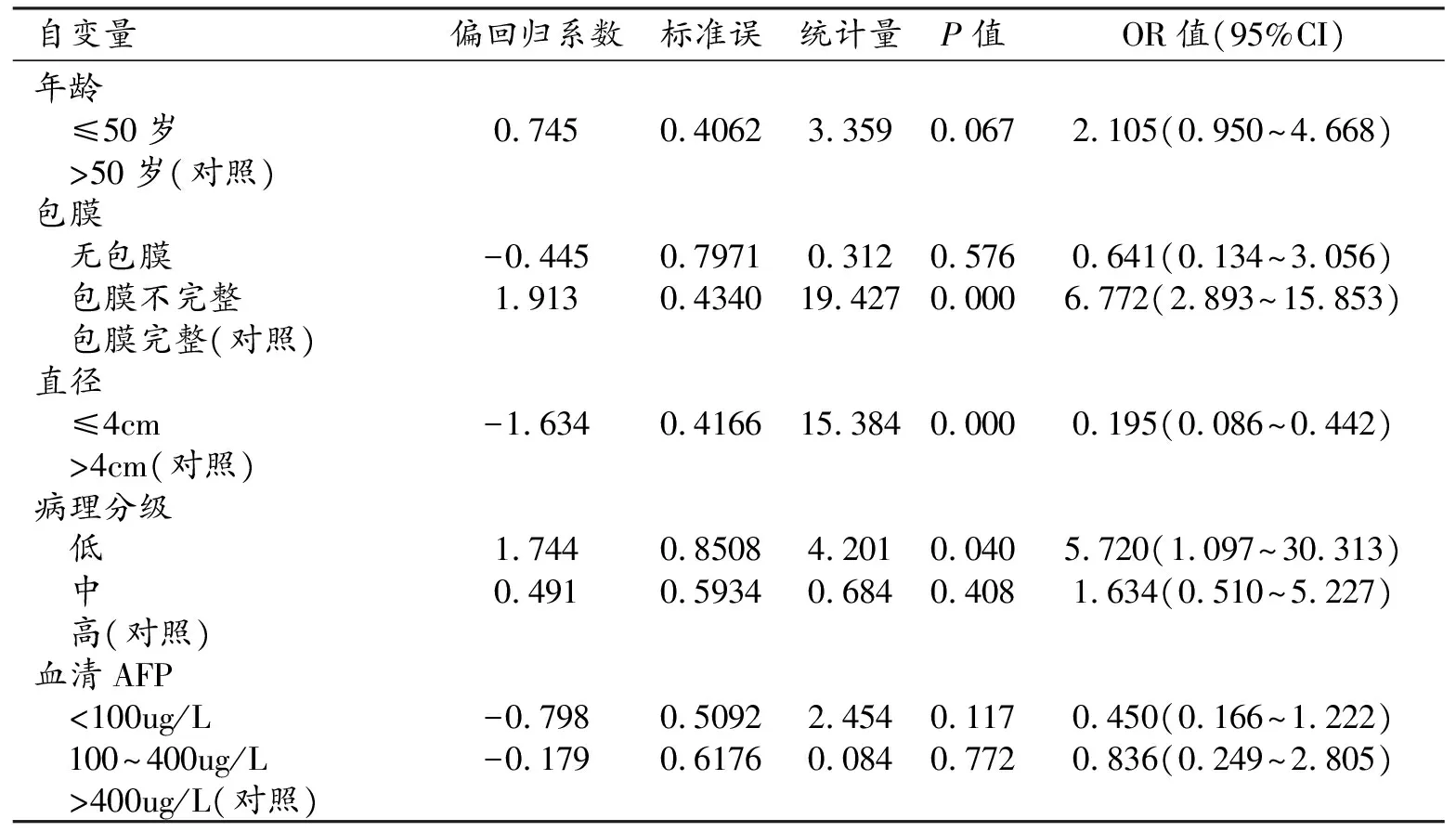
表2 肝癌MVI级别的影响因素分析
讨 论
1.患者基线资料、临床指标与MVI
关于患者的各项基线资料、临床指标与MVI的相关性,之前报道的研究结果并不一致。在年龄方面,有研究提出年龄大于65岁是 MVI 重要的预测因子[7]。但也有研究表明年龄不是MVI的潜在预测因素[6,8]。本研究显示年龄与MVI的发生及其分级没有统计学相关性。性别方面,多项研究表明性别与MVI无关[6,8]。本研究也显示性别与MVI分级无关。关于血清AFP水平,有研究提出AFP水平可作为潜在预测因子,可用于预测肝癌根治性切除后的早期复发,提示可能存在潜在的微血管侵犯,多项研究提示血清AFP>400 ug/L为MVI存在的危险因素[7,9]。然而本组研究中AFP水平与MVI的分级未见相关性。有研究表明患者有无肝硬化或肝炎与MVI没有显著预测意义[8]。 对此,本研究也未发现相关性。
2.影像学指标与MVI
关于影像学指标与MVI的相关性,之前报道的研究结果也不一致。Chandarana等[10]研究显示肿瘤直径与微血管侵犯没有显著的相关性,但多项研究证实肿瘤直径越大,发生MVI的可能性越大[11],只是研究认可肿瘤直径不同,有研究提出肝癌肿瘤的直径>5 cm是预测MVI的危险因素[8],有研究提出预测MVI的危险因素是肿瘤直径(>8 cm)[9],也有的表明是肿瘤直径(>4 cm)[7-8],本组研究显示肿瘤直径大于>3.9 cm是MVI的分级的独立危险因素。关于肿瘤数量,有研究提出即使患者的肿瘤较大,只要是单一病灶,就可以进行肝移植,提示病变的数量是一个重要的预测因素[10]。对此,Banerjee等[11]研究显示肿瘤数量越多,MVI存在的可能性越大,提出MVI通常与肿瘤负荷有关。 此外,也有研究显示肿瘤数量(>3)是MVI存在的危险因素[9]。然而也有研究报道肿瘤数量对MVI没有显著预测意义[8]。本研究结果与之相同,肿瘤数量与MVI的分级未见显著相关性。关于肿瘤的包膜,一项研究显示包膜的存在或不存在与微血管侵犯无关[12]。但多数研究显示包膜缺失和包膜侵犯与MVI呈正相关[13],本组研究显示无包膜或包膜不完整MVI级别越高。
3.病理Edmondson分级与MVI
关于病理Edmondson分级与MVI的相关性,报道的研究结果也不相同。对于肿瘤的病理分型,有研究显示肿瘤分化可能是一个独立的预后因素,而不是微血管侵犯的标志,即肿瘤的高、中、低分化与MVI无关[10]。但有研究提出肿瘤低分化是MVI的重要预测因子[7-8]。Banerjee等[11]也提出MVI与不良组织学分级密切相关。 本研究结果与之一致,显示肿瘤的分化程度与MVI分级具有相关性,肿瘤分化程度越低,MVI级别越高。
4.本组研究局限性
首先,本组为回顾性研究,可能在数据收集方面存在偏倚。其次,本组大多数患者有乙肝病毒感染背景,乙肝病毒感染是我国肝癌的主要病因,本研究可能不适用于非肝炎患者,比如北美和欧洲国家的患者。第三,本组患者未使用肝脏特异性对比剂(钆塞酸二钠),Kim等[14]认为,钆塞酸二钠肝胆期显示的瘤周低密度对预测MVI有很高的特异性。但由于价格因素,并不是所有患者均能承担钆塞酸二钠,此外,MVI阳性患者,由于肿瘤直径较大,常规钆剂已经能够明确诊断HCC。
综上,肿瘤的直径和包膜是MVI分级的独立危险因素,这提示我们在临床影像工作中需要对病变直径进行准确的量化、对包膜进行细致的观察和评价,尤其要注意当肿瘤直径>3.9 cm时则预示着MVI级别的升高,可提供给手术医生更多有价值的信息、更好地指导手术方案的选择。此外,对于术后病理未能开展MVI分级的医院,依据传统的Edmondson病理分级(肿瘤分化程度),再结合影像特征,也可对MVI分级高低进行预测,指导患者的预后。