碳酸盐热稳定性的一种简单标度方法
2020-11-25梁永锋韩新宁曹江平
梁永锋,员 蓉,王 会,韩新宁,曹江平
(宁夏师范学院 化学化工学院,宁夏 固原 756000)
碳酸盐是无机化学教学中一类重要的化合物,在无机化学教学中,对于其热稳定性大小的比较是无机化学学习的重要内容之一。但是,在现行的教科书和教学中对其热稳定性大小定性讨论的多,定量计算的少[1-3],即使定量讨论,也大多是从一个侧面对其热稳定性的强弱进行论证[4-5],同时,有关碳酸盐的分解温度在相关的文献中难以查找。在教学中深感有必要对碳酸盐的组成、结构和热稳定性之间的关系进行定量讨论,使学生进一步理解化合物组成、结构和性质之间的关系,学习模型构建的方法,并培养学生证据推理与模型认知等核心素养。
1 碳酸盐分解过程的热力学分析
碳酸盐当加热到一定温度时就分解为相应的金属氧化物和二氧化碳,其分解方式可表示为:
MCO3(s)□MO(s)+ CO2(g)
根据吉布斯-赫姆霍兹方程式△G=△H-T△S,碳酸盐分解后均生成1molCO2气体,因此,碳酸盐热分解是一个熵增加过程,对于不同的碳酸盐,△S几乎是相同的,△G的大小主要取决于△H的大小。而:
△H =△fHm(MO)+ △fHm(CO2)-△fHm(MCO3)
不同的碳酸盐分解反应都生成CO2,△fHm(CO2)一项是共同的,实质上,对不同的碳酸盐来说,△H主要决定于△fHm(MO)及△fHm(MCO3)的相对大小。
1.1 金属离子半径大小对碳酸盐分解温度的影响
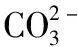
T ∝ 1/r+
1.2 金属离子极化力对碳酸盐分解温度的影响
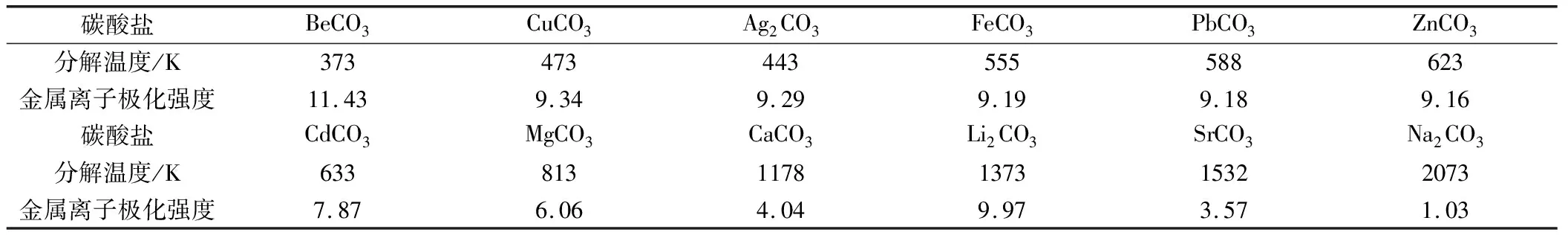
表1 碳酸盐的分解温度与金属离子的极化力对照
由此可见,碳酸盐的热稳定性是决定于中心C原子的极化强度与金属离子的反极化强度的大小,金属离子反极化作用越强,即中心C原子与金属离子极化强度之间差值越大,则碳酸盐的热稳定性就越小,因而分解温度就越低。
2 碳酸盐分解温度的计算公式的推导
为了研究问题方便,把碳酸盐的同系物用通式Mm(CO3)n表示。同时提出用分子稳定势(S*)表示中心C原子与金属离子极化强度之差,并定义为:
式中S*称为分子稳定势;Z*是中心原子有效电荷;Z是金属原子的形式电荷;r为原子共价半径(Å);a是表征金属离子变形参数,单位与r 相同。
参数(Z*/r)CA表征中心原子的极化力;(Z/r)m表征金属离子极化力;(Z/r2)m表征金属离子的附加极化参数,它与金属离子电子构型及r的大小有关.这样a(Z/r)m则是表征金属离子的附加极化力,其量纲与(Z/r)m相同;a值主要与金属离子结构及加热温度的高低有关。
将碱土金属及位于周期表中第四周期部分副族元素碳酸盐的分子稳定势S*(取a=0为参比)为横坐标,相应的分解温度(文献值)lgT(K)为纵坐标作图,结果如图1所示。
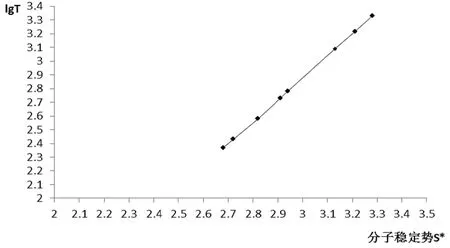
图1 碳酸盐分子稳定势S*对分解温度的影响
由图1可知,碳酸盐热分解温度lgT与中心原子稳定势S*之间呈线性关系,可用线性方程表示:
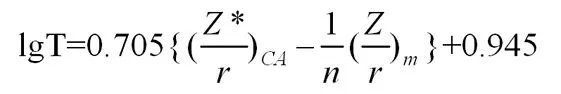
(1)
对于第四周期的金属元素的离子随电子层数的增加,它们的附加极化作用力增大,对碳酸盐热稳定性产生较大的影响,则需对金属离子引入适当的变形性参数a,因此,对于Mm(CO3)n型碳酸盐分解温度的分子稳定势标度修正为:
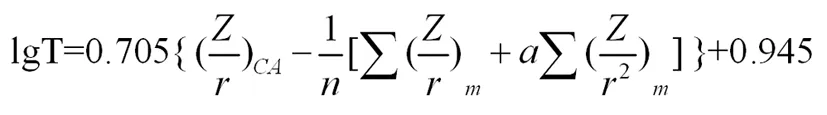
(2)
将(2)式可简化为:
lgT=0.705S*+0.945
(3)
计算时,上式中(Z*/r)CA通用4.22,对于碱土金属及第四周期元素a值取零;对第五、六、七周期金属元素除具有18、18+2电子构型的第六周期少数金属元素及锕系元素a值取0.4外,其余元素a值均取0.3。
3 计算结果与误差分析
应用公式(3)对文献中可查找到的32种碳酸盐的分解温度进行了计算与比较,结果列于表2,从表中的数据分析可以明显的看出,绝大多数的计算值与文献上的实验值非常吻合,相对误差小于0.5%。只有三组数据的相对误差大于1%,即碳酸钙的分解温度的计算值比实验值偏大2.16%,这可能是由于碳酸钙有不同的晶型菱型(低温型)和正交晶型(高温型)所致;碳酸铍分解温度的计算值比实验值偏大2.06%,这是因为铍离子具有较大的反极化作用。
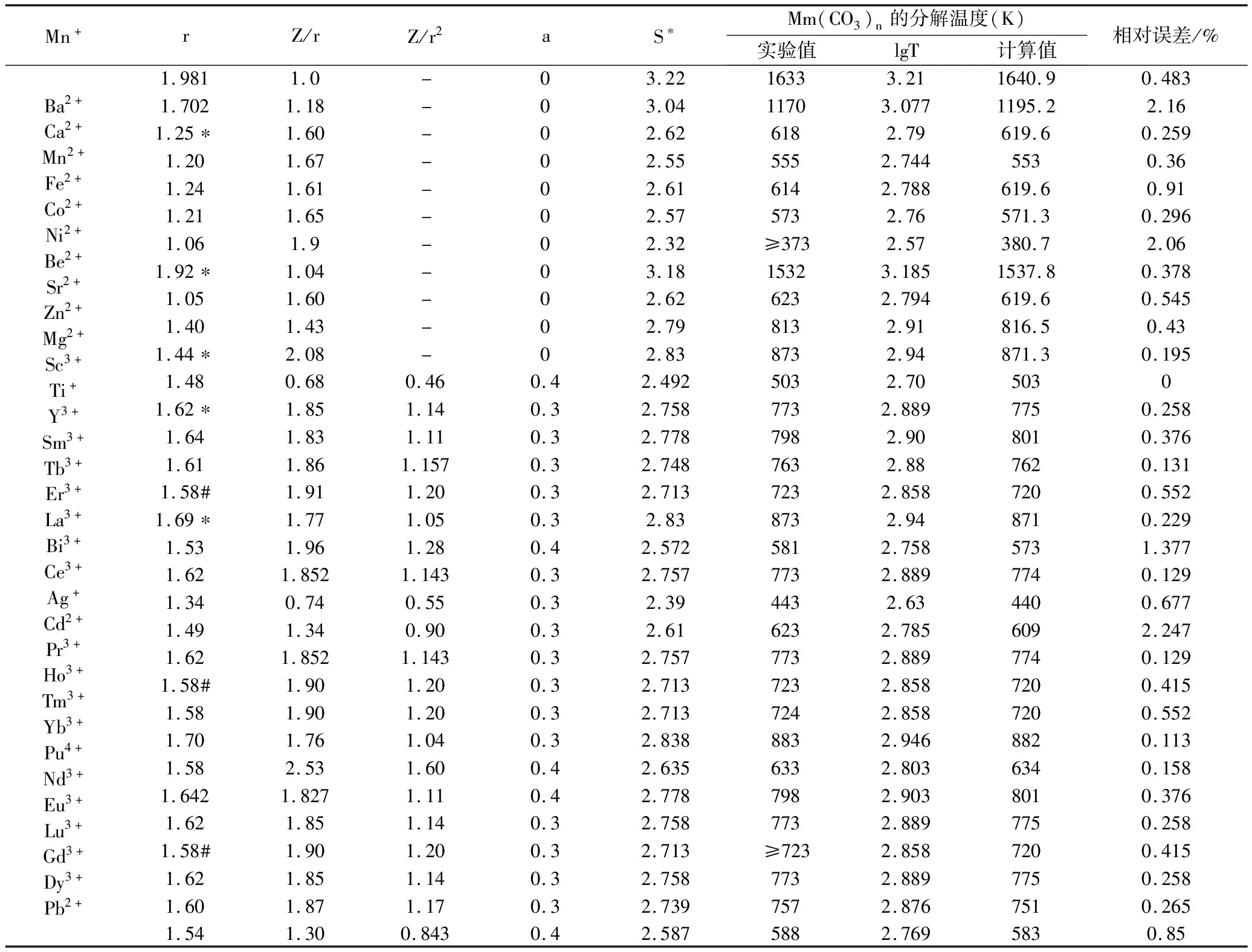
表2 碳酸盐分解温度的计算值与实验值比较
5 结论
计算表明,用分子稳定势作为碳酸盐热稳定性的定量标度是合理的,碳酸盐分解温度计算公式的推导既是科学的又是可行的,计算的结果是可靠的,它为教学、实验和生产提供了方便,同时也为研究其热稳定性提供了定量数据。
