Prospero相关同源异形盒蛋白1在非小细胞肺癌中的表达及意义
2020-11-25杨光,张昆,王俊
杨 光,张 昆,王 俊
1.淄博市第一医院心胸外科,山东 淄博 255200;2.中国人民解放军济南军区总医院肿瘤科,山东 济南250031
肺癌是全世界癌症相关死亡的主要原因之一[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)约占全部肺癌的80%。尽管近年来针对肺癌的手术治疗、放疗和化疗已取得了长足进步,但是患者5年生存率仍不足15%[2]。寻找肺癌潜在的分子生物学标志物是近年来研究的热点。Prospero相关同源异形盒蛋白1(prospero-related homeobox 1,PROX1)是一种高度保守的转录调节因子,其基因位于染色体1q32.2~32.3上,对淋巴管的形成和发育起到重要作用[3]。既往研究[4-6]发现,PROX1在乳腺癌、甲状腺癌和胶质瘤组织中高表达,并且与肿瘤细胞增殖、分化、侵袭、迁移和凋亡等密切相关。Zhu等[7]发现,PROX1在小细胞肺癌细胞中高表达,敲低PROX1基因后癌细胞增殖能力明显受到抑制。PROX1在NSCLC中的表达水平及意义既往少有报道。本研究用免疫组织化学法检测了NSCLC组织中PROX1的表达,探讨PROX1与临床病理学特征和预后的关系。此外,本研究通过下调PROX1的表达观察NSCLC细胞增殖、侵袭和迁移的变化,以期寻找潜在的NSCLC生物学标志物。
1 材料和方法
1.1 材料
1.1.1 试剂和仪器
DF-12培养基、胎牛血清和胰蛋白酶均购自上海泽叶生物科技有限公司,Tris/EDTA修复液购自北京盛科博源生物科技有限公司,SP免疫组织化学试剂盒购自上海研卉生物科技有限公司,鼠抗人PROX1单克隆抗体、辣根过氧化物酶标记山羊抗小鼠IgG、β-actin单克隆抗体购自美国Sigma公司,二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量检测试剂盒和十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶快速制备试剂盒均购自宝生物工程(大连)有限公司,LipoFiterTM脂质体转染试剂购自汉恒生物科技(上海)有限公司,PROX1 si-RNA由上海吉马制药有限公司合成并提供,细胞计数试剂盒(cell counting kit-8,CCK-8)和transwell小室购自北京智杰方远科技有限公司。CO2培养箱购自美国Thermo公司,CX41型光学显微镜购自日本Olympus公司,超灵敏化学发光成像仪购自美国GE公司,微孔板阅读器购自德国耶拿分析仪器股份公司。
1.1.2 细胞
人NSCLC细胞系A549、H460、H1229和H358,人支气管上皮细胞Beas-2b均购自中国科学院典藏培养物保藏委员会细胞库/中国科学院上海生命科学研究院细胞资源中心。用含10%胎牛血清、100 U/mL青霉素和0.1 mg/mL链霉素的DF-12培养基进行培养,培养条件为37 ℃、CO2体积分数为5%,每3 d换液1次,当细胞融合度达80%时进行传代。
1.1.3 组织样本
选取2011年1月—2013年6月在淄博市第一医院进行择期手术治疗且资料完整的NSCLC患者86例,术前均未接受放化疗或免疫治疗,术后经病理学检查证实为NSCLC。86例患者中男性50例,女性36例;年龄46~68岁,平均(57.98±9.04)岁;TNM分期为Ⅲ~Ⅳ期37例,Ⅰ~Ⅱ期49例;肿瘤直径≥3 cm者55例,<3 cm者31例;吸烟45例;腺癌48例,鳞癌38例;出现淋巴结转移38例、远处转移12例。术中留取癌组织及配对的癌旁组织(距离癌组织≥5 cm[8]),组织石蜡标本均由淄博市第一医院病理科完成。
1.2 方法
1.2.1 免疫组织化学法检测组织中PROX1的表达
石蜡切片厚度为4 μm,在70 ℃下烤片30 min,随后进行脱蜡处理。用Tris/EDTA修复液进行抗原修复,羊血清封闭30 min,加入鼠抗人PROX1单克隆抗体(1∶200)4 ℃过夜,加入辣根过氧化物酶标记山羊抗小鼠IgG,37 ℃温育30 min。随后用辣根过氧化物酶标记的链霉素卵白素工作液和二氨基联苯胺(diaminobenzidine,DAB)显色液处理,苏木紫复染。经过脱水、透明、封片处理后在显微镜下观察。每张切片随机取10个视野,每个视野计数100个癌细胞,根据细胞的染色强度及阳性细胞比例判断PROX1表达情况。染色为阴性记0分、浅黄色1分、棕黄色2分、棕褐色3分;阳性细胞数为0%~10%记1分、11%~50%记2分、51%~80%记3分、81%~100%记4分,将二者评分相乘得出最终结果:0分(阴性);1~3分(弱阳性);4~8分(中等阳性);9~12(强阳性)。0~3分低表达;4~12分为高表达[9]。
1.2.2 蛋白质印迹法(Western blot)检测
取对数生长期细胞加入蛋白裂解液,冰上裂解25 min后,12 000×g离心15 min后收集上清液。用BCA法检测蛋白浓度,每孔上样蛋白量为50 μg。经凝胶电泳(SDS-PAGE)后将蛋白转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,脱脂奶粉封闭1 h,温育一抗(鼠抗人PROX1单克隆抗体,1∶200),4 ℃过夜后弃去一抗,洗膜缓冲液(tris-buffered saline Tween,TBST)洗膜3次。随后室温温育二抗2 h,弃去二抗,TBST洗膜3次,每次5 min。以β-actin作为内参,采用电化学发光(electrochemical luminescence,ECL)仪对蛋白成像,采用Image J软件分析灰度值。
1.2.3 细胞转染
以2×105个细胞/孔将A549细胞接种于6孔板中。转染前用PBS洗涤细胞2次,加入1.8 mL无血清培养基。分别用100 μL无血清培养基稀释10 μL LipoFiter和10 mL si-RNA(或者si-control),静置5 min后将二者混匀,混合物加入6孔培养板中,转染6 h。si-RNA序列为5’-GGACGGGAAGUUAGACAAAGA-3’;si-control序列为5’-GGAAGUUAGACAA AGAUGAGA-3’。
1.2.4 克隆形成实验
转染24 h后,用2.5 g/L胰蛋白酶消化细胞,以1 000个细胞/孔将细胞接种于6孔培养板中,置于37℃、CO2体积分数为5%培养箱中培养中,培养3周,每3 d换液1次。当出现菌落时停止培养,弃去培养基。用4%多聚甲醛固定30 min,随后用结晶紫染色,统计每孔克隆数目。实验重复4次。
1.2.5 细胞增殖实验
转染后将细胞以10 000个/孔接种于24孔板中,使用CCK-8试剂盒检测细胞活性,培养24、48、72和96 h后,向每孔中添加10 μL CCK-8,继续培养4 h。用微孔板阅读器在490 nm波长处读取吸光度(D)值。实验重复4次。
1.2.6 Transwell侵袭与迁移实验
在transwell迁移板下室每孔中加入600 μL培养基。转染后以5×104个细胞/孔的密度将细胞铺于transwell迁移板上室中,温室培养24 h。弃去上室培养基,用PBS洗涤2次,随后用4%多聚甲醛固定30 min,结晶紫染色15 min。用棉签拭去上室上层黏附的细胞,进行拍照和计数。对于侵袭试验,首先在transwell迁移板上室铺基质胶,每孔接种1×105个细胞,侵袭48 h后进行分析,步骤同迁移实验。实验重复4次。
1.3 统计学处理
用SPSS 19.0进行统计学分析。两组间计量资料比较用t检验,计数资料比较用χ2检验;多组间比较用单因素方差分析;等级资料采用非参数检验;重复测量资料用重复测量方差分析;生存分析用Kaplan-Meier法,多因素分析用COX比例风险回归模型。P<0.05为差异有统计学意义。
2 结果
2.1 PROX1在NSCLC中的表达
免疫组织化学检测结果显示,NSCLC组织和癌旁组织中PROX1有不同程度的表达,PROX1主要分布在细胞核里,在细胞质中也有表达(图1)。癌组织中PROX1阴性、弱阳性、中等阳性、强阳性分别6例、25例、20例、35例;癌旁组织中分别48例、27例、8例、3例,癌组织中PROX1阳性表达率明显高于癌旁组织(Z=-8.021,P<0.001)。Western blot检测结果显示,与Beas-2b相比,A549、H460、H1229和H358细胞系中PROX1蛋白表达水平明显较高(P均<0.05,图2)。
2.2 PROX1与NSCLC临床病理学特征及预后的关系
PROX1高表达组淋巴结转移率和TNM分期为Ⅲ~Ⅳ期的占比明显高于低表达组(P<0.05)。
COX多因素分析结果显示,TNM分期为Ⅲ~Ⅳ期、淋巴结转移、远处转移和PROX1高表达是NSCLC患者不良生存预后的独立影响因素(P<0.05)。PROX1高表达组生存时间明显短于低表达组(P<0.001,图3,表1、2)。
2.3 下调PROX1对A549细胞增殖、迁移和侵袭的影响
与si-control组比较,si-RNA组PROX1蛋白表达水平、细胞克隆数目、培养第72和96 h时细胞增殖的D值、侵袭和迁移细胞数量明显较低(P<0.01,图4~5)。
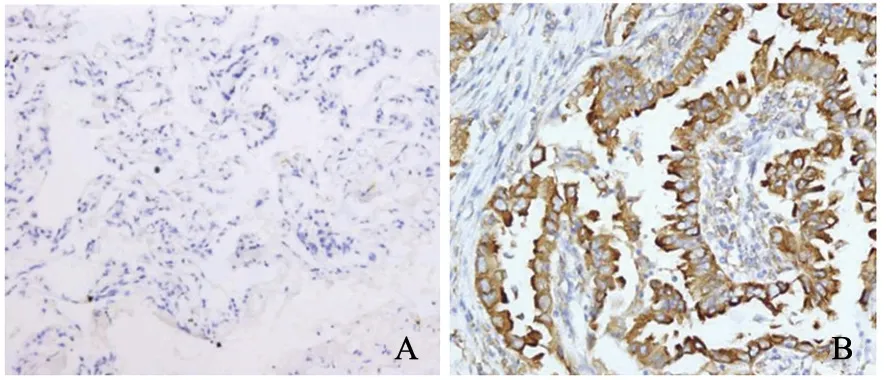
图1 免疫组织化学法检测PROX1在NSCLC组织中的表达Fig.1 PROX1 expression in NSCLC tissues detected by immunohistochemistry

图2 Western blot检测细胞中PROX1蛋白表达水平(n=4)Fig.2 Western blot detection of PROX1 protein expression in cells (n=4)
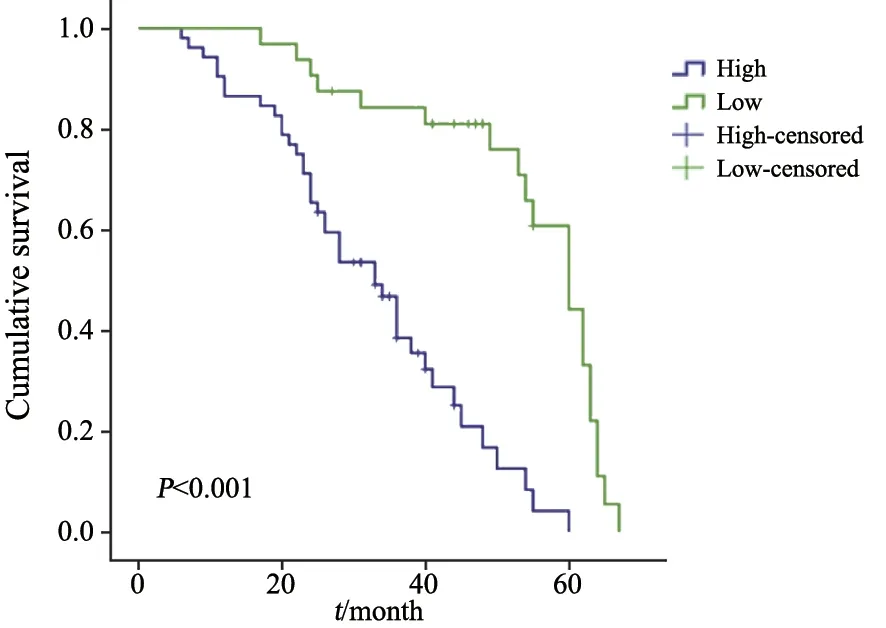
图3 PROX1高表达和低表达患者的生存时间比较Fig.3 Comparison of survival time between patients with high and low PROX1 expression

表1 PROX1与NSCLC临床病理学特征的关系Tab.1 Relationship between PROX1 and clinicopathological characteristics of NSCLC[n (%)]

表2 NSCLC患者生存时间的影响因素分析Tab.2 Analysis of factors influencing the survival time of NSCLC patients

图4 敲降PROX1对A549细胞PROX1蛋白表达水平的影响(n=4)Fig.4 The effect of knockdown PROX1 on the expression level of PROX1 protein in A549 cells (n=4)

图5 敲降PROX1对A549细胞增殖、迁移和侵袭的影响(n=4)Fig.5 Effect of knockdown PROX1 on proliferation,migration and invasion of A549 cells (n=4)
3 讨 论
肺癌是严重危害人类健康的恶性肿瘤之一,其发病机制复杂,目前尚未完全明确。本研究发现,癌组织中PROX1阳性表达率明显高于癌旁组织,并且PROX1与肿瘤细胞增殖、侵袭和迁移有关,可能成为NSCLC潜在的分子生物学标志物。
PROX1在1996年首次被分离,是果蝇的同源异形盒基因prospero在哺乳动物中的同源框基因转录因子。PROX1在乳腺癌、甲状腺癌和胶质瘤组织中高表达,并且与肿瘤发生、发展关系密切[4-6]。本研究采用免疫组织化学法检测了86例NSCLC组织中PROX1的表达,结果显示,癌组织中PROX1高表达55例(63.95%),癌旁组织高表达11例(12.79%),组间比较差异有统计学意义。另外,与人支气管上皮细胞Beas-2b相比,A549、H460、H1229和H358细胞系中PROX1蛋白表达水平明显较高。本研究还发现,敲低PROX1基因后,A549细胞增殖、迁移和侵袭明显受到抑制。说明PROX1可能作为癌基因参与NSCLC的发生。
PROX1在癌症中的作用机制尚未明了,可能为:①结合并抑制基质金属蛋白酶-14表达,进而参与肿瘤血管生成和肿瘤侵袭[10];②通过核小体重塑和去乙酰化酶复合物抑制Notch信号通路,进而抑制肿瘤细胞的增殖[11];③参与免疫炎症损伤,通过激活核因子κB促进瘤细胞增殖和侵袭;④表达于淋巴管内皮细胞,参与肿瘤淋巴管新生和肿瘤淋巴道转移[3]。
本研究结果显示,PROX1表达与淋巴结转移和肿瘤分期密切相关。在多种类型肿瘤中,淋巴管是肿瘤转移的主要途径。PROX1主要分布在淋巴管内皮细胞核里,在肿瘤组织内皮细胞中表达上调[12]。既往研究[13-14]发现,PROX1有促进内皮细胞分化和淋巴管形成的作用,可能会作为预测肿瘤淋巴道转移的关键因子。本研究86例患者中发生远处转移12例,其中PROX1高表达10例,占83.33%;未发生远处转移的74例患者中PROX1高表达45例,占60.81%,但两组比较差异无统计学意义,可能与样本量小有关。
TNM分期为Ⅲ~Ⅳ期、淋巴结转移和远处转移是NSCLC患者不良生存预后的影响因素,既往已被证实[15-17]。PROX1高表达与多种肿瘤的不良生存预后有关,如乳腺癌[18]、胃癌[19]和唾液腺样囊性癌[20]等。本研究COX多因素分析结果显示,PROX1是NSCLC患者不良生存预后的独立影响因素,PROX1高表达组生存时间明显短于低表达组。
综上所述,PROX1在NSCLC发生、发展中可能起到重要作用,敲降PROX1基因可以抑制NSCLC细胞的增殖、侵袭和迁移。PROX1与NSCLC患者淋巴结转移及肿瘤TNM分期有关,PROX1高表达可能预示患者不良生存预后。本研究也存在一些局限性,例如未分析PROX1下游分子的变化,临床样本量较小。未来需要深入探讨PROX1在NSCLC中的作用机制。
