兔源强毒力金黄色葡萄球菌双重PCR 检测方法的建立
2020-11-25王锦祥孙世坤陈岩锋陈冬金谢喜平
王锦祥,孙世坤,陈岩锋,陈冬金,桑 雷,谢喜平
(福建省农业科学院畜牧兽医研究所,福建 福州 350013)
0 引言
【研究意义】葡萄球菌病(Staphylocosis)是兔的常发病,是危害养兔业发展的重要疾病之一[1-3]。该病由金黄色葡萄球菌(Staphylococcus aureus)感染所致,临床上以脚皮炎、乳房炎和皮下脓肿为主要特征,也可见呼吸感染[2-5]。福建省是我国重要的家兔养殖区,存栏量和出栏量均居全国前列。加强福建省内兔源强毒力金黄色葡萄球菌的检测,对兔产业稳定发展具有重要意义。【前人研究进展】前期研究表明,金黄色葡萄球菌感染在福建省兔群中广泛存在,该菌在病死兔肺脏、乳房炎和脚皮炎样品中的分离率分别为19.96%、83.87%和83.33%[6]。此外,还发现福建省兔群中流行着两种毒力差异较大的金黄色葡萄球菌。强毒力菌株能引起严重的致死性呼吸道感染,而低毒力菌株则引起慢性的脚皮炎、乳房炎、皮下脓肿、肺炎或其他组织器官的脓肿。强毒力菌株感染兔后,能在兔群中快速传播,导致大量的死亡,在短期内造成严重的经济损失[4]。低毒力菌株感染兔后,在兔群中表现为慢速的点状扩散,感染兔最终以慢性消耗性的全身衰竭而死亡[2-3,7]。由此可见,实现对强毒力菌株的快速检测,对保障养兔业的发展具有重要意义。【本研究切入点】目前,针对金黄色葡萄球菌的检测方法主要有细菌分离鉴定和单重PCR[1-3,8-9],尚未见用于鉴别强毒力金黄色葡萄球菌的双重PCR 检测方法报道。【拟解决的关键问题】为了快速地对福建省兔群中强毒力金黄色葡萄球菌进行检测,本试验根据强毒力和低毒力菌株携带不同毒力基因的特点(强毒力菌株为nuc和pvl阳性;低毒力菌株为nuc阳性,pvl阴性)[4,6],针对nuc和pvl两种毒力基因的保守序列分别设计了两对特异性引物,建立了检测强毒力菌株的双重PCR 检测方法。该方法不仅能同时检测出强毒力和低毒力菌株并且还能区分强毒力和低毒力菌株,为兔葡萄球菌病的诊断提供技术支持。
1 材料与方法
1.1 材料
1.1.1 菌株 兔源金黄色葡萄球菌(Staphylococcus aureus)强毒力和低毒力菌株、多杀性巴氏杆菌(Pasteurella multocida)、支气管败血波氏杆菌(Bordetella bronchiseptica)、肺炎克雷伯菌(Klebsiella pneumonia)、大肠杆菌(Escherichia coli)由本实验室分离保存。上述分离菌均用脑心浸出液培养基培养,培养支气管败血波氏杆菌时添加1%甘油。
1.1.2 主要试剂 脑心浸出液培养基(Brain Heart Infusion,BHI)购自Oxoid 公司;2×PCR Mix、细菌基因组DNA 提取试剂盒和胶回收试剂盒购自北京全式金生物技术有限公司。
1.2 方法
1.2.1 引物设计 根据本实验室分离的兔源金黄色葡萄球菌强毒力菌株的nuc和pvl基因序列以及低毒力菌株的nuc基因序列,并结合这两种基因在NCBI基因库中的BLAST 分析结果,应用Primer Premier 5.0 软件设计了两对分别针对nuc和pvl基因保守序列的特异性引物(表1),引物由上海铂尚生物技术有限公司合成。
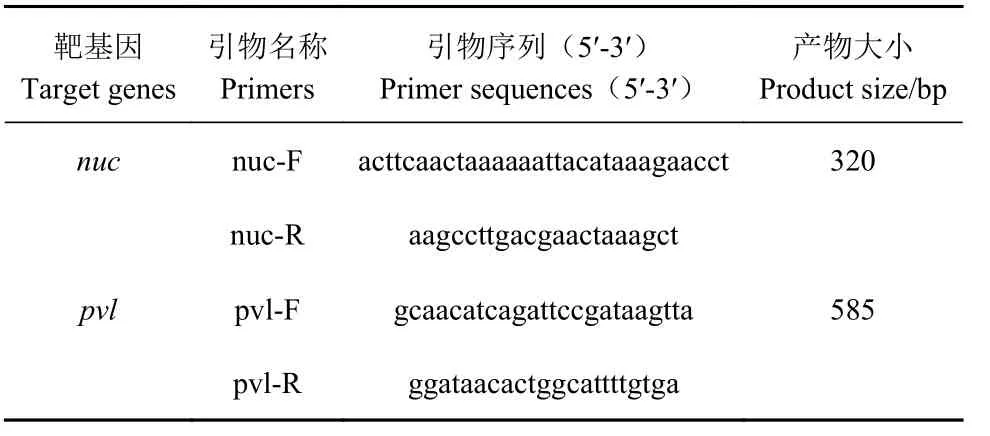
表1 双重PCR 检测方法引物Table 1 Primers for duplex PCR assay
1.2.2 单重PCR 检测方法的建立及扩增产物的鉴定 按照细菌基因组DNA 提取试剂盒说明书分别提取兔源金黄色葡萄球菌强毒力和低毒力菌株的基因组DNA。分别以强毒力和低毒力菌株的基因组DNA 为模板,利用nuc和pvl基因引物进行单重PCR 扩增。PCR 反应体系为50 μL:包含25 μL 2×PCR Mix,基因组DNA 100 ng,上下游引物各0.2 μmol·L-1。PCR反应程序:94 ℃预变性4 min;94 ℃ 30 s、58 ℃ 30 s、72 ℃ 30 s,35 个循环;72 ℃延伸5 min。PCR 产物经电泳分离后切胶回收,送上海铂尚生物技术有限公司测序。
1.2.3 双重PCR 检测方法的建立及反应条件的优化 将浓度稀 释至40 μmol·L-1的nuc和pvl基因 的上下游引物等体积混合,作为双重PCR 的引物。在步骤1.2.2 的基础上建立双重PCR 检测方法,PCR 反应体系为50 μL:包含25 μL 2×PCR Mix,强毒力菌株或低毒力菌株基因组DNA100 ng,混合引物0.4 μmol·L-1。PCR 反应程序:94 ℃预变性4 min;94 ℃30 s、58 ℃ 30 s、72 ℃ 30 s,35 个循环;72 ℃延伸5 min。在此基础上,将双重PCR 检测方法的退火温度设置为53~60 ℃,将混合引物的终浓度设置为0.2、0.3、0.4、0.5、0.6、0.7 和0.8 μmol·L-1,对 双重PCR 反应条件进行优化,确定最佳的退火温度和引物浓度。
1.2.4 双重PCR 检测方法特异性试验 按照细菌基因组DNA 提取试剂盒说明书分别提取兔源多杀性巴氏杆菌、支气管败血波氏杆菌、肺炎克雷伯菌和大肠杆菌的基因组DNA。以提取的基因组DNA 为模板,应用建立的双重PCR 检测方法分别进行扩增,并设置阴性对照,检测双重PCR 方法的特异性。
1.2.5 双重PCR 检测方法敏感性试验 分别取强毒力菌株和低毒力菌株的基因组DNA100 ng,进行连续的10 倍倍比稀释,以稀释的基因组DNA 为模板,应用建立的双重PCR 检测方法分别进行扩增,检测双重PCR 方法的敏感性。
1.2.6 双重PCR 检测方法重复性试验 取60 份已知结果的样品,平均分为3 组,每组20 份(强毒力菌株阳性样品6 份,低毒力菌株阳性样品8 份,阴性样品6 份)。应用建立的双重PCR 方法重复3 次检测上述60 份样品,根据检测结果与已知结果的符合率分别计算批内和批间变异系数,评价双重PCR 方法的重复性。
1.2.7 临床样品的检测 119 份从福州、南平、三明和龙岩4 个地区收集的呼吸道病死兔肺脏样品,用已报道的检测金黄色葡萄球菌nuc[8]和pvl[9]基因的单重PCR 方法和本试验建立的双重PCR 方法同时进行检测,统计检测结果,比较双重PCR 方法检测结果与已报道的单重PCR 方法检测结果的一致性。
2 结果与分析
2.1 单重PCR 检测方法的建立及扩增产物的鉴定
应用本试验设计的引物能特异地扩增出强毒力菌株的nuc(320 bp)和pvl(585 bp)基因片段以及低毒力菌株的nuc(320 bp)基因片段,而低毒力菌株的pvl基因片段以及阴性对照(灭菌ddH2O)的nuc和pvl基因片段的扩增结果均为阴性(图1)。测序结果表明,扩增得到的nuc和pvl基因片段的序列与对应的参考基因的同源性均为100%。
2.2 双重PCR 检测方法的建立及反应条件的优化
将强毒力菌株或低毒力菌株基因组DNA 的量固定为100 ng 进行双重PCR 扩增,结果表明混合引物浓度为0.4 μmol·L-1、退火温度为58 ℃时能分别扩增出强毒力菌株的nuc和pvl基因片段和低毒力菌株的nuc基因片段(图2)。在此基础上,进一步对反应体系中混合引物的浓度和退火温度进行优化。结果表明当混合引物的浓度为0.6~0.8 μmol·L-1(图3-A)、退火温度为57.5~60.0 ℃时(图4-A),双重PCR 对强毒力菌株的扩增效果较好;当混合引物的浓度为0.5~0.7 μmol·L-1(图3-B)、退火温度为57.5~59.6 ℃时(图4-B),双重PCR 对低毒力菌株的扩增效果好。引物会与反应体系中的Mg2+结合而抑制DNA 聚合酶的活性,而退火温度越高则特异性越强。因此,确定双重PCR 的最优反应条件为引物浓度0.6 μmol·L-1和退火温度59.6 ℃。
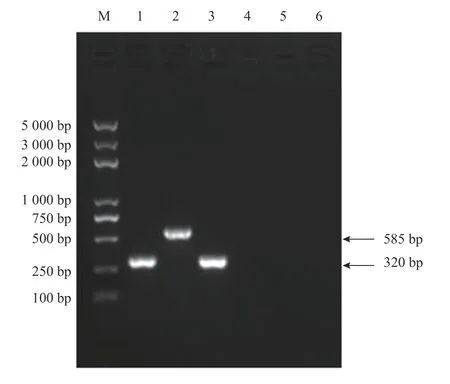
图1 单重PCR 扩增结果Fig.1 Result of single PCR amplification

图2 双重PCR 扩增结果Fig.2 Result of duplex PCR amplification
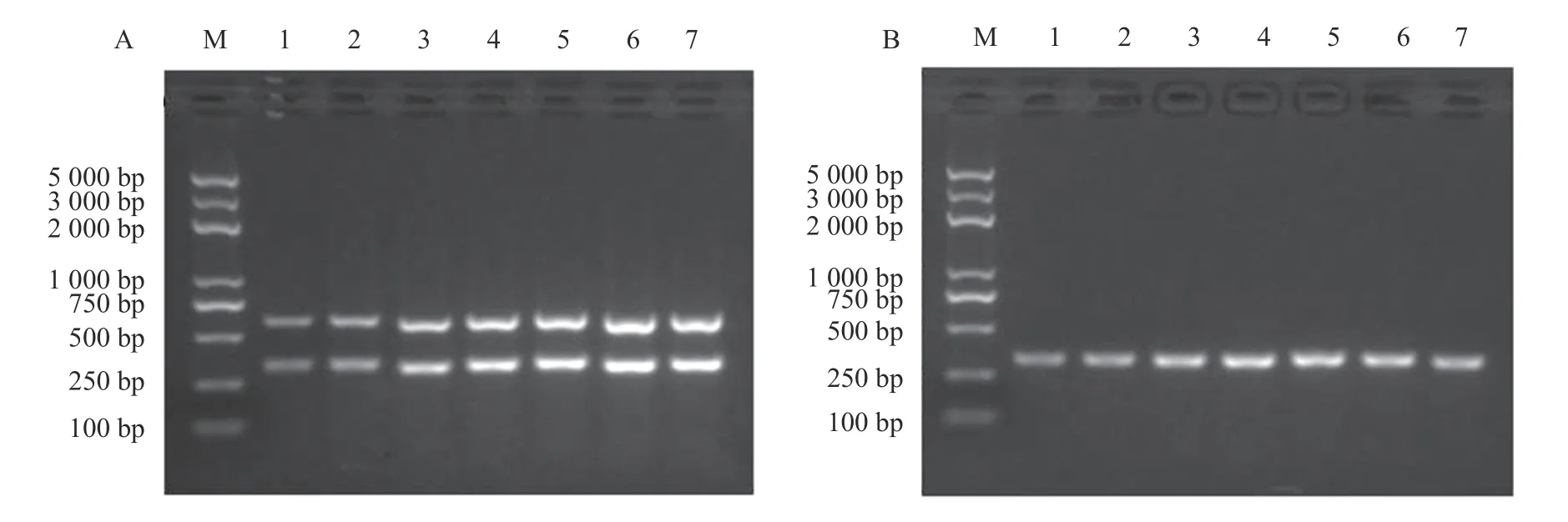
图3 双重PCR 检测方法引物浓度优化Fig.3 Optimization on primer concentration for duplex PCR assay
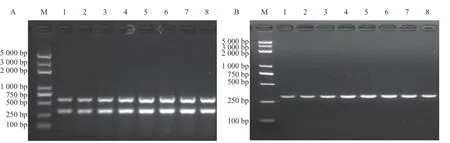
图4 双重PCR 检测方法退火温度优化Fig.4 Optimization on annealing temperature for duplex PCR assay
2.3 双重PCR 检测方法的特异性
应用建立的双重PCR 检测方法能特异地扩增出兔源金黄色葡萄球菌强毒力菌株的nuc和pvl基因片段以及低毒力菌株的nuc基因片段,而多杀性巴氏杆菌、支气管败血波氏杆菌、肺炎克雷伯菌和大肠杆菌等4 种常见兔源细菌性病原以及阴性对照(灭菌ddH2O)的结果均为阴性(图5)。结果表明,该双重PCR 检测方法具有良好的特异性。
2.4 双重PCR 检测方法敏感性
取强毒力菌株和低毒力菌株的基因组DNA 各100 ng,进行连续的10 倍倍比稀释,使双重PCR 反应体系中模板的量为1 fg~100 ng。扩增结果显示,该双重PCR 检测方法能检测到的强毒力菌株和低毒力菌株的最低模板量为分别为10 pg(图6-A)和100 fg(图6-B)基因组DNA。结果表明,该双重PCR 检测方法具有良好的敏感性。
2.5 双重PCR 检测方法重复性

图5 双重PCR 检测方法特异性Fig.5 Specificity test of duplex PCR assay
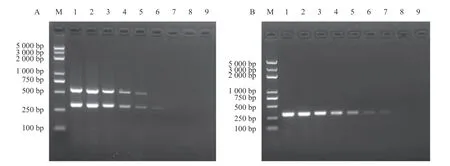
图6 双重PCR 检测方法敏感性Fig.6 Sensitivity test of duplex PCR assay
应用建立的双重PCR 方法检测3 组已知结果的样品(每组20 份,共60 份),重复3 次,结果显示,重复性试验批内和批间的变异系数均为0,表明该双重PCR 方法具有良好的重复性。
2.6 临床样品的检测
应用建立的双重PCR 方法检测检测119 份临床样品(82 份已知结果,37 份未知结果),检测出强毒力菌株阳性样品30 份、低毒力菌株阳性样品45 份和阴性样品44 份,检测结果与已报道的单重PCR 方法检测结果的符合率为100%(表2)。结果表明,该双重PCR 检测方法具有良好的准确性。

表2 临床样品的检测Table 2 Detection of clinical samples
3 讨论与结论
葡萄球菌病是危害养兔业发展的重要疾病之一。前期研究结果表明,福建省兔群中流行着两种毒力差异较大的金黄色葡萄球菌。强毒力菌株是序列型为ST121 的菌株,该菌株危害所有日龄的兔,能在兔群中快速传播,引起严重的致死性呼吸道感染[4];低毒力菌株是序列型为ST398 的菌株,该菌株主要危害成年兔,在兔群中呈慢速的点状扩散,引起慢性的化脓性感染[2-3,6]。由此可见,不同毒力菌株感染导致的临床症状的多样化给兔葡萄球菌病的诊断带来了困难。
本试验根据不同毒力金黄色葡萄球菌携带不同毒力因子的特点,选取nuc和pvl两种毒力基因作为目的基因,建立了检测兔源强毒力金黄色葡萄球菌的双重PCR 检测方法。nuc基因编码耐热核酸酶,普遍存在于金黄色葡萄球菌中,是该菌的一种特异基因[8,10]。研究表明,以nuc基因为目的基因能建立检测金黄色葡萄球菌的特异性PCR 检测方法[8-9]。pvl基因编码杀白细胞毒素,该毒素是导致坏死性肺炎的主要毒力因子,是强毒力金黄色葡萄球菌菌株的重要标志之一[9,11]。因此,选取nuc和pvl基因作为目的基因建立检测福建省兔源强毒力金黄色葡萄球菌的双重PCR 检测方法是可行的。本试验对反应条件进行优化后,建立了特异性强、敏感性高、准确性高和重复性好的双重PCR 检测方法。该检测方法能同时扩增出强毒力菌株的nuc和pvl基因片段,能扩增出低毒力菌株的nuc基因,不仅能作为兔源金黄色葡萄球菌的特异性检测方法,在强毒力或低毒力菌株单纯感染的情况下还能作为强毒力和低毒力菌株的鉴别诊断方法。此外,该双重PCR 检测方法仅需约3 h 就能检测出样品中的强毒力或低毒力菌株,与传统的细菌分离鉴定相比较,极大地提高了检测效率。该双重PCR 检测方法的建立将为兔葡萄球菌病的诊断提供有力的技术支撑。
