原发性胆汁性胆管炎患者肝组织中自然杀伤细胞活化性受体及其配体的表达及意义
2020-11-25余海燕韦进香付海艳杨依娜涂荣芳唐映梅
余海燕, 韦进香, 付海艳, 杨依娜, 涂荣芳, 唐映梅
昆明医科大学第二附属医院 消化内科, 昆明 650101
原发性胆汁性胆管炎(primary biliary cholangitis,PBC)是以进行性肝内小胆管非化脓性炎症为特征的慢性胆汁淤积性自身免疫性肝病。近年来,我国PBC的发病率显著增加[1]。但是目前PBC的病因和发病机制尚不完全清楚。
NK细胞活化性受体(NK cell activating receptor,NKG2D)为目前研究较清楚的NK细胞的活化性受体之一,MHC-Ⅰ类(MHC class Ⅰchain-related molecule,MIC)是最早被发现且研究较充分的NKG2D受体的配体。NK细胞介导的先天免疫反应可能是PBC初始阶段的关键[2]。有研究[3]表明,阻断NKG2D可降低NK细胞的细胞毒性和IFNγ的产生,阻断IL-10可增强NK细胞的细胞毒性和IFNγ的产生。IL-15可诱导先天性和适应性淋巴细胞亚群上NKG2D的表达[4]。本实验着重探讨单核细胞是否通过NKG2D/MICA及细胞因子途径参与PBC发病,为阐明PBC的发病机制及寻找新的治疗靶点提供理论基础。
1 资料与方法
1.1 研究对象 选取2014年8月-2015年6月在本院住院且确诊为PBC(PBC组,n=30)、慢性乙型肝炎(CHB组,n=15)和非酒精性脂肪性肝病(NAFLD组,n=10)患者的肝穿刺活检标本。PBC的诊断符合美国肝病学会2009年修订的PBC诊疗指南[5],CHB的诊断符合《慢性乙型肝炎防治指南(2015年版)》[6],NAFLD的诊断符合2010年修订的《非酒精性脂肪性肝病诊疗指南(2010年修订版)》[7]。排除标准:自身免疫性肝炎,原发性硬化性胆管炎,病毒性肝炎,肝豆状核病变等遗传代谢性疾病,酒精性肝病,肝、胆、脾和其他器官的占位性病变,其他引起肝脾肿大的相关疾病,严重的心肺疾病。
1.2 试剂 鼠抗人NKG2D、IL-15、IFNγ单克隆抗体、兔抗人IL-10、MICA多克隆抗体(美国GeneTex公司);HRP标记山羊抗小鼠、山羊抗兔二抗(武汉谷歌生物科技有限公司);苏木素液(武汉博士德生物工程有限公司);柠檬酸盐抗原修复液/EDTA(上海翊圣生物科技有限公司)。
1.3 结果判断 根据肝组织HE染色结果,按照我国慢性肝炎的病理学分级、分期判断肝脏标本的肝脏炎症活动度(G)和纤维化程度(S),分析各表达因子与肝内炎症的关系。肝脏炎症活动度分级和纤维化程度分期标准参见《慢性乙型肝炎防治指南(2015年版)》[6]。
采用SP法行免疫组化染色。各指标细胞浆和/或细胞核和/或细胞膜有棕黄色颗粒为阳性表达;根据染色细胞多少及染色深浅计算染色评分,判断各指标表达情况。在显微镜下随机选取5个高倍视野进行细胞计数,根据染色深浅将所有细胞分为4个等级:A不着色,0分;B浅黄色,1分;C棕黄色,2分;D棕褐色,3分。每个视野中阳性细胞A、B、C、D所占的百分数分别为a、b、c、d;细胞的染色评分按A×a+B×b+C×c+D×d计算。
1.4 伦理学审查 本研究通过昆明医科大学第二附属医院医学伦理委员会审批(批号:审-PJ-2019-38)。

2 结果
2.1 一般资料 3组患者一般资料见表1。

表1 3组患者的一般资料比较
2.2 NKG2D表达情况 CHB组与NAFLD组肝组织中NKG2D均阴性表达。PBC组:NKG2D阳性表达主要位于汇管区(50%)及中央静脉(10%)与汇管区之间(40%),且NKG2D的表达随炎症程度加重而上升,G3~4级者明显高于G1~2级者,差异有统计学意义(G1 vs G2 vs G3 vs G4:1.4±0.05 vs 1.56±0.05 vs 1.86±0.11 vs 2.60±0.17,F=150.8,P<0.05);随纤维化程度加重而下降,差异有统计学意义(S3 vs S4:2.30±0.17 vs 1.56±0.05,t=-1.52 ,P<0.05)(图1)。



注:a,CHB组;b,NAFLD组;c,PBC组。
2.3 MICA表达情况 CHB组、NAFLD组及PBC组G1~2级MICA均为阴性表达。PBC组:G3~4级MICA的阳性细胞主要位于汇管区(60%)及中央静脉与汇管区之间(40%),G3与G4级比较差异无统计学意义(0.11±0.01 vs 0.20±0.03,t=-2.20,P>0.05),S3与S4级比较差异无统计学意义(0.12±0.02 vs 0.18±0.03,t=-2.64,P>0.05)(图2)
2.4 IL-15表达情况 IL-15在NAFLD组阴性表达,在CHB组与PBC组肝内表达。PBC组:IL-15的阳性细胞主要位于汇管区(60%)及中央静脉与汇管区之间(30%),炎症程度组间比较差异有统计学意义(G1 vs G2 vs G3 vs G4:0.70±0.10 vs 1.50±0.10 vs 1.93±0.11 vs 2.60±0.17,F=251.3,P<0.05),纤维化程度组间比较差异无统计学意义(S3 vs S4:2.00±0.05 vs 2.40±0.30,t=-1.62,P>0.05)。CHB组IL-15的表达:炎症程度组间比较差异有统计学意义(G1 vs G2 vs G3:0.73±0.15 vs 1.96±0.15 vs 2.50±0.17,F=150,P<0.05),纤维化程度组间比较差异有统计学意义(S1 vs S2 vs S3:0.70±0.10 vs 21.96±0.15 vs 2.50±0.17,F=158.7,P<0.05)(图3)。
2.5 IL-10表达情况 NAFLD组、CHB组G3~4级及PBC组G2~4级IL-10均阴性表达。PBC组:IL-10的阳性细胞主要位于汇管区(60%)及中央静脉与汇管区之间(20%),且仅G1期表达(0.16±0.01)。CHB组G1、G2级均表达IL-10,炎症程度组间比较差异无统计学意义(G1 vs G2:0.19±0.01 vs 0.13±0.01,t=-1.522,P>0.05)(图4)。
2.6 IFNγ表达情况 3组IFNγ均为阴性表达(图5)。
2.7 PBC组IL-15、IL-10、IFNγ表达与肝功能的相关性分析 PBC患者肝组织IL-15的表达与ALP、GGT水平均呈正相关(r值分别为0.241、0.407,P值分别为0.014、0.045)(图6)。



注:a,CHB组;b,NAFLD组;c,PBC组。


注:a,CHB组;b,NAFLD组;c,PBC组。


注:a,CHB组;b,NAFLD组;c,PBC组。
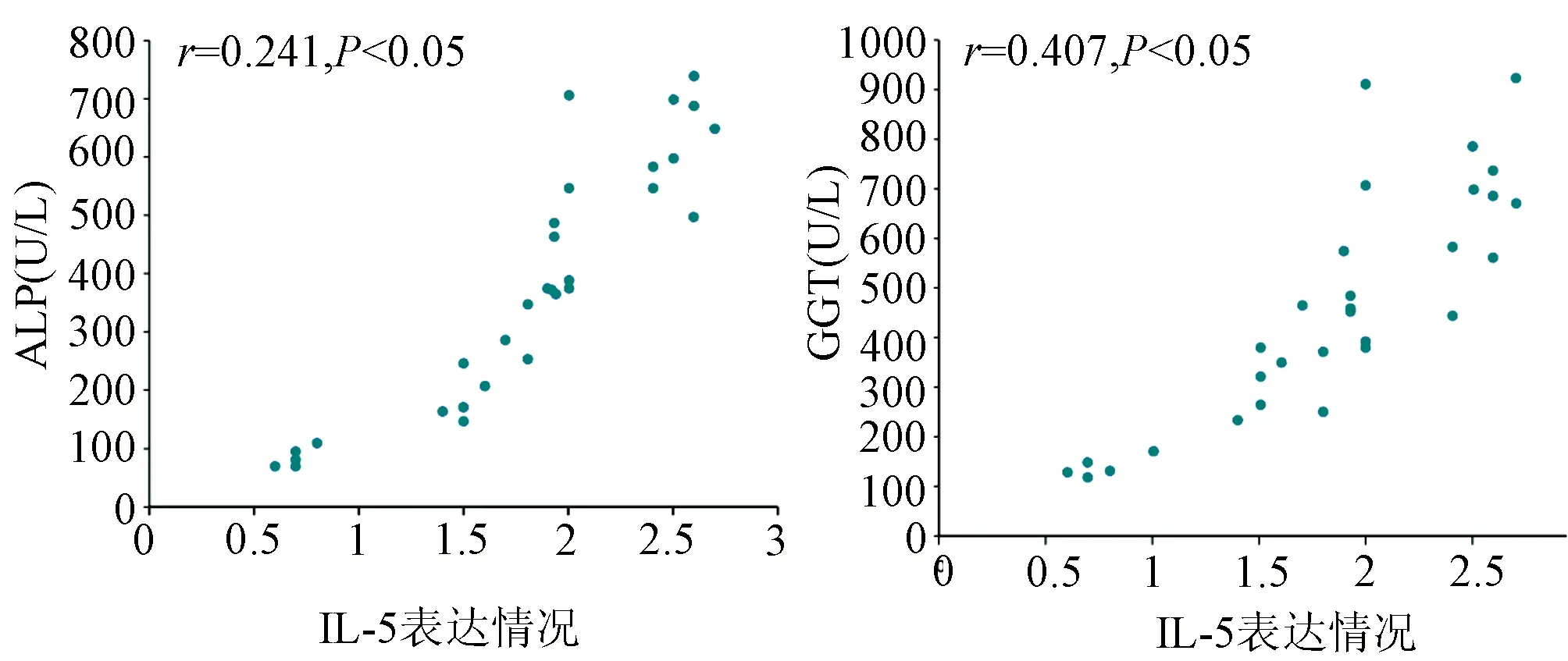
图6 PBC患者IL-15表达与ALP、GGT相关性
3 讨论
近年来,天然免疫在PBC发病中的作用日益受到重视[8]。NK细胞介导的先天免疫反应在PBC的早期阶段至关重要[9]。前期研究[10]也发现,PBC患者肝内NK细胞功能增强,提示NK细胞上游存在调节机制,但目前PBC时NK细胞如何被激活的机制仍不清楚,需进一步探究。
NKG2D是NK细胞特异性基因家族中的一个基因编码,可与MICA结合,且主要表达在有免疫活性的细胞上(如NK细胞、CD8+T淋巴细胞及CD4+T淋巴细胞表面),可为NK细胞同时提供完全激活信号和协同刺激信号,通过增强杀伤作用,参与天然免疫和适应性免疫的调节。
本实验中NKG2D主要表达于PBC肝脏汇管区,与PBC非化脓性小胆管炎症及破坏、胆管增生的病理特征一致。PBC患者肝组织中高表达NKG2D,且随着炎症程度加重而上升,随纤维化程度加重而下降,提示NKG2D可能参与了PBC的早期发病,而PBC晚期NK细胞活性则受到抑制。前期研究[11]亦表明,PBC患者外周血NK细胞比例低于正常对照组,以CD56+NK亚群为主,由于CD56+NK细胞产生细胞因子,介导免疫调节作用,提示NK细胞可能主要以免疫调节参与PBC的发病。
MICA在表达异常时被NKG2D识别并结合,启动NK细胞介导的免疫应答。在自身免疫性疾病中,异常表达的MICA分子,可能导致NK细胞异常活化从而引发自身免疫反应[12]。
本研究发现PBC患者肝组织MICA表达明显升髙,且随着炎症及纤维化程度的加重呈上升趋势,提示PBC患者MICA异常表达,巨噬细胞处于“应激”状态,参与免疫反应。PBC患者肝组织中MICA的表达升高,NKG2D表达亦升高。因此,单核细胞与NK细胞之间可能通过NKG2D/MICA途径参与PBC的发生发展。此外,MICA的表达较NKG2D的表达减少,可能是细胞上的抑制性受体与单核细胞上一部分MICA结合干扰所致,或是持续上调的NKG2D负反馈调节MICA,这提示可能还有其他因素影响NKG2D的活化。
外源性HBsAg刺激了CHB患者NK细胞NKG2D表达[13]。本研究中CHB组NKG2D、MICA均为阴性表达,可能是因为纳入的慢性乙型肝炎患者均治疗过,且慢性乙型肝炎免疫激活期患者NK细胞活化受体NKG2D的表达、IFNγ和TNFα的产生分别低于免疫耐受期[14]。
IL-15能诱导NK细胞、T淋巴细胞增殖及细胞因子的产生,同时还能增强树突状细胞和巨噬细胞的存活,促进强烈的免疫应答。本研究发现IL-15在PBC患者肝脏中表达,随炎症程度加重呈上升趋势。其次,IL-15的表达与血清GGT和ALP的表达呈显著正相关。有研究[15]表明,IL-15激动剂可使CD8+T淋巴细胞的细胞内IFNγ和TNFα分泌增加,并上调CD8+T淋巴细胞上NKG2D的表达。
肝内单核巨噬细胞被HBV抗原活化导致IL-15大量释放,而增高的IL-15反过来刺激细胞毒性T淋巴细胞、NK细胞等免疫活性细胞分泌炎性细胞因子,其通过介导细胞毒性作用直接参与自身免疫病理过程[16]。本实验结果中CHB组IL-15高表达,且随着炎症程度和纤维化程度的加重呈上升趋势。有研究[17]表明,抗病毒药物替比夫定可通过上调IL-15和NKG2D来恢复CD56 NK细胞的功能。因此,提示IL-15可能参与PBC的发生发展,且在胆管上皮细胞的损伤中具有一定作用,但IL-15在PBC中的具体作用及机制需进一步研究探索。
NK细胞表达IL-10和IL-10受体,单独的IL-10对NK细胞毒性具有显著影响,在IL-15存在下,其可增加NK细胞的细胞毒性[18]。其次,IL-10作为一种免疫抑制和抗炎细胞因子,内源性IL-10在维持免疫耐受中起关键作用,外源性IL-10会加剧肝脏炎症和纤维化[19]。本研究发现IL-10在PBC组、CHB组表达,提示IL-10可能在肝内炎症及纤维化发生的进程中发挥一定作用,但具体机制需进一步研究。
PBC患者中由NK细胞合成的IFNγ、IL-6和IL-8的水平显著降低,且NK细胞频率的降低和NKG2A的增加可能通过IFNγ分泌减少而导致细胞毒活性降低,有助于恢复NK细胞相关免疫力[20-21]。IFNγ的缺失降低了肝脏中炎性巨噬细胞的频率,并减轻了肝纤维化[22]。而NK细胞上IL-15受体的上调可能促进IFNγ的产生[23]。本研究3组中IFNγ均阴性表达,PBC患者高表达的NKG2D、IL-15可能通过负反馈调节导致IFNγ表达减少,但需进一步深入研究。
本实验结果中PBC肝内表达NKG2D,同时在晚期表达MICA,提示可能通过NKG2D/MICA促进NK细胞的活化,并介导细胞间相互作用,调节肝内炎症反应的程度,进而引起胆管上皮的损伤,从而参与PBC的发生发展。其相关细胞因子分泌异常在PBC的发生发展中发挥一定作用,但细胞因子之间的相互调节作用需要进一步深入探究。因此,NKG2D/MICA信号转导活化通路可能是PBC治疗的一个靶点,而IL-15可能作为一个辅助诊断PBC的指标。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突,特此声明。
作者贡献声明:余海燕、杨依娜参与撰写论文,修改论文,资料分析;韦进香收集数据,研究过程及数据分析;付海艳指导撰写文章,负责拟定写作思路;涂荣芳参与资料分析;唐映梅负责课题设计,最后定稿。
