大气增温对杉木幼树叶片及细根生理特征的影响
2020-11-24叶旺敏熊德成杨智杰张秋芳刘小飞高艳丽杨玉盛
叶旺敏,熊德成,*,杨智杰,张秋芳,刘小飞,高艳丽,胥 超,杨玉盛
1 福建师范大学地理科学学院, 福州 350007 2 湿润亚热带山地生态国家重点实验室培育基地, 福州 350007
自工业革命以来,由于CO2等温室气体的大量排放,导致全球气候变暖日渐加剧。据IPCC第五次报告指出,预计到21世纪末,全球大气温度可能升高0.3—4.8 ℃[1]。森林是地球陆地生态系统的重要组分,具有较高的生物生产力和生物多样性[2],研究森林生态系统对全球气候变暖响应模式已成为当代生态学研究的热点问题之一。
以往研究结果显示,由于高纬度及高寒地区植物所处环境温度普遍低于最适生长温度值,适当增温可以增加其净光合速率,加快物候生长节律并延长生长季,以促进植物地上地下生物量的积累[3- 4]。而就亚热带地区而言,由于本身温度较高,该地区森林所处的环境温度可能已接近阈值,在未来全球变暖的趋势下,可能对亚热带植物的生长及生理学特性造成剧烈影响,进而影响森林生产力[5- 6],但有关亚热带森林对气候变暖的响应报道仍十分有限。
抗氧化特征和渗透调节是植物对外界环境适应的综合体现。正常环境下,植物细胞进行有氧代谢生成的活性氧类物质与抗氧化防御机制(酶促抗氧化剂和非酶促抗氧化剂)对其的清除能力处在氧化还原的动态平衡[7]。但当外界环境胁迫程度超过植物抗氧化防御系统清除能力,便会引起活性氧的大量积累,导致植物细胞脂质、蛋白质、核酸、光合色素及酶的氧化损伤,影响植物正常代谢功能[8- 9]。目前,关于植物在温度升高下生理响应和适应策略的研究已有很多,但多数研究都局限于植物单个器官或组织上。植物不同器官组织结构不同,所处的微环境亦有所差异,因此,对逆境响应机制可能不同,甚至相反。例如:Roessner等[10]研究发现,大麦(Hordeumvulgare)同一品种不同器官间生理代谢差异大于品种间差异。Skliros等[11]认为,植物不同器官能够合成各种特异代谢化合物,它们之间相互协作,共同抵御外界环境胁迫。白羽扇豆(Lupinusalbus)茎对其耐旱策略的贡献最大[12],而细根则是杠柳(Periplocasepium)适应干旱环境的重要器官[13]。由此可见,仅对植物单一器官进行研究,很难全面地揭示植物适应高温环境的策略,有必要对高温条件下植物体不同器官同时进行研究,以更好地理解植物适应增温的机制和策略。
杉木(Cunninghamialanceolata)作为亚热带地区主要造林树种之一,广泛分布于我国南方16个省区,面积占世界人工林面积的6%,我国人工林面积的19%、蓄积量的25%,在我国人工林生产中占有重要地位[14]。为此,本文以杉木为研究对象,通过在福建三明森林生态系统与全球变化研究站——陈大观测点内开展开顶式(OTC)模拟增温实验,以探究增温对杉木地上部分(叶片)和地下部分(细根)的渗透调节物质、保护酶活性及丙二醛含量的影响,以深入认识亚热带经济树种生理代谢特征对未来全球变暖的响应。
1 材料与方法
1.1 样地基本概况
本试验地点位于福建三明森林生态系统与全球变化研究站—陈大观测点(26.19°N,117.36°E),该地区平均海拔300 m,年均气温19.1 ℃,年均降水量1749 mm,年均蒸发量1580 mm,相对湿度81%,属中亚热带季风气候,土壤为黑云母花岗岩发育的红壤。
1.2 研究方法
实验设置增温(W)和对照(CT)两种处理,每种处理共6个重复,共计12个小区。每个小区面积2.5 m×2.5 m,深0.5 m。小区内土壤均取自观测站附近杉木人工林 (0—40 cm),填土过程主要是将取回的土壤去除根系和沙石,充分混合均匀后分别填入各小区内,以此尽可能的消除土壤的异质性。
增温处理采用开顶式(OTC)大气增温,于2014年10月份在各个实验小区周边建立增温室,增温室采用不锈钢管架设而成,顶部半敞开,底部面积16 m2,顶部露天面积约10 m2,高度4.8 m,框架搭建完成后采用进口塑料薄膜覆盖,依次相连建立6个大气增温室。于各个实验小区地表下10 cm处布设一个土壤温、湿度传感器用以监测土壤温度及水分变化,大气温度监测主要采用大气温度记录仪(MicroLite5032P-RH),降雨量采用气象站监测数据。于2015年1月,将5棵一年生三代杉木幼苗种植于各小区,用号码牌标记各个树苗,并每半个月对杉木树高、地径、冠幅等指标进行观测。
于2016年11月,在对照(CT)和OTC增温(W),选取杉木幼树健康且向阳叶片进行随机采集,阳生叶片取样主要参照等Huang等[15]的方法。细根取样采用土芯法,于每个实验小区各取6个土钻,土钻直径3.5 cm,取样深度为10 cm,尽量保证在小区中心和边缘均有取样点以做到随机取样,将所取叶片和细根用液氮保存并迅速带回实验室进行测定。

表1 不同处理杉木初始生长特征参数
1.3 测定项目与方法
1.3.1叶片和细根活性氧类物质的测定
超氧阴离子自由基的测定采用羟氨氧化法,利用紫外分光光度计于550 nm下测定吸光度,具体操作参照柯德森等[16]。过氧化氢含量的测定参照Prochazkova等[17]方法,
1.3.2叶片和细根抗氧化酶的测定
超氧化物歧化酶活性的测定采用黄嘌呤氧化酶法,每毫克蛋白抑制1mL反应液的50%时对应的SOD量作为1个酶活性单位(U),具体操作参照Giannopolitis和Ries[18]方法。过氧化物酶活性采用愈创木酚法测定,于波长420nm处测定吸光值,具体操作参照Kochhar等[19]方法。过氧化氢酶活性参照Trevor等[20]方法进行测定。抗坏血酸含量和抗坏血酸过氧化物酶活性采用2,4-二硝基苯肼法,具体操作参照Nakano和Asada[21]方法。
1.3.3叶片和细根丙二醛、渗透调节物质含量的测定
丙二醛含量采用硫代巴比妥酸(TBA)法测定, 根据532 nm下的吸光值减去600 nm下最小吸光值从而计算丙二醛含量[22]。可溶性蛋白浓度采用考马斯亮蓝法进行测定[23]。脯氨酸(Pro)含量的测定:采用酸性茚三酮显色法,具体操作参照Walter和Lindsley[24]方法。
1.4 数据分析
利用Excel 2013对所有数据进行处理计算,使用统计软件SPSS 20.0中单因素方差分析,对增温和对照处理中杉木叶片和细根活性氧类物质、抗氧化酶活性以及渗透调节物质进行显著性分析,并比较同种处理叶片和细根生理的特征差异,显著性水平设定为P=0.05。采用Origin 9.0完成制图。
2 结果与方法
2.1 空气温度及土壤温湿度
由图1可以看出,OTC处理使大气温度(4—11月)平均增加1.12℃,土壤温度平均增加0.26℃,土壤含水量相对比例降低为12.10%。

图1 大气温度,土壤温度及土壤水分变化Fig.1 Air temperature, soil temperature and moistureCT:对照Control;W:增温处理 Warming treatment
2.2 增温对杉木幼树生长特征的影响
增温对杉木生长特征均无显著影响(图2)。对照处理中杉木幼树树高和地径分别为297.3 cm、54.7 mm;增温处理中杉木幼树树高和地径分别为处理分别为310.9 cm、51 mm。
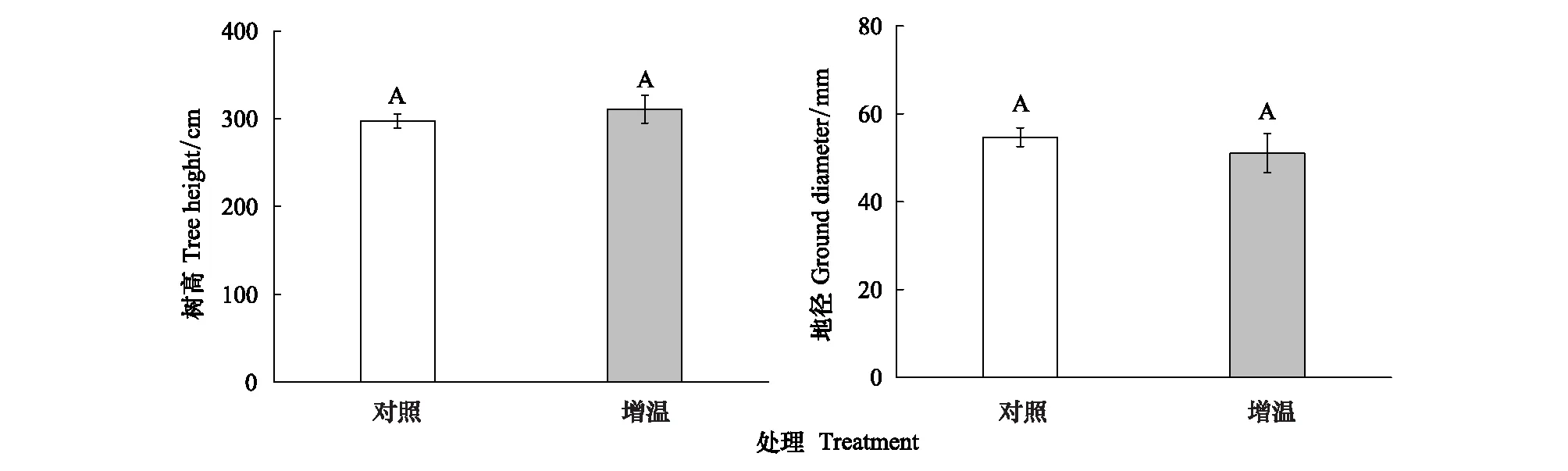
图2 增温和对照处理杉木生长特征Fig.2 The growth characteristic of Cunninghamia lanceolate误差线上的不同大写字母表示两种处理杉木树高和地径差异显著(P<0.05)
2.3 增温对杉木幼树叶片和细根活性氧类物质的影响
活性氧类物质是植物进行有氧代谢的必然产物,包括超氧阴离子自由基、羟自由基和过氧化氢等,具有超强的氧化能力。由图3可以看出,增温处理均未对杉木叶片、细根超氧阴离子自由基和过氧化氢浓度产生显著影响(P>0.05)。另外,无论增温还是对照处理下,杉木幼树叶片超氧阴离子自由基和过氧化氢浓度均显著高于细根(P<0.05)。
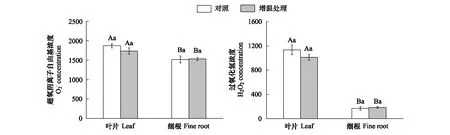
图3 增温对杉木幼树叶片、细根活性氧类物质的影响Fig.3 Effects of warming on leaves and fine root active oxygenic species of Cunninghamia lanceolata saplings误差线上的不同大写字母表示同种处理杉木叶片和细根差异显著(P<0.05);误差线上不同小写字母表示杉木叶片和细根在不同处理差异显著(P<0.05)
2.4 增温对杉木幼树叶片和细根抗氧化酶活性的影响
超氧化物歧化酶、过氧化氢酶、过氧化物酶、抗坏血酸过氧化物酶是植物体内重要的4种保护酶,抗坏血酸则能直接清除植物体内活性氧。由图4可知,增温较对照相比,杉木叶片过氧化氢酶、抗坏血酸过氧化物酶活性和抗坏血酸含量分别提高了13.9%(P>0.05)、9.2%(P>0.05)和4.2%(P>0.05),过氧化物酶显著提高42.4%(P<0.05),但超氧化物歧化酶活性相比于对照则降低9.2%(P>0.05);细根超氧化物歧化酶和抗坏血酸过氧化物歧化酶活性较对照均有增加的趋势,分别增加9.2%(P>0.05)和8.9%(P>0.05),增温后杉木细根过氧化氢酶和过氧化物酶活性分别降低了20.7%(P>0.05)和15.3(P>0.05),细根抗坏血酸含量无显著差异(P>0.05)。同种处理下,杉木细根抗坏血酸过氧化物酶活性和抗坏血酸含量均高于叶片(P>0.05),过氧化氢酶显著高于叶片(P<0.05),细根过氧化物酶活性则显著低于叶片(P<0.05),另外,对照处理中,杉木叶片和细根超氧化物歧化酶活性无显著差异。增温后,细根超氧化物歧化酶活性显著大于叶片(P<0.05)。

图4 增温对杉木幼树叶片、细根抗氧化酶活性的影响Fig.4 Effects of warming on antioxidant enzyme activities in leaves and fine roots of Cunninghamia lanceolata saplings
2.5 增温对杉木幼树叶片、细根渗透调节物质及丙二醛含量的影响
可溶性蛋白和脯氨酸含量是植物体内重要的两种渗透调节物质,由图5看出,增温后杉木叶片可溶性蛋白和脯氨酸含量均降低,分别降低5.5%(P>0.05)和10.3%(P>0.05),细根可溶性蛋白和脯氨酸含量则分别增加了9.2%(P>0.05)和9.2%(P>0.05);增温和对照处理下杉木叶片可溶性蛋白和脯氨酸均显著高于叶片;本研究中,增温显著增加杉木叶片和细根丙二醛含量(P<0.05),其中叶片提高了19.7%,细根提高25.5%(P<0.05);增温和对照处理下杉木叶片丙二醛含量显著高于细根(P<0.05),说明杉木叶片氧化损伤程度高于细根。

图5 增温对杉木幼树叶片、细根渗透调节物质和丙二醛含量的影响Fig.5 Effects of warming on leaf and fine roots osmotic adjustment substance substances and malondialdehyde content in Cunninghamia lanceolata saplings
3 讨论
3.1 增温对杉木叶片、细根活性氧代谢和丙二醛含量的影响
植物进行有氧代谢时体内通常会积累大量活性氧类物质,该类物质会引起植物细胞膜酯和蛋白的氧化损伤,破坏植物细胞膜的结构及功能的稳定性[25- 26]。丙二醛是植物细胞膜脂过氧化作用的最终产物,用以表征细胞膜受损程度以及植物抗逆性强弱[27]。本研究发现,增温处理并未导致杉木叶片和细根超氧阴离子自由基和过氧化氢浓度发生显著变化(图3),但杉木叶片和细根丙二醛含量均显著增加(图5)。可能原因在于夏季高温胁迫降低了杉木叶片光合能力,使蛋白质合成受限及抗氧化酶活性降低,加剧叶片氧化损伤,进而影响光合碳向地下部分输送过程,导致可供杉木细根代谢生长的能源物质降低,亦使细根膜脂过氧化加剧。而至11月份,高温胁迫程度降低,杉木可以通过自身物质合成以及诱导激活抗氧化防御系统,使体内活性氧类物质维持在原有水平。本研究还发现无论增温还是对照处理下,杉木叶片超氧阴离子自由基和过氧化氢浓度均显著高于细根(图3),且叶片丙二醛含量亦显著高于细根(图5),这与肖群英等[28]和周瑞莲等[29]研究结果相似。可见,杉木叶片氧化损伤程度高于细根。在光照辐射下,杉木叶片光合和呼吸强度较高产生的活性氧类物质较多是导致其丙二醛含量显著高于细根的主要原因。同时也表明细根是杉木适应高温环境的重要器官,器官间的生理整合作用与协调使其能有效地适应的高温环境。
3.2 增温对杉木叶片、细根渗透调节物质的影响
渗透调节被认为是植物对逆境胁迫的一种重要生理适应策略[30],可溶性蛋白和脯氨酸是植物体内主要渗透调节物质。在遭受高温胁迫时,植物体内通常积累较多的脯氨酸和可溶性蛋白,以平衡细胞渗透势,维持细胞正常膨压,从而适应外界条件的变化[31- 32]。本研究中,增温较对照相比,杉木细根脯氨酸和可溶性蛋白均有所提高(图5),这可能是由于增温引起土壤含水量降低,杉木细根通过合成较多的脯氨酸和可溶性蛋白,来维持正常的渗透调节功能[33]。另外,增温对杉木叶片脯氨酸和可溶性蛋白的积累却存在一定的抑制作用(图5),一方面可能因为叶片直接与空气接触,大气增温引起的叶温增幅较大,使其蛋白水解酶活性增加。另一方面则可能是由于杉木叶片在经历过夏季高温胁迫后,叶片体内碳水化合物的供应受阻,影响了谷氨酸的合成,进一步抑制脯氨酸的积累[34]。另外,本研究发现,无论增温还是对照下,杉木叶片可溶性蛋白和脯氨酸含量均显著高于细根(图5),可见杉木叶片渗透调节能力高于细根。
3.3 增温对杉木叶片、细根抗氧化酶活性的影响
植物体内抗氧化系统由酶促和非酶促抗氧化剂共同组成[35]。超氧化物歧化酶通常被认为是植物抗氧化系统的第一道防线,超氧阴离子先由超氧化物歧化酶歧化为过氧化氢和氧气,再由过氧化氢酶、过氧化物酶及抗坏血酸过氧化物酶等联合作用将过氧化氢转化为水和氧气,另外抗坏血酸则能直接清除植物体内活性氧[36]。吴永波和叶波[37]发现构树幼苗在高温胁迫下,叶片超氧化物歧化酶、过氧化物酶及过氧化氢酶活性均显著提高,但过度高温胁迫则破坏抗氧化酶活性,抑制酶表达。郭盈添[38]等亦发现金露梅幼苗叶片能通过增强过氧化物酶、过氧化氢酶和抗坏血酸过氧化物酶活性以清除因高温胁迫积累的活性氧类物质,但随高温胁迫时间延长,各项抗氧化酶活性呈下降趋势。本研究中,增温后杉木叶片过氧化物酶活性显著提高(图4),叶片过氧化氢酶、抗坏血酸过氧化物酶活性和抗坏血酸含量(图4)也均有不同程度的增加趋势,超氧化物歧化酶活性则略微降低(图4),表明植物叶片不同种类抗氧化酶活性对温度的敏感性存在差异。增温后杉木叶片过氧化物酶活性显著提高是导致叶片活性氧类物质无显著变化的主导因素。细根是植物吸收养分和水分的主要器官,也是植物根系中最敏感的部分[39]。本研究中,增温后杉木细根超氧化物歧化酶和抗坏血酸过氧化物酶活性和抗坏血酸含量均有增加趋势(图4),过氧化氢酶和过氧化物酶活性则降低(图4),但总体而言变化并不显著。这可能是由于地上增温方式并未对根区环境造成明显影响,这与李伟成等[40]模拟高温对髯毛箬竹根系保护酶系统的研究结果一致。增温后杉木细根超氧化物歧化酶和抗坏血酸过氧化物酶活性提高,与较高的脯氨酸含量共同作用,增加了细根抗氧化能力,使细根活性氧物质维持在原有水平。由此可见,杉木叶片和细根清除活性氧自由基的方式存在一定差异,这可能是由于叶片和细根功能和代谢不同所致。另外,本研究中,无论增温还是对照处理,杉木细根过氧化氢酶、抗坏血酸过氧化物酶活性和抗坏血酸含量均高于叶片,其中过氧化氢酶达显著水平(图4),仅过氧化物酶显著低于叶片(图4)。由此可推断,杉木细根活性氧和丙二醛含量显著低于叶片的原因可能在于较叶片相比细根超氧化物歧化酶和过氧化氢酶显著高于叶片,亦说明了细根在抗氧化能力可能更优于叶片。
温度几乎影响植物所有的代谢过程,植物对增温的响应是植物各器官之间通过代谢和信号事件进行复杂的互动交流的结果[41]。若只考虑叶片在增温后的表现,显然无法深入解释杉木整体生理代谢过程对未来全球变暖的响应机制。对杉木地上(叶片)和地下部分(细根)同时进行研究,可以更好的揭示杉木适应增温的机制和策略。在增温条件下,杉木细根灵活高效地调节保护酶系统的能力,是杉木适应高温环境的重要的生理生态机制,这与Dichio等[42]研究结果类似。
4 结论
综上所述,研究发现增温后杉木叶片和细根丙二醛含量显著升高,但二者活性氧物质均无显著变化,这可能是由于夏季高温胁迫加剧杉木叶片和细根的氧化损伤,而随着高温胁迫程度降低,杉木叶片和细根可以通过诱导激活自身的抗氧化系统以及增强其渗透调节能力使其活性氧物质维持在稳定水平。另外,本研究还发现,无论增温还是对照处理下,杉木叶片活性氧类物质均显著高于细根,即叶片氧化损伤高于细根,可能归因于细根超氧化物歧化酶和过氧化氢酶活性显著高于叶片。虽然在本文中,增温后杉木可以通过自身物质合成和诱导较高的抗氧化酶活性来平衡体内活性氧含量,但夏季增温引起的极端高温环境可能对杉木产生氧化损伤。因此,今后的研究还应重点关注增温对不同季节杉木活性氧代谢及抗氧化系统的影响。
