超高效液相色谱–串联质谱法同时测定蔬菜中12 种杀菌剂
2020-11-24李颜岩于浩洋冯静陈曦刘顺鑫
李颜岩,于浩洋,冯静,陈曦,刘顺鑫
(辽宁省疾病预防控制中心,沈阳 110005)
杀菌剂是一类用来防治由病原微生物引起的植物病害的农药,因其投入低,回报高,作用迅速,效果明显,被广泛应用于蔬菜生产过程中的病害防治[1]。蔬菜作为仅次于粮食的第二大农产品,是人们日常生活中必不可少的食物之一。我国《食品安全国家标准 食品中农药最大残留限量》(GB 2763–2019)[2]对蔬菜中杀菌剂的限值作出了相应规定。由于蔬菜生产周期和货架期均较短,如果在生产过程中没有按照相关规定控制杀菌剂的使用频次、浓度和安全间隔期,容易造成蔬菜中杀菌剂残留超标,进而危害人们身体健康[3]。我国种植的蔬菜品种多,病害和杀菌剂种类也繁多,为了扩大防治范围、减缓抗药性、节省喷药次数,经常将几种杀菌剂混合在一起使用[4],因此建立快速、准确,可同时测定多种杀菌剂的方法十分必要。
目前检测杀菌剂常用的方法有气相色谱法[5–6]、气相色谱–串联质谱法[7–10]、液相色谱法[11–13]和液相色谱–串联质谱法[14]。气相色谱法和液相色谱法通过保留时间定性,相比质谱法定性能力有限,同时检测多种杀菌剂时,难以获得较好的分离效果。近年来随着高效、低毒、低残留杀菌剂品种不断涌现和越来越多非挥发性农药的研发,一些难挥发、热稳定性差的杀菌剂不适合采用气相色谱–串联质谱法检测,而液相色谱–串联质谱法多通道检测功能不需要分析物之间实现完全色谱分离,一次性检测多种化合物而不被干扰,可以缩短分析时间,且灵敏度较气相色谱–串联质谱法高。样品前处理是检测过程中耗时最长、工作量最大的部分,样品前处理质量的好坏直接影响分析结果的准确性和精密度。目前常用的样品前处理方法主要有衍生法、液–液萃取法、固相萃取法等。衍生法对衍生反应条件、人员操作熟练度要求严格;液–液萃取法和固相萃取法需要用大量的有机溶剂反复提取、定容,操作时间长,试剂用量大,检测成本高,且容易造成待测物损失,影响检测结果准确度。基于QuEChERS 原则的样品处理技术操作简便,对实验人员熟练度要求不高,试剂用量相对较少,分析范围广,速度快,准确度高,近年来受到人们的广泛关注,其应用范围不断扩大。然而用该方法处理蔬菜样品,采用超高效液相色谱–串联质谱同时测定蔬菜中12 种常见杀菌剂的方法还没见报道。笔者以乙腈为提取液对蔬菜样品进行萃取,上清液经QuEChERS 分散固相萃取试剂盒净化,建立了超高效液相色谱–串联质谱法同时测定蔬菜中12 种常见杀菌剂残留的检测方法。该方法试剂用量少,分析速度快,具有较高的准确度和灵敏度,可以为蔬菜中杀菌剂残留风险评估提供科学、可靠的检测数据。
1 实验部分
1.1 主要仪器与试剂
超高效液相色谱仪–串联质谱仪:Acquity Xevo TQ 型,美国沃特斯公司;
电子天平:BS 110S 型,感量为0.1 mg,德国赛多利斯公司;
超纯水系统:MILLI–Q Gradient 型,法国默克密理博公司;
涡旋振荡器:Lab Dancer 型,德国艾卡公司;
台式高速冷冻离心机:ST16R 型,美国赛默飞世尔科技公司;
高速离心机:TGL–16A 型,上海安亭科学仪器厂;
QuEChERS 分 散 固 相 萃 取 试 剂 盒:5982–0028CH 型,规格为2 mL,内含PSA 50 mg,C1850 mg,GCB 7.5 mg,MgSO4150 mg,美国安捷伦科技公司;
Pall-4544 PVDF 膜Acrodisc 针式滤器:孔径为0.2 μm,直径为13 mm,美国颇尔公司;
乙腈、甲醇:色谱纯,美国费希尔公司;
甲酸:色谱纯,美国福禄克公司;
乙酸铵:色谱纯,德国CNW 公司;
蔬菜样品:市购;
多菌灵、三唑酮、烯酰吗啉、腐霉利、吡唑醚菌酯、恶霜灵标准品:纯度均大于97%,德国Dr.Ehrenstorfer 有限公司;
腈菌唑标准品:纯度为99.6%,德国西格玛奥德里奇公司;
实验用水为超纯水;
5 种杀菌剂标准溶液:基本信息见表1。
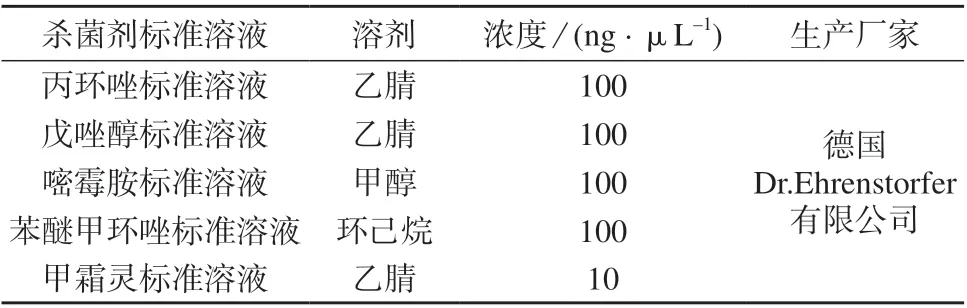
表1 5 种杀菌剂标准溶液基本信息
1.2 仪器工作条件
1.2.1 色谱条件
色谱柱:ACQUITY UPLC HSS T3 柱(2.1 mm×100 mm,1.8 μm,美国沃特世公司);柱温:40℃;进样体积:10.0 μL;流动相:A 为乙腈,B 为0.05%甲酸水溶液;洗脱方式:梯度洗脱,流量为0.30 mL/min;梯度洗脱程序见表2。
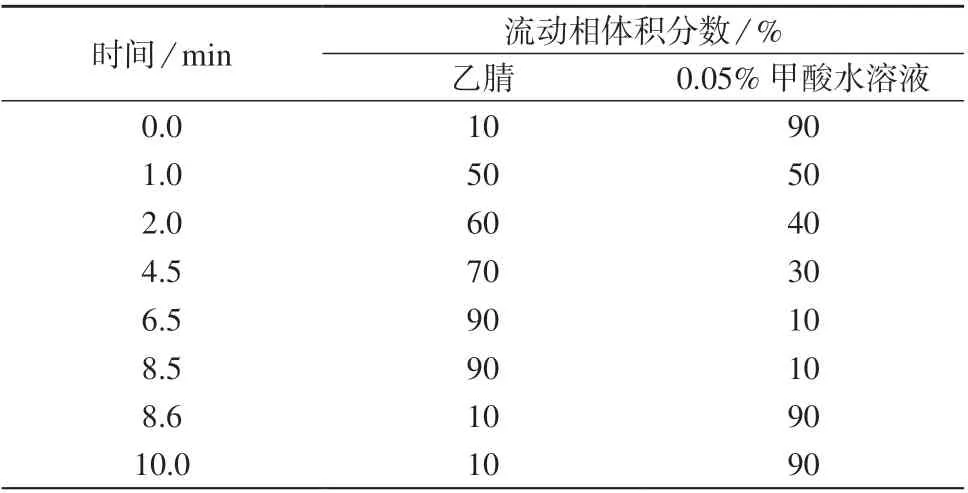
表2 梯度洗脱程序
1.2.2 质谱条件
离子化模式:正离子电离模式(ESI+);检测方式:多反应监测(MRM)模式;离子源温度:150℃;毛细管电压:2.9 kV;锥孔反吹气流量:50 L/h(氮气);锥孔气流量:50 L/h;脱溶剂气温度:500℃;脱溶剂气流量:800 L/h;12 种杀菌剂质谱参数和 保留时间见表3。
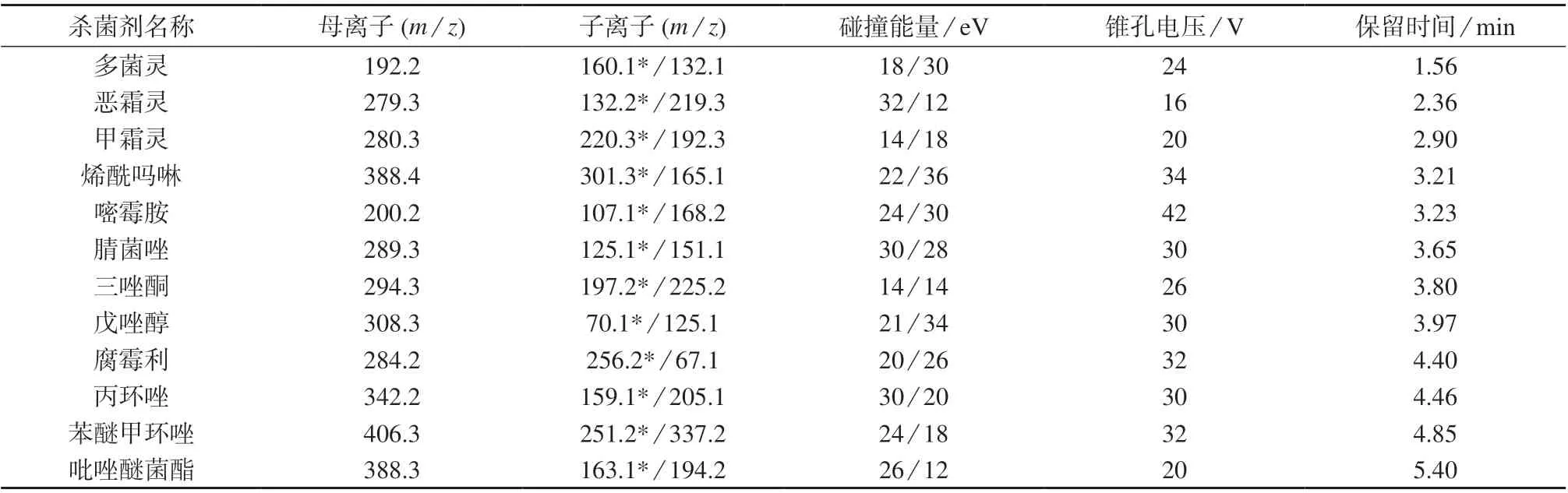
表3 12 种杀菌剂质谱参数和保留时间
1.3 样品前处理
将采集的蔬菜样品按GB/T 27404–2008[15]中蔬菜样品的制备要求进行捣碎均质,放入密封样品袋、塑料离心管或广口瓶中,标记好样品信息,于–18℃冰箱中保存备用。准确称取5.0 g 均质后的蔬菜样品,置于50 mL 塑料离心管中,加入10.0 mL 乙腈涡旋萃取5 min,然后以10 000 r/min 转速离心5 min。取1.0 mL 上清液加入至QuEChERS分散固相萃取试剂盒中,手动振摇5 min,涡旋1 min,然后以10 000 r/min 转速离心3 min,上清液过PVDF 膜后上机测定。
1.4 溶液配制
多菌灵、三唑酮、烯酰吗啉、腐霉利、吡唑醚菌酯、恶霜灵、腈菌唑7 种杀菌剂标准储备溶液:1 000 μg/mL,准确称取7 种杀菌剂标准品各0.01 g,分别置于7 只10 mL 容量瓶中,加入适量甲醇溶解,完全溶解后继续加入甲醇定容至标线,摇匀,于–18℃冰箱中保存。
5 种杀菌剂标准溶液于–18℃冰箱中保存备用。
12 种杀菌剂混合标准工作溶液:分别准确吸取上述7 种杀菌剂标准储备溶液和5 种杀菌剂标准溶液各适量,置于同一只10 mL 容量瓶中,用乙腈稀释并定容至标线,摇匀,配制成腐霉利的质量浓度为10 μg/mL,吡唑醚菌酯、腈菌唑、恶霜灵的质量浓度均为2 μg/mL,其它杀菌剂的质量浓度均为1 μg/mL 的混合标准工作溶液,于4℃条件下保存。
系列基质标准工作溶液:称取5 份均质后的阴性蔬菜样品各5.0 g,置于5 只50 mL 塑料离心管中,分别加入适量体积的混合标准工作溶液和乙腈共10.0 mL,配制成腐霉利的质量浓度分别为5.0,20.0,100.0,500.0,1 000.0 μg/L,吡 唑醚 菌酯、腈菌唑、恶霜灵的质量浓度均分别为1.0,4.0,20.0,100.0,200.0 μg/L,其它杀菌剂的质量浓度均分别为0.5,2.0,10.0,50.0,100.0 μg/L 的系列基质标准工作溶液。基质标准工作溶液按1.3 样品前处理方法进行处理。
2 结果与讨论
2.1 色谱条件优化
分别以相同比例的乙腈和甲醇与水混合作为流动相进行试验,发现在低比例混合时,乙腈的洗脱能力更强,且压力较低,12 种杀菌剂的色谱峰形和响应值均好于甲醇为流动相时,因此选用乙腈–水溶液作为流动相。在正离子模式下,向水相中加入甲酸可以提高离子化效率,考虑到恶霜灵和嘧霉胺在弱酸至弱碱性条件下稳定,可以适当减少甲酸的加入量,故B 相选用0.05%甲酸水溶液。分别以乙腈–0.05%甲酸水溶液、乙腈–0.05%甲酸水溶液(含5 mmol 乙酸铵)为流动相,考察12 种杀菌剂混合标准工作溶液的色谱峰形和响应值,结果发现,在B相中加入乙酸铵可以改善待测化合物的色谱峰形,但会降低目标物的响应值,比较加入乙酸铵前后的色谱图,发现色谱峰形改善不明显,但12 种杀菌剂的响应均受到一定程度的抑制,尤其是对响应较低的腐霉利影响较大,故B 相中不加乙酸铵。因此选用乙腈–0.05%甲酸水溶液为流动相。
以乙腈–0.05%甲酸水溶液为流动相,分别采用ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm)和ACQUITY UPLC HSS T3 (2.1 mm×100 mm,1.8 μm)两种色谱柱对12 种杀菌剂混合标准工作溶液进行分离,发现采用ACQUITY UPLC HSS T3 柱能够获得较好的色谱峰形和分离效果,故选择ACQUITY UPLC HSS T3 柱作为分析柱。
以乙腈–0.05%甲酸水溶液为流动相,采用ACQUITY UPLC HSS T3 柱(2.1 mm×100 mm,1.8 μm)对12 种杀菌剂混合标准工作溶液进行分离,结果表明,梯度洗脱比等度洗脱分析时间短,且可以克服等度洗脱时间越长化合物色谱峰越宽的缺点。优化的梯度洗脱程序见表2。在优化条件下12 种杀菌剂提取色谱图如图1 所示。
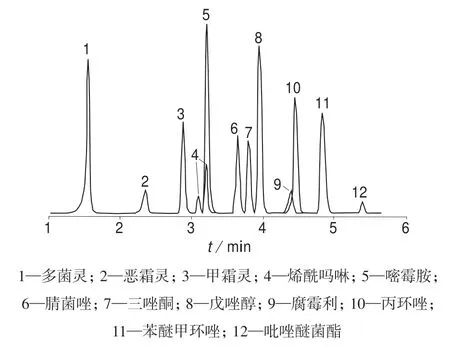
图1 12 种杀菌剂提取色谱图
2.2 质谱条件优化
由于12 种杀菌剂中含有氨基、仲胺或叔胺基团,容易得到加成的正离子,在正离子电离模式(ESI+)下,可获得丰度较高的[M+H]+母离子。通过子离子扫描方式选择响应最大的两个碎片作为子离子,确定定量离子对和定性离子对,并对碰撞能量等质谱条件进行优化。优化的质谱参数见表3。
2.3 净化方法选择
QuEChERS 分散固相萃取试剂盒中装有PSA(N-丙基乙二胺),C18,GCB(石墨化碳黑)和MgSO4,其中PSA 可以去除蔬菜样品中的有机酸、脂肪酸、糖类、酚类以及极性色素;C18可以去除样品中的脂肪、固醇及其它非极性干扰物,对于含脂肪较高的蔬菜样品(黄豆芽等)有很好净化效果;蔬菜样品中往往色素含量很高,GCB 可以有效去除样品中的色素;MgSO4可以去除样品中的水分且不溶于乙腈,不会造成离子源的污染。经QuEChERS分散固相萃取试剂盒处理后的样品可以得到很好的回收率和精密度,且操作步骤简单。因此选择QuEChERS 分散固相萃取试剂盒对样品提取液进行净化。
2.4 提取液选择
QuEChERS 分散固相萃取试剂盒常用乙腈或酸化乙腈(1%乙酸乙腈溶液)作为提取液,考虑到恶霜灵和嘧霉胺在弱酸到弱碱性条件下稳定,因此选择用乙腈为提取液。称样质量(m)与提取液体积(V)比对提取效率有明显影响,刘佳等[16]研究表明,当m∶V=1∶2 时,回收率显著增加。准确称量5 g 样品,分别考察5,10,15 mL 乙腈对12 种杀菌剂的提取效果,结果显示5 mL 乙腈的提取效率明显低于10 mL 和15 mL 乙腈的提取效率,而10 mL 和15 mL 乙腈的提取效率差别不大,考虑到经济效益和环境保护,选择10 mL 乙腈为提取液。
2.5 线性方程与检出限
选取根茎类蔬菜萝卜和叶菜类蔬菜白菜为基质,按1.3 方法配制系列基质标准工作溶液,在1.2仪器工作条件下进行测定。以12 种杀菌剂的质量浓度(X)为横坐标,定量离子对色谱峰面积(Y)为纵坐标,绘制标准工作曲线,计算线性回归方程和相关系数。将基质标准工作溶液逐级稀释,在1.2 仪器工作条件下进行测定,以3 倍信噪比对应的质量浓度作为方法检出限。12 种杀菌剂的线性范围、线性方程、相关系数及检出限见表4。
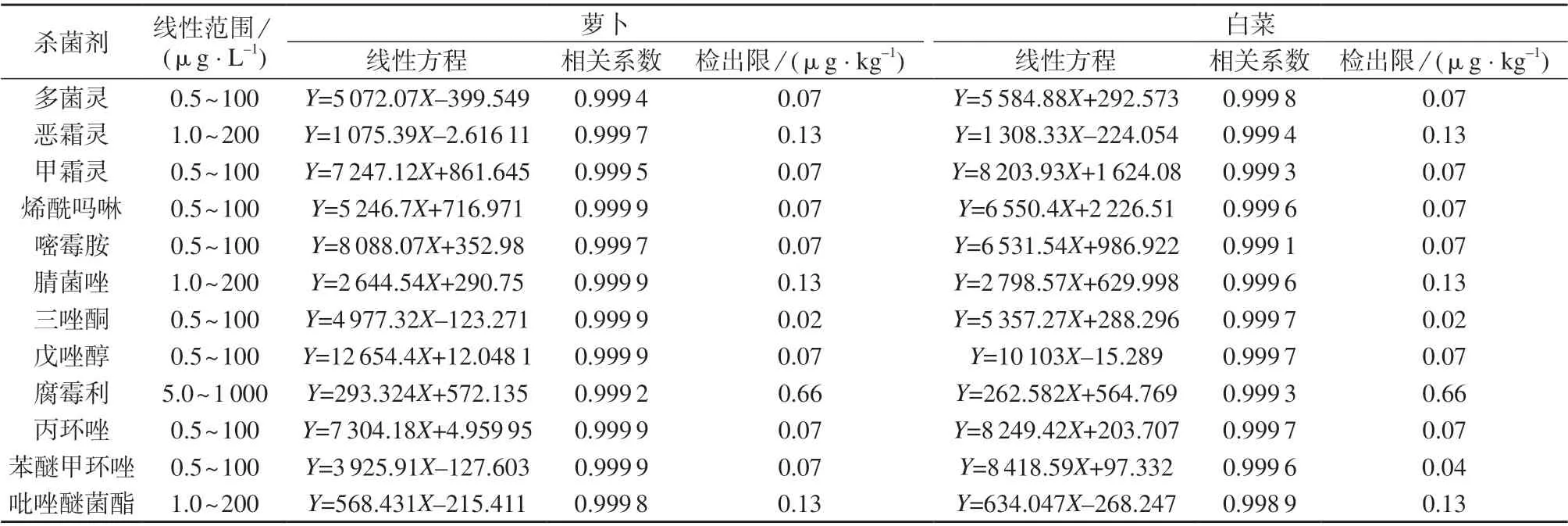
表4 12 种杀菌剂的线性方程、线性范围、相关系数及检出限
由表4 可知,两种基质中12 种杀菌剂在各自的质量浓度范围内线性关系良好,相关系数均大于0.998,方法检出限为0.02~0.66 μg/kg。
2.6 加标回收与精密度试验
准确称取5.0 g 阴性萝卜和白菜样品各18 份,分别加入适量的12 种杀菌剂混合标准工作溶液,按1.4 方法进行样品处理,在1.2 仪器工作条件下分别进行低、中、高3 个浓度水平的加标回收试验,每个浓度水平平行测定6 次,结果见表5。由表5 可知,12 种杀菌剂的平均加标回收率为93.6%~107.5%,测定结果的相对标准偏差为0.93%~3.75%,满足测定要求。表明该方法具有较高的准确度和精密度。
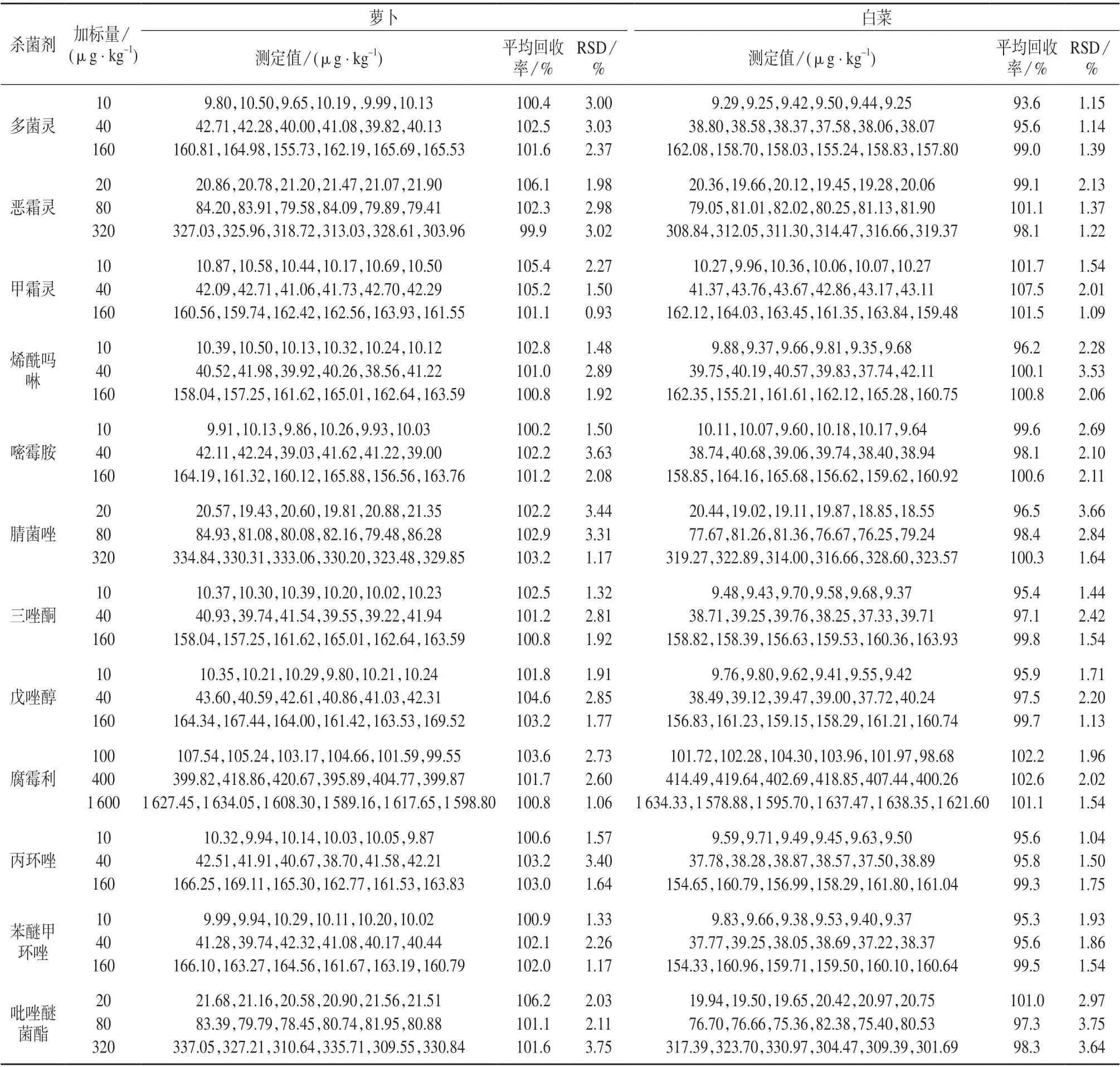
表5 加标回收与精密度试验结果
2.7 样品测定
用所建方法对市售的16 份蔬菜样品进行测定,结果显示,多菌灵和甲霜灵阳性样品各1 份,测定值均为11 μg/kg,苯醚甲环唑阳性样品3 份,测定值分别为6,9,40 μg/kg,均低于各自限值[2],其余杀菌剂均未检出。
3 结语
建立了12 种常见杀菌剂超高效液相色谱–串联质谱检测方法。选取乙腈为提取液,用QuEChERS 分散固相萃取试剂盒对蔬菜样品进行净化,减少了有机试剂用量,操作简便,缩短了样品前处理时间。采用基质标准工作曲线法进行定量,在降低基质效应的同时补偿了净化过程中杀菌剂的损失。该方法准确度高,精密度好,选择性强,大样本量检测时间短,适用于蔬菜样品中多种杀菌剂的同时测定,可以为蔬菜中杀菌剂残留风险评估提供科学、可靠的检测数据。
