气相色谱法同时测定禾谷类农作物中甲草胺、乙草胺和丁草胺
2020-11-24曲颖超王岩王盛男李雯雯索力墨
曲颖超,王岩,王盛男,李雯雯,索力墨
(赤峰市农牧科学研究院,农业面源污染研究中心,内蒙古赤峰 024031)
酰胺类除草剂是一类高选择性的高效触杀性农药,全球销售量最大的酰胺类除草剂有3 种,分别是甲草胺、乙草胺和丁草胺。这3 种酰胺类除草剂适用于多种作物,如玉米、谷子、花生、大豆、棉花等,主要用于防除一年生禾本科杂草与部分阔叶杂草[1]。酰胺类除草剂除草效果好,价格低廉,使用方便,因此在农业生产中应用面积逐渐扩大[2]。近年来,随着农药的大量使用,其对禾谷类农作物的污染问题受到越来越多的关注。
禾谷类农作物可作为粮食、加工食品原料或饲料原材料直接或间接被人们食用,因此在禾谷类农作物种植过程中大量使用的农药成为农产品质量安全的监测项目。建立禾谷类农作物中酰胺类除草剂残留量的测定方法,将有助于了解农药在禾谷类农作物中的残留动态及其污染状况,对后茬作物的生产、绿色生态农业的发展具有重要意义。
目前酰胺类除草剂的测定方法主要有气相色谱法[3–5]、高效液相色谱法[6–8]、气相色谱–质谱法[9–12]、 超高效液相色谱–串联质谱法[13–16]等,上述方法主要用于水、果蔬、大豆、土壤中酰胺类除草剂的测定。目前大米和大豆中的甲草胺[17]、食品中的乙草胺[18]、大米中的丁草胺[19]均有国家标准检测方法,但均为单一农药的检测,而对禾谷类农作物中甲草胺、乙草胺和丁草胺3 种酰胺类除草剂同时测定的研究还没见报道。笔者基于国家农业环境监测项目,对玉米和谷子种植过程进行长期监测,建立了气相色谱法同时测定禾谷类农作物中甲草胺、乙草胺和丁草胺分析方法。该方法操作简单、快速,准确度、精密度和灵敏度高,适用于禾谷类农作物中甲草胺、乙草胺和丁草胺3 种酰胺类除草剂残留量的同时 测定。
1 实验部分
1.1 主要仪器与试剂
气相色谱仪:Agilent 7890B 型,配有电子捕获检测器,美国安捷伦科技有限公司;
高速离心机:Mutifuge X3R 型,赛默飞世尔科技中国有限公司;
24 位氮吹仪:912b 型,美国Orgnomation 公司;
超声波清洗仪:KQ5200DE 型,昆山市超声仪器有限公司;
快速混匀器:HW–2 型,常州未来仪器设备有限公司;
恒温水浴振荡器:SHY–A 型,金坛市成辉仪 器厂;
甲草胺、乙草胺和丁草胺农药标准溶液:质量浓度均为100 μg/mL,农业部环境保护科研监 测所;
乙腈:色谱纯,美国瑞米克化学公司;
丙酮、正己烷:色谱纯,美国Fisher Chemical 公司;
氯化钠:分析纯,国药集团化学试剂北京有限公司;
弗罗里矽硅土固相萃取柱:Florisil-SPE 净化柱,500 mg,6 mL,德国CNW technologies 公司;
有机相微孔滤膜:0.2 μm,美国安捷伦科技有限公司。
1.2 样品前处理
1.2.1 样品提取
取谷子籽粒(脱壳)、玉米籽粒,用高速研磨机粉碎,混匀,将小米粉和玉米粉分别密封,备用。
准确称取小米粉和玉米粉样品各5.00 g 分别置于50 mL 离心管中,加入20 mL 乙腈,浸泡3 h 后,以300 r/min 转速振荡10 min,超声提取30 min,以4 500 r/min 转速离心10 min,分离上清液,收集至装有2~3 g 氯化钠的25 mL 离心管中,盖上塞子,以2 000 r/min 转速剧烈震荡5 min,在室温下静置30 min 以上,使乙腈相和水相分层。吸取10 mL乙腈相提取液于50 mL 离心管中,置于氮吹仪上浓缩至近干,用1 mL 正己烷溶解残渣,供固相萃取柱 净化。
1.2.2 样品净化
用10 mL 正己烷和10 mL 丙酮–正己烷溶液(体积比为1∶9)依次活化弗罗里矽硅土固相萃取柱(Florisil-SPE)。将农作物提取液注入弗罗里矽硅土固相萃取柱内,收集洗脱液至玻璃试管中,用3 mL 正己烷分3 次润洗盛样液离心管,注入萃取柱内,一并收集。最后用15 mL 丙酮–正己烷溶液洗脱,将收集后的全部洗脱液置于氮吹仪上,浓缩至近干,用正己烷定容至5 mL,再用0.22 μm 有机相微孔滤膜过滤,装入进样小瓶,供气相色谱测定。
1.3 仪器工作条件
色谱柱:DB–1701 石英毛细管柱(30 m×0.530 mm,0.50 μm,美国安捷伦科技有限公司);进样口温度:240℃;检测器温度:300℃;载气:氮气,纯度为99.999%;载气流量:2 mL/min,恒流方式;程序升温:初始温度为60℃,以20℃/min 升温至150℃,然后以8℃/min 升温至230℃,保持10.5 min。进样体积:1.0 μL;进样方式:分流进样,分流比为5∶1。
1.4 溶液配制
甲草胺、乙草胺、丁草胺标准储备溶液:质量浓度均为10 mg/L,准确移取甲草胺、乙草胺、丁草胺农药标准品各1.0 mL,分别置于3 只10 mL 容量瓶中,用正己烷稀释并定容至标线,摇匀。
甲草胺、乙草胺、丁草胺混合标准溶液:质量浓度均为2.0 mg/L,准确移取甲草胺、乙草胺、丁草胺标准储备溶液各1.0 mL,置于同一只5 mL 容量瓶中,用正己烷定容至标线,摇匀。
系列混合标准工作溶液:分别移取甲草胺、乙草胺、丁草胺混合标准溶液0.5,2.0,4.0,6.0,8.0,10.0 mL,置于6 只10 mL 容量瓶中,用正己烷定容至标线,配制成甲草胺、乙草胺、丁草胺的质量浓度均分别为0.1,0.4,0.8,1.2,1.6,2.0 mg/L 的系列混合标准工作溶液。
2 结果与讨论
2.1 色谱柱选择
DB–1701 是一款低/中等极性的(14%氰丙基-苯基)-甲基聚硅氧烷色谱柱,常用于分析农药、除草剂、糖的三甲基硅烷化衍生物以及芳氯物。该色谱柱经过键合交联处理,可使用溶剂冲洗,并可与DuraGuard(具有内置保护柱的气相色谱柱)配套使用。DB–17 是一款中等极性的(50%–苯基)-甲基聚硅氧烷色谱柱。其固定相性能与USP G3 固定相相当,是确证分析的理想色谱柱。分别考察DB–1701 和DB–17 两种色谱柱对甲草胺、乙草胺和丁草胺的分离效果,结果如图1 和图2 所示。由图1 和图2 可以看出,采用DB–1701 柱时,3 种酰胺类除草剂分离效果理想且峰型最佳。故选择DB–1701 色谱柱(30 m×0.530 mm,0.50 μm)。
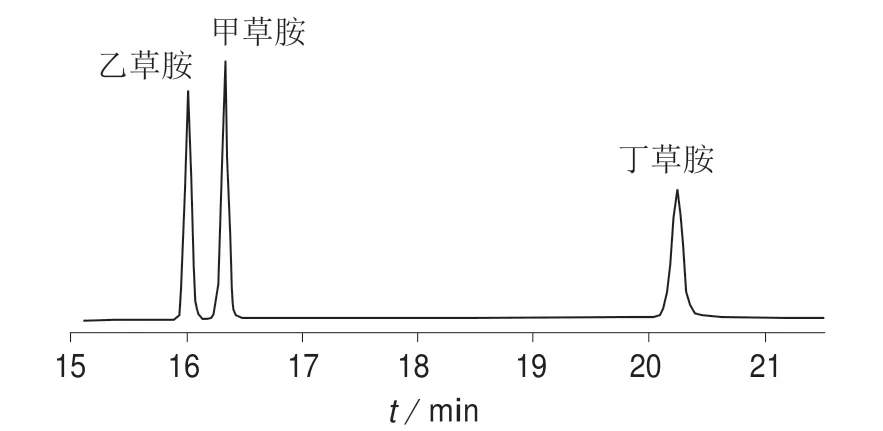
图1 DB–1701 色谱柱分离的气相色谱图
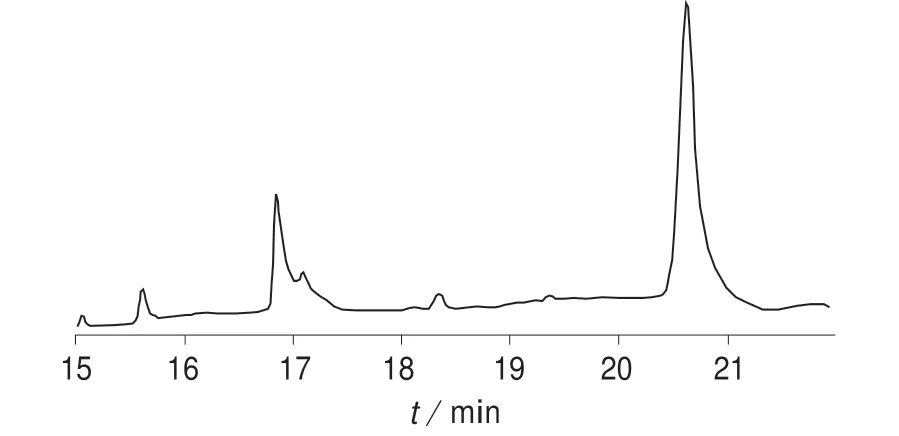
图2 DB–17 色谱柱分离的气相色谱图
2.2 超声时间选择
以乙腈为提取溶剂,分别考察超声时间为0,20,30,40,50 min,振荡10 min 条件下的提取效果,结果如图3 所示。由图3 可以看出,超声时间为30,40 和50 min 时,酰胺类除草剂的回收率基本相当,均达到95%左右;超声时间为20 min 时的回收率为80%左右。综合考虑,最终选择乙腈超声时间为30 min。
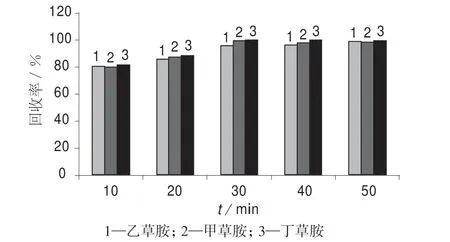
图3 3 种酰胺类除草剂不同超声时间的回收率
2.3 净化方法选择
分别考察通用性较好的氨基固相萃取柱(NH2–SPE)和弗罗里矽硅土固相萃取柱(Florisil-SPE)对3种酰胺类除草剂的净化效果,结果如图4 所示。由图4 可以看出,采用弗罗里矽硅土固相萃取柱净化的回收率明显高于氨基固相萃取柱,净化时间也较短,故选择弗罗里矽硅土固相萃取柱进行净化处理。
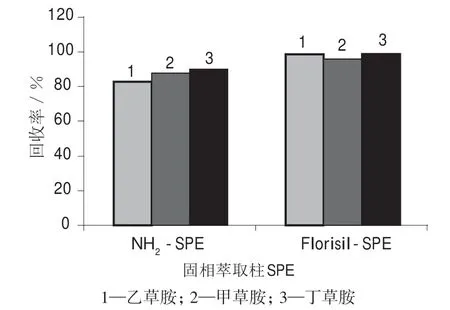
图4 3 种酰胺类除草剂不同净化方式的回收率
2.4 线性方程与检出限
在1.3 仪器工作条件下,对1.4 中的系列混合标准工作溶液进行测定,以3 种除草剂的质量浓度(X)为横坐标,以对应的色谱峰面积(Y)为纵坐标绘制标准曲线,计算线性方程和相关系数。
按GB/T 27417 中所述方法确定检出限和定量限[20]。向空白样品中添加不同浓度的甲草胺、乙草胺、丁草胺混标标准溶液,通过多次添加试验,反复降低添加浓度,确定最低可接受浓度的样品,在1.3 仪器工作条件下,连续测定11 次,计算标准偏差。用样品空白值加上4.65 倍标准偏差计算方法检出限。为了增加数据的可信性,用3 倍的方法检出限计算方法定量限。3 种酰胺类除草剂的线性范围、线性方程、相关系数、检出限及定量限见表1。
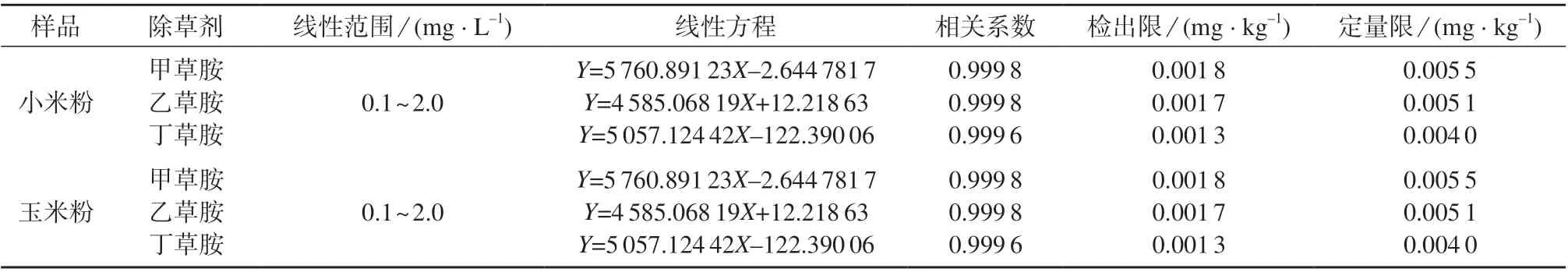
表1 线性范围、线性方程、相关系数、检出限及定量限
由表1 可知,3 种酰胺类除草剂的质量浓度在0.1~2.0 mg/L 范围内与色谱峰面积呈良好的线性关系,线性相关系数均大于0.999 6。甲草胺、乙草胺、丁草胺的检出限分别为0.001 8,0.001 7,0.001 3 mg/kg,定量限分别为0.005 5,0.005 1,0.004 0 mg/kg。
2.6 加标回收与精密度试验
准确称取5.00 g 不含待测农药的小米粉、玉米粉样品,分别添加0.4,2.0,3.6 mg/kg 3 个水平的甲草胺、乙草胺和丁草胺,按所建立方法进行前处理及测定,每个浓度点平行测定6 次,结果见表2。由 表2 可 知,在0.4,2.0 和3.6 mg/kg 3 个加标水平下,甲草胺、乙草胺和丁草胺的平均回收率为90.7%~104.8%,测定结果的相对标准偏差为0.61%~3.97%,表明该方法具有较高的准确度和精密度,满足农药定量分析要求[21]。
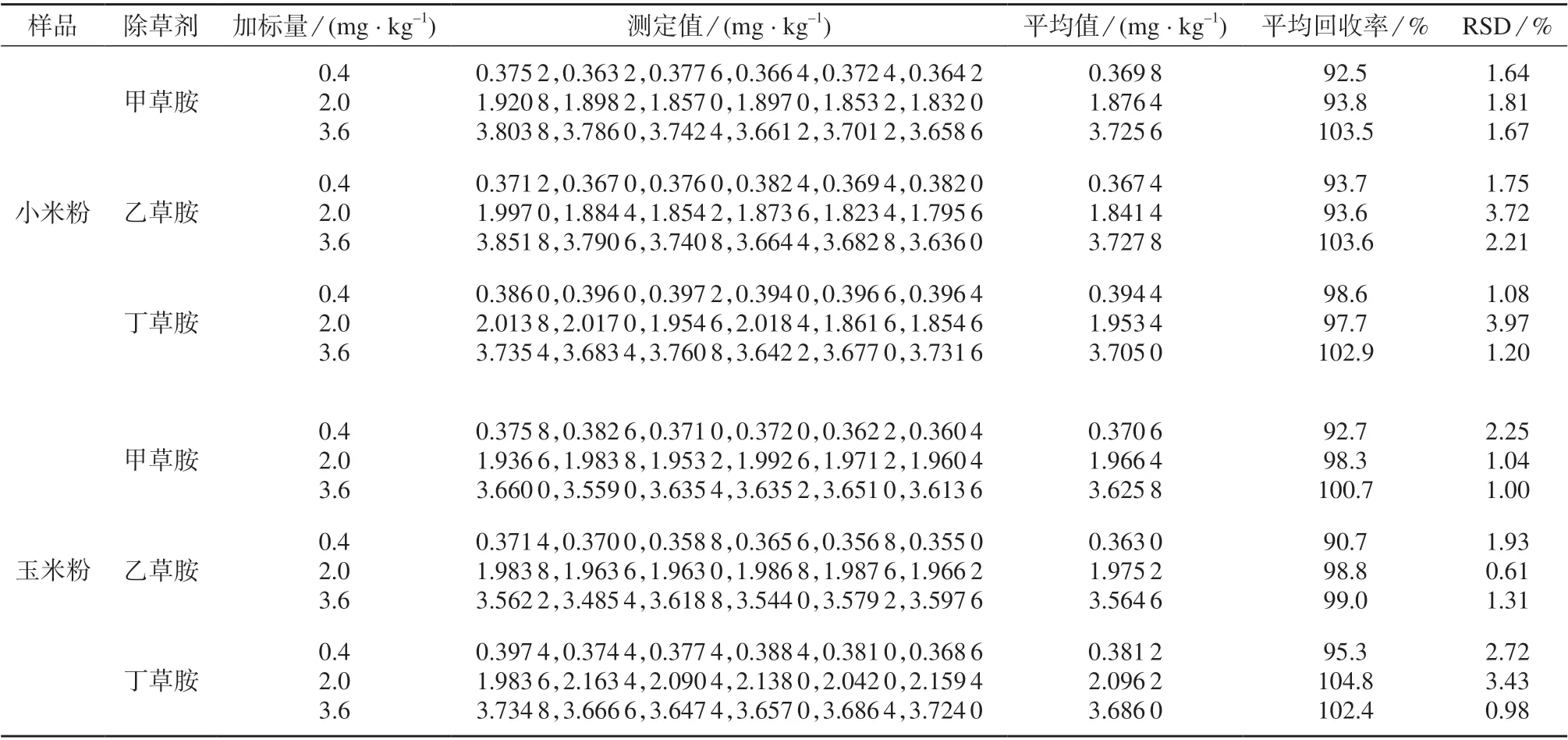
表2 加标回收与精密度试验结果
3 结语
采用乙腈为提取剂超声浸提样品,浸提液经过离心,用弗罗里矽硅土固相萃取柱净化,建立了气相色谱法同时测定禾谷类农作物中甲草胺、乙草胺和丁草胺3 种酰胺类除草剂的分析方法。该方法操作简单,准确度、精密度和灵敏度高,适用于日常大量禾谷类样品中甲草胺、乙草胺和丁草胺残留量的同时检测。
