手术与放疗间隔与新发胶质母细胞瘤病人肿瘤增长及预后的相关性
2020-11-23王勇陶治鹤田少斌
王勇 陶治鹤 田少斌
胶质母细胞瘤(glioblastoma,GBM)是最难治愈的5大肿瘤之一,也是成人最常见的原发性恶性脑肿瘤,异质性和侵袭性较高,导致致残率和病死率高,预后差[1],其表观遗传学机制可能是异柠檬酸脱氢酶1和2基因突变、表皮生长因子受体异常激活、血小板源性生长因子受体异常激活、BRAF突变等。目前其治疗方案是综合治疗,以最大限度地安全切除为主,并于术后辅以放疗与化疗[2-3]。胶质母细胞瘤是生长最快的实体瘤之一,尽早进行放疗或许可抑制癌细胞增殖,改善预后,但目前对进行放疗的时机仍未有统一标准[4]。山常国等[5]研究显示,尽早进行放疗可增加胶质母细胞瘤病人总生存期,降低死亡率,仇振巍[6]认为,手术与放疗间隔时间并不影响胶质母细胞瘤病人术后预后。我们对80例新发胶质母细胞瘤病人的临床资料进行回顾性分析。
对象与方法
一、对象
本院2013年6月~2016年8月收治的新发胶质母细胞瘤病人80例,年龄20~78岁,平均年龄(48.56±8.23)岁,男49例,女31例。按照术后行放疗时间不同分为3组:<30天组(27例)、30~60天组(26例)和>60天组(27例)。纳入标准:(1)均患有新发胶质母细胞瘤,其诊疗均符合《2014EANO指南:未分化神经胶质瘤和胶质母细胞瘤的诊断和治疗》[7];(2)经组织病理检查证实为胶质母细胞瘤;(3)均行手术切除。排除标准:资料不全者或在围术期死亡者;复发胶质母细胞瘤或继发性、多发性、多部位胶质母细胞瘤。本研究已获本院医学伦理委员会批准。
二、方法
1.治疗方法:所有病人入院后均完善相头颅CT、MRI等检查,明确病灶位置及大小,以非功能区作为手术入路,在不损害功能区的前提下,进行近全切除或部分切除最大限度地切除病灶,术后予以放疗(总剂量60 Gy,分为30次)治疗。同时,连续42天口服替莫唑胺(TMZ)胶囊(江苏天士力帝益药业有限公司,规格:50 mg/粒,国药准字H20040637),剂量为75 mg/m2,每天1次。同步放化疗期结束后4周,采用TMZ 5/28方案(TMZ 150~200 mg/m2,5天,28天为1个周期,共6个周期)进行辅助化疗。3组病人一般资料比较差异无统计学意义。见表1。
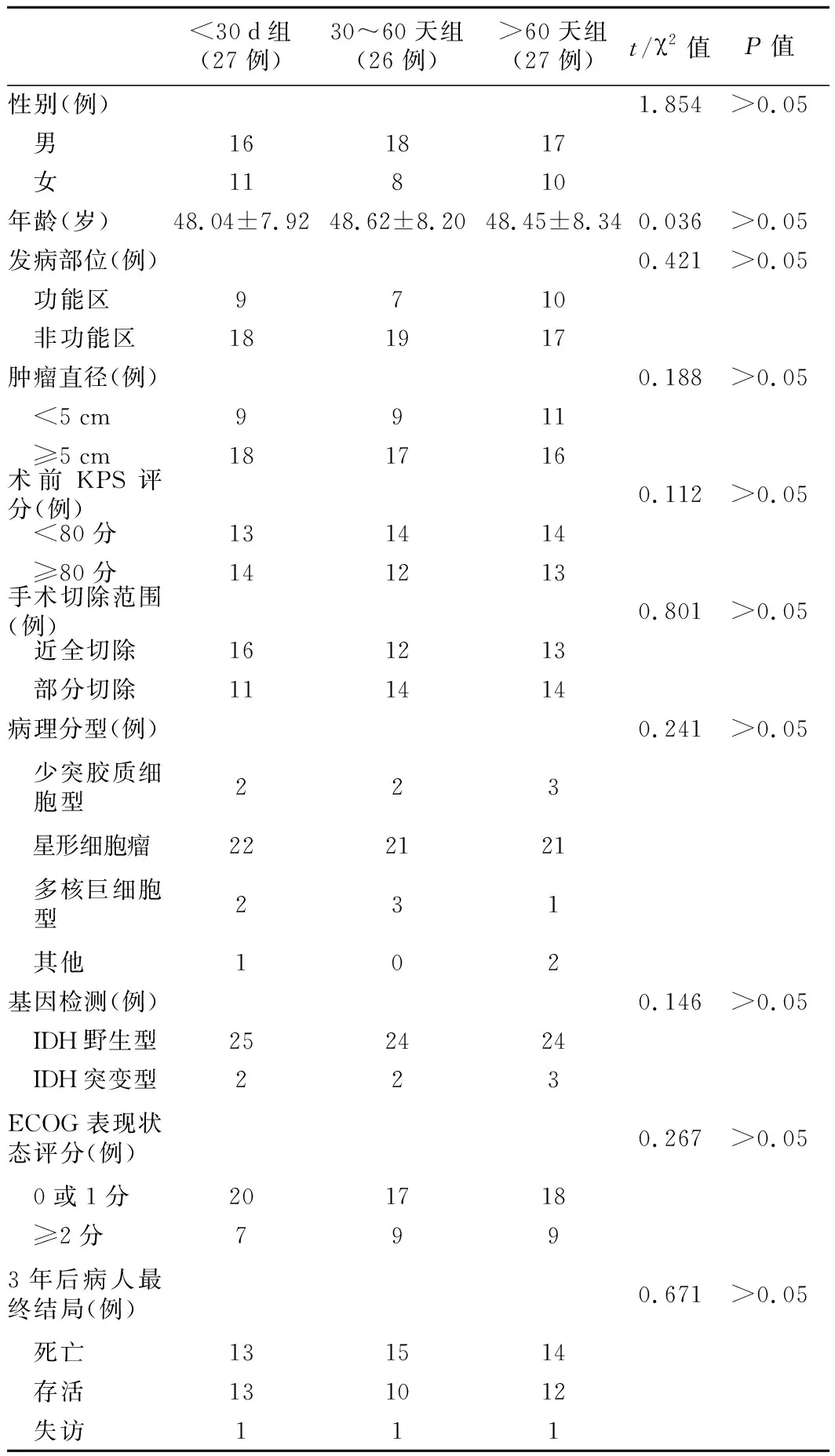
表1 3组病人一般资料比较
2.观察指标:记录3组病人性别、年龄、发病部位、肿瘤直径、术前KPS评分、手术切除范围、美国东部肿瘤协作组织(ECOG)表现状态评分等基线资料指标。 KPS评分是Karnofsky功能状态评分标准,评分范围为0~100分,分数越高,说明病人健康状况越佳。近全切除定义为不考虑视觉残留增强肿瘤的MRI切除,同时考虑到T1对比增强以及FLAIR信号信息[8]。总生存时间为病人首次手术时间至死亡或末次随访的时间。
3.随访:3组病人随访截止时间为2019年8月;记录3组病人总生存期,Kaplan-Meier法绘制生存曲线,分析死亡风险。
三、统计学处理
结果
1.3组病人3年总生存情况比较:3组病人随访期间各出现1例失访,共失访3例;<30天组3年总生存率为46.16%(12/26),中位生存时间为32(10~36)个月;30~60天组3年总生存率为48.00%(12/25),中位生存时间为32(9~36)个月;>60天组3年总生存率为42.31%(11/26),中位生存时间为30(8~36)个月;Kaplan-Meier生存曲线分析显示,3组病人3年死亡风险比较,差异无统计学意义(Log-rank X2=0.046,P=0.977)。见图1。

图1 3组病人3年总生存时间比较
2.死亡组与存活组病人相关资料比较:死亡组病人年龄、KPS评分、手术切除范围与存活组比较,差异有统计学意义(P<0.05)。影响新发GBM病人生存时间的单因素分析,见表2。
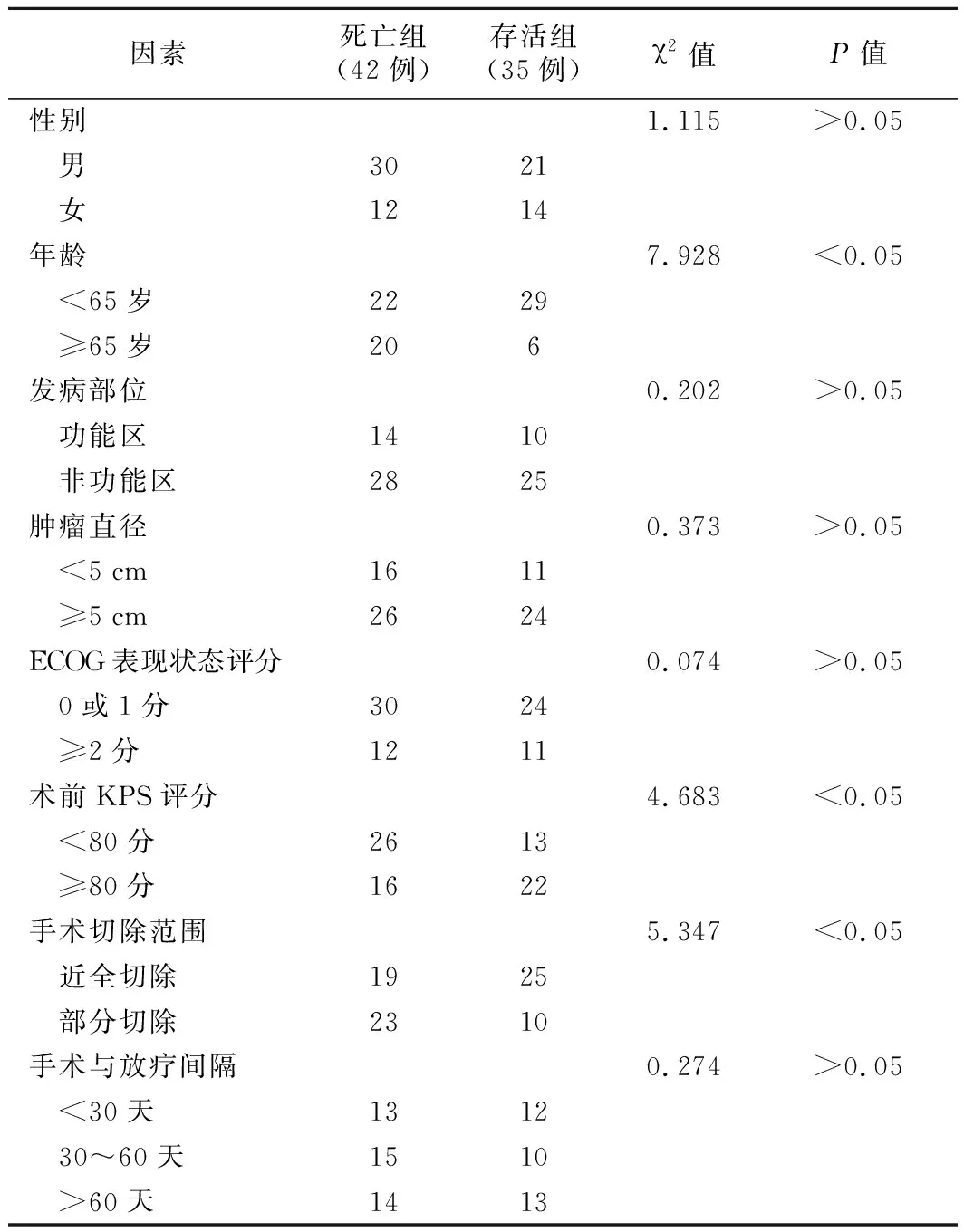
表2 影响病人生存时间的单因素分析
3.影响病人死亡的危险因素分析:多因素COX回归分析显示,年龄≥65岁(HR=2.162)、术前KPS评分<80分(HR=1.634)、部分手术切除(HR=3.241)是导致新发GBM死亡的危险因素,见表3。

表3 影响病人死亡的COX回归分析
讨论
GBM是难以治愈的最常见中枢神经系统恶性肿瘤之一,主要表现为头痛、肢体瘫痪、癫痫、视力障碍、感觉障碍、失语等神经压迫症状,甚至死亡,其发病率较高,病死率和致残率高[9-10],目前其治疗标准是最大范围地安全切除,但由于GBM侵袭性强,部位特殊,难以真正做到完全切除,常辅以放化疗[11]。GBM癌细胞增殖速度迅猛,存在早期放疗抑制肿瘤增长,并改善预后的可能。梁进华等[12]提出,对于GBM病人,尽早在术后进行放疗可增加其总生存时间。Loureiro等[13]持不同看法。目前,对于是否尽早进行术后放疗以及最佳手术与放疗间隔仍缺乏足够的循证医学证据。
本研究GBM病人的3年的存活率为45.45%,与钟琼等[14]报道的存活率相近。年龄、术前KPS评分、手术切除范围均对GBM病人的生存情况有影响,与郑宗泰等[15]、Jiang等[16]研究结果一致。对于老年人,机体基础疾病较多,手术耐受能力下降,较多接受部分切除手术,术后接受放化疗几率下降,无法更好清除残余的癌细胞,导致OS较短,预后较差[17]。术前KPS评分越高,说明病人的机体状况越好,越能耐受手术与放化疗。在放化疗过程中,可利用异柠檬酸脱氢酶1和2(IDH1/2)基因突变、表皮生长因子受体异常激活、血小板源性生长因子受体异常激活、BRAF突变等表观遗传学特征,予以生物靶向治疗。手术切除范围越大,肿瘤对脑组织的压迫作用越小,颅内压越接近正常范围,为后续的放化疗提供良好的耐受能力[18]。手术残留癌细胞是引起GBM病人术后原位复发的主要原因,应最大限度切除肿瘤,争取全切除,达到磁共振显示T1增强消失,T2、FLAIR异常信号可较前无明显变化,减少癌细胞残留,抑制肿瘤增殖,改善预后[19-20]。
性别、发病部位、肿瘤直径、ECOG表现状态评分、手术与放疗间隔均对GBM病人的平均OS无统计学意义上的影响,与Vaness等[21]研究结论一致。Sun等[22]、何东杰等[23]认为,手术与放疗间隔延长,未及时抑制癌细胞增殖,肿瘤体积增大,压迫正常脑组织,颅内压增高,可造成病人OS缩短,存活率下降,这可能与本次研究样本量较少,GBM的病理分级等有关。本研究为单中心、回顾性研究,实验样本量仅为80例,未对肿瘤分子进行相关研究,且不可避免地存在不同程度的主观及客观误差,还需进一步进行更大样本量的前瞻性、多中心性研究,以探索治疗GBM的最佳手术与放疗间隔时间。
综上所述,对于新发GBM病人,术后与放疗时间间隔对于预后并无明显影响,而年龄、术前KPS评分和手术切除范围会影响病人不良预后。
