锰矿石中有效氧含量测定方法确认与应用
2020-11-21王干珍易晓明田宗平
王干珍,易晓明,李 力,彭 君,田宗平
(1. 湖南省地质测试研究院,湖南 长沙 410007; 2. 湖南省有色地质勘查局二四五队测试中心,湖南 吉首 416007)
0 前 言
锰矿石中有效氧含量的测定方法主要有重铬酸钾容量法[1]、硫酸亚铁容量法和草酸钠容量法[2]和碘量法[3-6]。重铬酸钾容量法采用二氧化碳气体保护并于微沸状态下分解试样,实验过程繁琐费时;硫酸亚铁容量法在重铬酸钾容量法基本原理的基础上,对测定步骤等条件进行了改进,但碳酸铁和硫化锰等对测定方法的干扰等没有改进;草酸钠容量法不仅操作费时测定周期较长,适用性受限,测定干扰因素多,测定结果重现性差,终点有时很难判断等诸多因素影响。上述方法在快速测定锰矿石中有效氧[ω(MnO2)]含量时均存在不足。本文根据碘量法的基本原理, 在硫酸和磷酸混介质和过量碘化钾存在的条件下, 使二氧化锰与碘化钾反应定量析出碘,然后用硫代硫酸钠标准溶液滴定析出的碘,建立间接测得锰矿石中有效氧的含量的方法。本法简单快速, 分析结果准确,排除了共存三价铁离子的干扰。实验用有证标准物质(CRM)样品作对照试验,其分析结果与其标准值一致。且该方法应用于锰矿标准物质制备定值也取得了较好的效果。
1 试验部分
1.1 主要试剂
1) 重铬酸钾标准溶液,C(1/6K2Cr2O7)=0.100 0 mol/L。
准确称取4.903 5 g预先在 120℃烘干至恒重的重铬酸钾纯度标准物质(GBW061025C)于200 mL的烧杯中,加少量水溶解后,移入1 000 mL 的容量瓶中,用水稀至刻度,混匀。
2)硫代硫酸钠标准溶液,C(Na2S2O3)=0.05 mol/L。
称取12.5 g硫代硫酸钠(Na2S2O3·5H2O)于200 mL的烧杯中,加入0.2 g无水碳酸钠,用水溶解后,移入1 000 mL 的 容量瓶中,用水稀至刻度,混匀,放置2~3 d后标定。
3)淀粉指示剂0.5%,现用现配。
4)硫酸和磷酸混合介质:将200 mL硫酸(ρ=1.84 g/mL)缓慢倒入100 mL水中,边加边搅,冷却后,再加200 mL磷酸(ρ=1.69 g/mL),并小心混匀。
1.2 试验样品的前处理
试验样品粉碎至全部通过0.097 mm,混匀,105℃烘干后,备用。
1.3 试验方法
1.3.1 方法原理
在酸性介质中,碘化钾可将二氧化锰还原为二价锰,并析出等物质量的碘。其化学反应方程式为:MnO2+2I-+4H+=Mn2++I2+2H2O。
析出的碘用硫代硫酸钠标准溶液滴定。其化学反应方程式为:I2+2S2O32-=2I-+S4O26-。
根据消耗的硫代硫酸钠标准溶液的体积,计算出锰矿石中有效氧的含量。
1.3.2 量值溯源
量值溯源是通过一条具有规定的不间断的比较链,使测量结果与国家计量基准联系起来的特性,实现量值溯源的主要手段是校准和检定[7-8]。本法采用重铬酸钾纯度标准物质(GBW061025C)配制的标准溶液对硫代硫酸钠标准溶液进行浓度校准的方式实现量值溯源。
1.3.3 浓度校准
采用有证标准物质(CRM)配制的重铬酸钾标准溶液和光谱纯度的二氧化锰试剂,按照样品分析步骤对同一硫代硫酸钠标准溶液分别进行浓度标定,根据消耗的硫代硫酸钠标准溶液的体积,计算出硫代硫酸钠标准溶液的摩尔浓度,后换算出彼此的滴定度。计算公式如下:
T1=C(Na2S2O3)×0.043 47×100
式中C(Na2S2O3)——硫代硫酸钠标准溶液的浓度,mol/L;
C(1/6K2Cr2O7)——重铬酸钾标准溶液的浓度,mol/L;
V(1/6K2Cr2O7)——移取重铬酸钾标准溶液的体积,mL;
V1(Na2S2O3)——用重铬酸钾校准消耗硫代硫酸钠标准溶液的体积,mL;
T1——用重铬酸钾标准溶液校准硫代硫酸钠标准溶液换算的滴定度,mg/mL;
0.043 47——二氧化锰的毫摩尔质量,g/mmol;
T2——用光谱纯二氧化锰校准硫代硫酸钠标准溶液换算的滴定度,mg/mL;
m(MnO2)——称取光谱纯二氧化锰的质量,g;
V2(Na2S2O3)——用光谱纯二氧化锰校准消耗硫代硫酸钠标准溶液的体积,mL;
1.3.4 浓度校准结果
用重铬酸钾标准溶液和光谱纯度二氧化锰对硫代硫酸钠标准溶液多次标定,标定结果见表1。

表1 硫代硫酸钠标准溶液浓度校准结果
由表1可知:同时分取不同体积的重铬酸钾标准溶液和称取不同重量的光谱纯度二氧化锰对硫代硫酸钠标准溶液进行标定,其结果稳定可靠,表明两种标准物质标定硫代硫酸钠对二氧化锰的滴定度,可以起到量值溯源和硫代硫酸钠标准溶液滴定度校准的目的。
1.4 样品测定
准确称取0.2 g(精确至 0.000 1 g)样品于300 mL的碘量瓶中,加50 mL水,2 g碘化钾,用水洗涤瓶口,摇动碘量瓶使碘化钾溶解。然后加20 mL混合酸,盖上瓶塞,摇匀,放置暗处不时摇动,至试样完全分解。20 min后用硫代硫酸钠标准溶液滴定至浅黄色,加3 mL 0.5%的淀粉指示剂,继续用硫代硫酸钠标准溶液滴定至溶液由蓝色刚变为无色为终点。根据消耗的硫代硫酸钠标准溶液的体积,计算出二氧化锰的质量分数。
1.5 结果的计算
测定结果按下式计算:
式中C(Na2S2O3)——硫代硫酸钠标准溶液的浓度,mol/L;
V(Na2S2O3)——试料消耗硫代硫酸钠标准溶液的体积,mL;
43.47——1/2二氧化锰的摩尔质量,g/mol;
m——样品的质量,g。
2 结果与讨论
2.1 样品分解使用的介质及用量
在测定样品有效氧[ω(MnO2)]的含量时,溶液需要保持一定的酸度,以保证碘的定量析出。本方法在参考文献[3-6]的基础上,分别选择加入盐酸、硫酸或硫酸—磷酸混合酸来分解样品,发现3种方法都能溶解样品。但用盐酸或者硫酸溶解样品滴定时容易产生MnO2沉淀,影响终点的观察,同时,因试样中含有一定量的铁,在酸性条件下铁会将KI氧化成I2而干扰测定,本法利用硫酸—磷酸混合酸分解样品能让H3PO4与Fe3+络合,消除铁的干扰,且滴定终点容易判断,故本法选择加入硫酸—磷酸混合酸来分解样品。在实验条件下,加入20 mL硫酸—磷酸混合酸,可获得满意的测定结果。
2.2 温度及光照的影响
室温下分解样品是本方法的优点之一,不仅缩短了样品分解时间,同时也减少了许多副反应的发生,避免影响测定。由于MnO2与KI的反应以及Na2S2O3滴定I2的反应速度都比较快,因此,样品分解与滴定在室温下都能正常进行;而碘化钾在光照及酸性溶液中较易损失,故本方法选择在室温下进行样品分解与滴定,但应注意分解样品时尽可能避光。
2.3 分解时间的影响
按本试验方法,对一个有证标准物质(GBW07264)前处理完成后,放置不同的时间后滴定,记录其消耗的硫代硫酸钠标准溶液的体积,计算结果见表2。

表2 不同反应时间的测定结果
结果表明,在室温条件下,随着放置时间的延长,样品分解的更完全,结果误差更小。但反应时间太长会增加测定成本,同时由于时间太长,空气中的氧会慢慢氧化碘离子造成结果偏高。对于粒度较均匀的样品反应时间在15 min即可。考虑到样品粒度的差异,本法选择放置时间20 min为宜。
2.4 碘化钾的用量
碘化钾的加入是为了MnO2与KI反应定量析出I2。用量太少反应不完全,用量太多造成浪费,同时增加分析成本。按照碘量法反应式计算,要求碘化钾的用量过量2~3倍即可,同时可以减少碘的挥发,使反应趋于稳定。在实验条件下对一个有证标准物质(GBW07264)加入不同量的碘化钾,测定其MnO2含量,结果见表3。

表3 加入不同量碘化钾分解后二氧化锰的测定结果
结果表明:同一样品加入的碘化钾用量在1.0~4.0 g之间时,结果都在误差范围内,综合考虑实验要求及分析成本,本法选择碘化钾用量2.0 g。
2.5 倍比实验
在最优实验条件下对3个有证标准物质(CRM)及2个标准物质候选物样品进行倍比实验,其结果见表4。

表4 倍比实验测定结果
结果表明,同一样品称样量发生变化时,测定结果都在误差范围内,由此判定基体对测定结果基本没有影响。
2.6 本法与国标方法对照实验
对3个有证标准物质及2个标准物质候选物样品分别称取0.2 g(精确至0.000 1 g),用本法和GB/T1507-2006进行测定,其结果见表5。
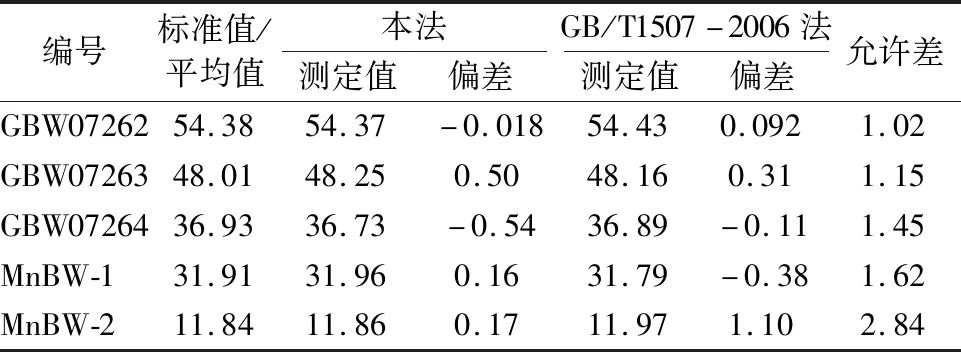
表5 不同方法对比实验结果表 10-2
结果表明:本法与国标法(GB/T1507-2006)所测定结果偏差均在允许差范围内,表明本法的准确度高。
3 方法的确认与应用
对3个有证标准物质和2个锰矿标准物质候选物样品分别进行加标回收实验,同时对5个样品进行精密度和准确度实验。结果分别见表6、表7、表8。

表6 标准加入回收试验结果
由表6可知,方法加标回收率在97.71%~100.51%,该方法加标回收率高。

表7 二氧化锰含量的精密度测定结果与统计 10-2
由表7可知,方法多次测定结果相对标准偏差0.27%~1.34%,表明精密度较高。
由表8可知:相对误差0.018%~0.97%,小于允许差,表明方法准确度较高。
综上所述,根据本方法加标回收、精密度和准确度实验结果,以及利用重铬酸钾纯度标准物质(GBW061025C,CRM)配制的标准溶液对硫代硫酸钠标准溶液进行浓度校准方式实现量值溯源。确认该法完全满足锰矿石中有效氧含量定值要求,可作为锰矿石成分分析标准物质候选物中二氧化锰质量分数的定值方法。
4 结 论
1) 通过对锰矿中有效氧含量测定方法的确认与应用研究,确保了锰矿成分分析标准物质研制中有效氧质量分数定值的准确性、科学性和权威性。
2) 确认的方法应用于锰矿石成分分析标准物质中二氧化锰的定值,结果准确可靠。
3) 本方法简洁快速,对厂矿企业生产中二氧化锰质量分数的测定具有很好的应用前景。
