锰系氧化物在LiMn2O4中的应用
2020-11-21木宗云许定胜李庆波王德志吴秀玲刘维荣黄文杰
木宗云,许定胜,李庆波,王德志,江 权,吴秀玲,刘维荣,黄文杰,张 敬
(1. 湖南特种金属材料有限责任公司,湖南 长沙 410013; 2. 中南大学 材料科学与工程学院,湖南 长沙 410083)
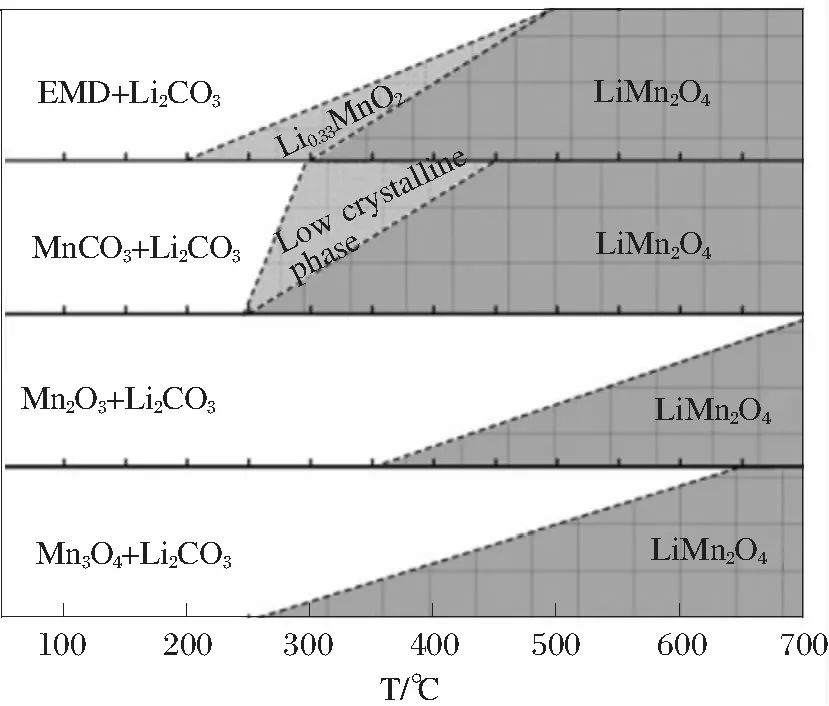
用于合成LiMn2O4的锰系氧化物有MnO、Mn3O4、Mn2O3和MnO2,由图1的Li-Mn-O相图[1]可知,理论上均可以制备出LiMn2O4[2-5]。工业化生产LiMn2O4的常用方法是固相反应法,将锂化合物与锰氧化物进行混合,然后在高温下进行煅烧。
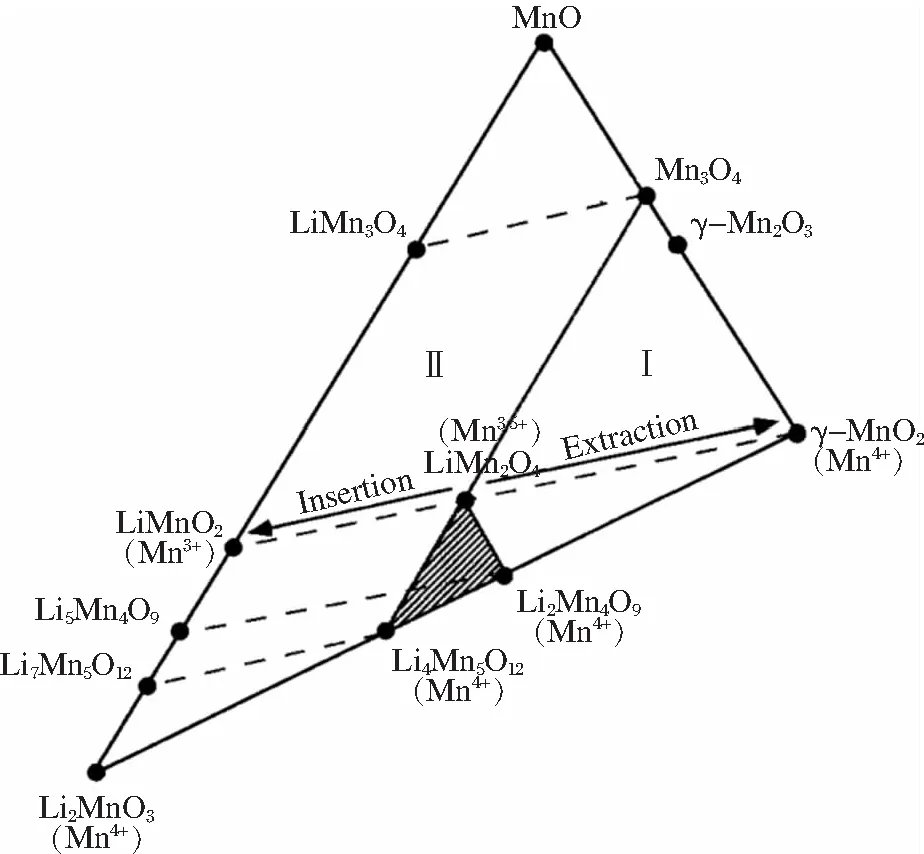
图1 Li-Mn-O相图[1]
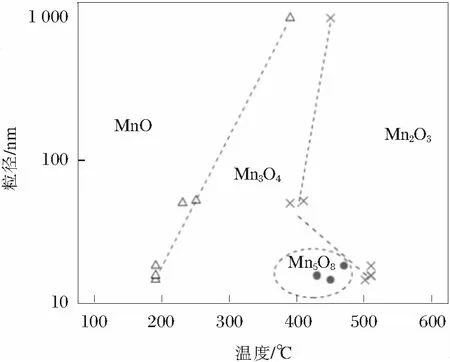
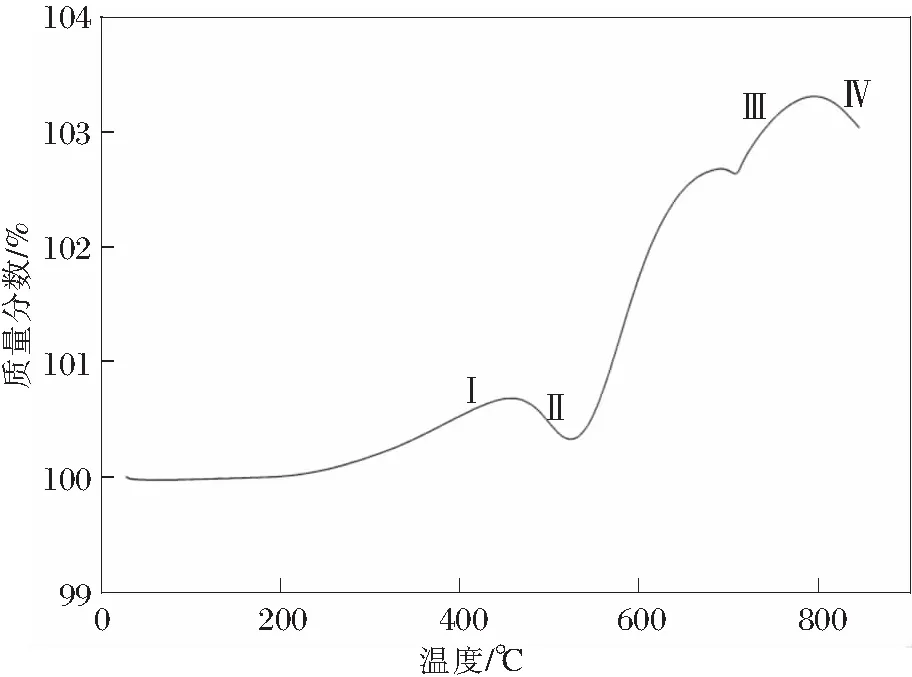
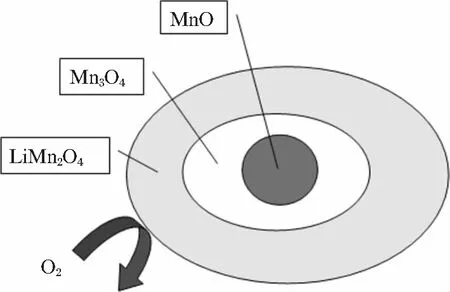
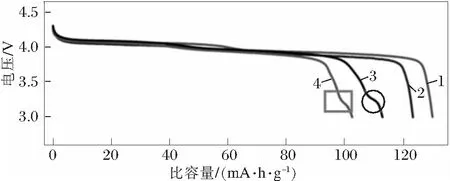
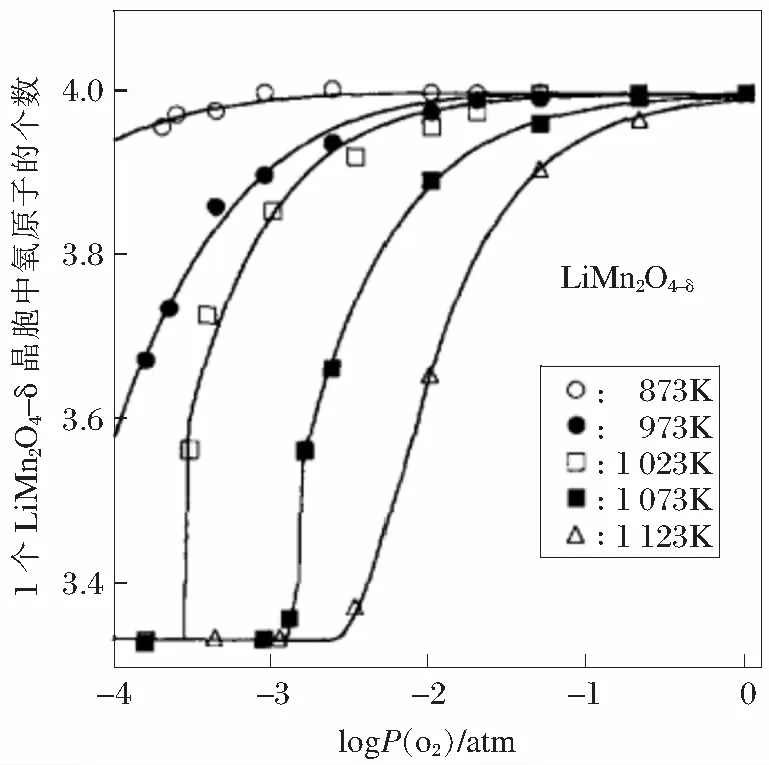
尖晶石型LiMn2O4具有资源丰富、成本低、环境友好、放电电压高、耐大电流充放电安全性好等优点,是锂离子二次电池最有优势正极材料之一,一直是研究热点[6],其理论容量148 mA·h/g,实际容量约120 mA·h/g。Li1-xMn2O4(0 不同锰系氧化物制备LiMn2O4时的工艺有所不同,制备的LiMn2O4微观缺陷表现各异[8-11],电化学性能差距较大[5,9-15]。锰系氧化物的形貌、杂质含量对LiMn2O4的电性能具有重要影响。不同锰系氧化物的成本会影响LiMn2O4的成本,工业化生产中应予以考虑。 以MnO为原料制备LiMn2O4反应方程式如下: 24MnO+9O2+6Li2CO3→12LiMn2O4+6CO2 加热状态下,MnO非常容易在空气中氧化,发生氧化的温度随粒度不同而不同,粒度越小,氧化温度越低(如图2所示),随温度升高的氧化过程是MnO→Mn3O4→Mn2O3[16]。当MnO粒径为15 nm时,发生氧化的温度是200℃;1 μm时,氧化温度是400℃。在不同的温度下,氧化产物有可能是MnO+Mn3O4的混合物或者Mn3O4+Mn2O3的混合物。 以MnO+Li2CO3(ωLi=28%)为反应原料制备LiMn2O4的DSC曲线中,如图3[17]所示,从室温加热到850℃的反应分为4个阶段[17],即阶段Ⅰ、Ⅱ、Ⅲ、Ⅳ,如下所述: 图2 不同粒径MnO随温度变化的产物[16] 阶段Ⅰ,质量增加,发生温度范围200~450℃,结合图2,对应的反应过程是6MnO+O2→2Mn3O4,表明MnO发生氧化时的产物是Mn3O4。 图3 MnO+Li2CO3为反应原料制备LiMn2O4的DSC曲线[17] 结合图5可知:在250℃时就已经发生反应,8Mn3O4+5O2+6Li2CO3→12LiMn2O4+6CO2。如图4所示,可以预见,包覆在Mn3O4表面的LiMn2O4严重阻碍氧气往内部扩散;由于氧气缺乏,MnO的氧化反应将无法进行,最终生成的是LiMn2O4+Mn3O4+MnO混合物,LiMn2O4充放电性能差。 图4 LiMn2O4包覆后,MnO氧化反应无法进行 阶段Ⅱ,质量降低,对应的反应是Li2CO3的分解,Li2CO3→Li2O+CO2↑,温度480~520℃;阶段Ⅲ,质量增加,对应的反应是Mn3O4+O2→Mn2O3,同时也包括生成LiMn2O4时的吸氧行为,温度520~780℃;阶段Ⅳ,质量降低,对应的是LiMn2O4的高温分解。 MnO作为锰源制备LiMn2O4时有如下特点: 1)成本较高。一般MnO的制备需要采用其他锰系氧化物还原制备,从价态转变考虑,首选Mn3O4作为还原底物;还原时需要通H2,还原成本高; 2)难以保存。Mn2+室温不稳定,容易氧化,保存条件要求无氧; 3)制备条件苛刻。制备LiMn2O4时,需要消耗大量的氧气,氧气扩散不充分容易引起烧结物料不均匀,未反应的MnO、Mn3O4甚至Mn2O3都有可能残留,LiMn2O4充放电性能一致性差。 以Mn3O4为原料制备LiMn2O4反应方程式如下: 8Mn3O4+5O2+6Li2CO3→12LiMn2O4+6CO2 与Li2CO3反应,Mn3O4反应活性达到2个“+”[18],如表1所示,反应活性较强;如图5[19]所示,反应起始温度250℃,Mn3O4能够直接合成得到LiMn2O4结构。 表1 合成尖晶石LiMn2O4时不同起始原料的活性[18] 图5 不同锰系氧化物与Li2CO3的反应产物变化示意[19] 邹兴[2]认为相对其他锰系氧化物,Mn3O4制备的LiMn2O4形貌不均匀,充放电性能较差。周汉章[3]采用EMD、Mn3O4、Mn2O3为原料制备了LiMn2O4,其中使用Mn3O4合成的LiMn2O4形貌较好,性能最优,常温循环480次和45℃高温循环300次后容量保持率依然高达91.2%和89.7%;该LiMn2O4由呈类球形的一次颗粒和二次颗粒组成,且一次颗粒表面光滑、紧密堆积,形成面接触,使得二次颗粒内部无明显空隙存在,既保证了材料的电子导电性能又可降低材料的表面活性,提高稳定性能。 在改进Mn3O4形貌方面上,JIANG[20]通过控制结晶法制备了球形Mn3O4,利用球形Mn3O4制备的球形结构LiMn2O4的充放电性能得到较大幅度地提升,并且球形结构LiMn2O4振实密度高,利于工业化生产,具有较好的市场前景。进一步,JIANG[21]制备了掺杂型球形Mn3O4,高低温循环性能得到进一步提升。GUO[13]对球形Mn3O4进行了改进,增加了Mn3O4的孔隙,更好的促使Li在球形Mn3O4内部的扩散,振实密度达到2.67 g/cm3,5 C倍率下充放电200次的容量保持率为95%。 从价态变化考虑,Mn3O4可以理解为MnO·Mn2O3的混合物,反应时Mn2+、Mn3+会氧化成高价态Mn3+、Mn4+,具体氧化过程是Mn2+→Mn3+→Mn4+,价态转变、Li扩散、新相生成、晶粒聚集和合并同时进行,可能生成微量缺氧型LiMn2O4。由于Mn3O4反应过程中需要吸收大量氧气,局部尤其是底部的氧气扩散不足会导致缺氧型尖晶石LiMn2O4的生成,由图6[18]中曲线4方框处表明存在晶格氧缺陷。由此可以看出,Mn3O4作为反应原材料存在生产控氧难题,图6中曲线d表明由于缺氧尖晶石LiMn2O4的存在[18],制备的LiMn2O4放电性能表现较差。 Mn3O4作为锰源制备LiMn2O4时有如下特点: 1)形貌及杂质可控。通过控制结晶法可以合成球形结构的Mn3O4,Fe、Ca、Mg等杂质含量可以很容易满足锂电池的要求; 2)易于掺杂。在控制结晶过程中,可以进行Al、Co、Ni元素的掺杂等,由此得到的LiMn2O4性能优异; 3)控制结晶法制备的Mn3O4易于工业化生产; 4)Mn3O4与LiMn2O4都为尖晶石结构,制备过程相变应力小。 如表1所示,Mn2O3对Li2CO3表现出一定的反应活性。各锰系氧化物反应温度与物相之间的对应关系如图5所示。 4Mn2O3+O2+2Li2CO3→4LiMn2O4+2CO2 与Li2CO3反应,Mn2O3反应活性达到1个“+”,如表1所示,反应活性弱;如图5[19]所示,Mn2O3同样能够直接合成得到LiMn2O4结构。 如图6所示:在4.3 V,20 mA/g的条件下,首轮放电曲线中,Mn2O3制备的LiMn2O4性能最优异,容量达到130 mA·h/g。Mn3O4制备的LiMn2O4放电性能最差。值得注意的是,上述Mn2O3、MnCO3、EMD(电解MnO2)、Mn3O4都是普通非球形结构,放电性能可以较准确的反映在相同制备工艺下材料的本质特性。 图6 Li2CO3与不同锰源合成的尖晶石结构 Mn2O3反应的起始温度较高,约为350℃[19],整个反应涉及价态转变、Li扩散、新相生成、晶粒聚集和合并同时进行,但从价态变化考虑,反应时Mn3+会氧化成高价态Mn4+,具体氧化过程是Mn3+→Mn4+,只有一个电子的转移,耗氧量少。从图6曲线1可以看出:Mn2O3制备的LiMn2O4放电性能最优,没有表现出图6曲线3和4中微量缺氧型LiMn2O4的不利影响。 Nakamura T[9]认为在相同生产工艺下,由不同方法制备的Mn2O3合成的LiMn2O4产生了程度不一的氧缺陷,导致充放电性能差距较大。李卫[22]采用Mn2O3原料,以离子渗透法制备的LiMn2O4性能较差。相较于用Mn3O4、MnO2制备的LiMn2O4,邹兴[2]用Mn2O3制备的LiMn2O4的充放电性能好,结晶度高,颗粒细小、致密,颗粒大小分布均匀,首次充放电比容量最高,分别为136.51 mA·h/g 和124.18 mA·h/g,也表现出了最优的循环性能,循环50次后的充放电容量分别为103.02,91.21 mA·h/g。 可以认为,在一定条件下,Mn2O3也能够制备出充放电性能较优的LiMn2O4。 Mn2O3作为锰源制备LiMn2O4时有如下特点: 1)Mn2O3的制备需要采取其他锰系氧化物进行高温煅烧,能耗高,成本高; 2)Mn2O3的形貌较难控制,难以满足锂电池的高振实密度要求。 目前,电解MnO2(EMD)是制备LiMn2O4常用原材料。反应方程式如下: 8MnO2+2Li2CO3→4LiMn2O4+2CO2↑+O2↑ EMD与Li2CO3反应,EMD反应活性达到4个“+”[18],如表1所示,反应活性非常强;如图5所示,反应起始温度200℃[19],生成中间相Li0.33MnO2,加热到300℃生成LiMn2O4。结合图5[19]可知,EMD与Li2CO3在200~500℃温度范围内,Li0.33MnO2与LiMn2O4共同生成;该两种物相存在相界,在继续升高温度过程中Li0.33MnO2会转变成LiMn2O4,上述相界会转变成晶界,晶界的存在会导致晶粒之间结合强度减弱,导电性能下降,电子传输受阻,放电容量降低;另一方面,EMD与Li2CO3会生成缺氧尖晶石结构的LiMn2O4[18],图6圆圈处所示,同样导致放电性能差。邹兴[2]的研究表明:相对Mn2O3,MnO2制备的LiMn2O4性能较差。 由图7可知:在常规合成温度700℃时,氧气不足仍然可以引起缺氧型尖晶石LiMn2O4的生成。 图7 MnO2制备的缺氧型尖晶石LiMn2O4缺氧程度δ变化 当改变合成工艺时,MnO2表现出最好地充放电性能。如李卫[22]采用离子渗透法合成LiMn2O4,发现相对β-MnO2、Mn3O4和Mn2O3,具有2×2方形隧道结构的α-MnO2更有利于锂离子渗透到隧道结构中,高温时容易获得较完整的立方尖晶石结构,表现出优异地充放电性能。为降低LiMn2O4的成本,John A[23]利用自然界中的β-MnO2制备了LiMn2O4,在9 C高倍率循环下依然保持较好的稳定性。 MnO2作为锰源制备LiMn2O4时有如下特点: 1)MnO2的制备方法以电解法居多,价格低; 2)电解法制备的MnO2形貌可控性差,非球形结构; 3)杂质含量高,尤其硫、钠,磁性杂质(铁、铬、镍)含量高,制备的LiMn2O4容量低。 综上所述,制备低比表面积和高振实密度LiMn2O4时,MnO、Mn2O3的成本高、难以反应完全,EMD杂质含量高、形貌可控性差,均不是首选原料;球形Mn3O4在制备低比表面积和高振实密度LiMn2O4时表现出明显地优势。可以预测,对球形Mn3O4的研究将成为热点,未来研究方向应该包括: 1)形貌优化。制备便于锂扩散的多孔球形结构Mn3O4以及能有效抑制Mn溶解的表面包覆技术; 2)元素掺杂。以提高LiMn2O4倍率性能为目标的多元素共同掺杂; 3)成本控制。由于球形Mn3O4较EMD生产成本高,未来将聚焦降低球形Mn3O4的成本。1 MnO制备LiMn2O4
2 Mn3O4制备LiMn2O4

3 Mn2O3制备LiMn2O4
4 MnO2制备LiMn2O4
5 结 语
