基于UPLC-MS/MS大鼠体内白术内酯Ⅰ、Ⅱ、Ⅲ的药代动力学参数研究*
2020-11-20许玲玲姚兆敏汪电雷周媛媛李晨辉仰忠华赵亚男
许玲玲,姚兆敏,汪电雷,周媛媛,张 敏,李晨辉,仰忠华,赵亚男,3△
(1.安徽中医药大学药学院, 安徽 合肥 230012;2.安徽仙寓山农业科技有限公司,安徽 黄山 245000;3.皖南医学院第一附属医院弋矶山医院,安徽 芜湖 241001)
白术(Atractylodes macrocephala Koidz.),菊科多年生草本植物,根茎入药,主产于浙江、江西、湖南、安徽等地,有於术、浙东术、江西术、平江术、祁术之称[1],多以产地命名。性温,味苦、甘,归脾、胃经,具有健脾益气、利水祛湿的功效[2]。白术中主要化学成分为倍半萜类、多炔类、多糖等,其中倍半萜类中白术内酯类具有显著的抗肿瘤[3]、抗炎[4-5]和神经保护作用[6]。白术内酯I可剂量依赖性地抑制NO、TNF-α、IL-6的产生,对慢性炎症有较强的抑制作用[2]。白术内酯II和III能够增强唾液淀粉酶活性和改善胃肠道运动功能[7-8],具有健脾和调节紊乱肠道菌群的作用,符合临床应用白术健脾的药理活性机制。
白术内酯I、II、III是白术化学成分与药效密切相关的指标性成分,为了研究白术内酯类化合物的药理活性机制,本文就文献报道的方法进行改进[9-14],采用UPLC-MS/MS法同时检测白术内酯I、II、III的含量,考察其在大鼠体内的药动学变化趋势,旨在为其体内药物代谢动力学过程提供初步参考,以期为白术的临床合理应用提供实验依据。
1 材料与方法
1.1 药物与试剂 白术(Atractylodes macrocephala Koidz.),产于安徽祁门,经安徽中医药大学生药系金传山教授鉴定为菊科白术的干燥块茎。药材前处理:白术,除去表面污泥,晒干,并清理多余的须根。置于35℃恒温干燥箱中干燥48 h,切片,打粉过3号筛,备用。取白术粉末300 g,加入3 000 mL蒸馏水,先浸泡30 min,保持微沸30 min,药液移至旋转蒸发仪中,T=60℃,n=40 r/min,浓缩至一定体积,得到浓度为 0.84 g/mL的白术药材提取物。白术内酯I、II、III(武汉中标科技有限公司,批号分别为:73069-13-3、73069-14-4、73030-71-4,纯度:≥98%);对乙酰氨基酚(中国药品生物制品检定所,批号:100018-200408,纯度 ≥ 98%);乙腈、甲醇(色谱纯);超纯水(自制);其他试剂均为分析纯。
1.2 实验动物 SPF级SD雄性大鼠,体质量(180±20)g,购自安徽医科大学实验动物中心,合格证号:SCXK(皖)2019-002。实验前大鼠适应性饲养1周,标准温度(25±2)℃,相对湿度 40%~55%,自由摄食摄水。给药前禁食12 h,自由饮水。本文涉及的动物实验经安徽中医药大学动物伦理委员会批准。
1.3 仪器 Acquity UPLC超高效液相色谱仪(美国Waters公司);Xevo G2QTOF质谱仪(美国 Waters公司);A2004型十万分之一电子天平(德国Sartorius公司);Milli-Q Gradient A10超纯水器(Millipore Inc.USA);Centrifuge 5804R台式高速离心机(上海东兢电子有限公司);HK-2016切片机(湖北海阔医疗科技有限公司);LK-400B型打粉机(浙江温岭创新药材器械厂);202-2型电热恒温干燥箱(上海实验仪器有限公司);AS5150A型超声清洗仪(Autoscience公司);YRE201D旋转蒸发器(巩予予华仪器有限公司)。
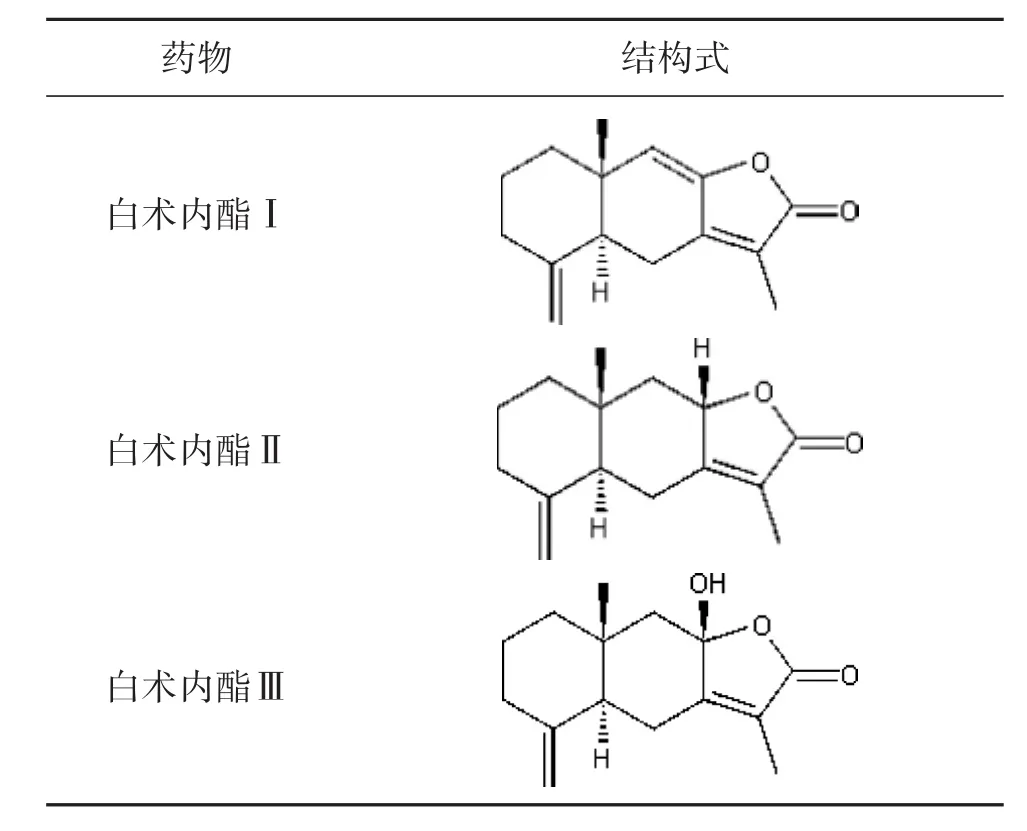
表1 白术内酯I、II、III的结构式
1.4 方法
1.4.1 色谱条件 Waters ACQUITY UPLC CSH C18柱(2.1 mm×100 mm,1.7 μm);柱温:25 ℃;进样量:2 μL;体积流量:0.2 mL/min;运行时间:55 min;检测波长:240 nm。流动相:0.05%磷酸水溶液(A)-乙腈(B),梯度洗脱:0~19 min,25%~54%B;19~30 min,54%~56%B;30~40 min,56%B;40~50 min,56%~65%B;50~60 min,65%~25%B。
1.4.2 质谱条件 质谱离子源为电喷雾离子化源正离子(ESI+),选择多反应监测(MRM)模式,高纯氮气作为质谱用气,用于定量反应的离子和能量分别为:白术内酯 I(m/z 233.1→215.1),去簇电压 96.1 V、射入电压10.4 V、碰撞电压18.6 V、碰撞室射出电压11.0 V;白术内酯II(m/z 231.0→185.0),去簇电压103.4 V、射入电压10.0 V、碰撞电压26.8 eV、碰撞室射出电压 13.1 V;白术内酯 III(m/z 249.1→231.0),去簇电压80.0 V、射入电压10.4 V、碰撞电压13.9 eV、碰撞室射出电压16.0 V;对乙酰氨基酚(m/z 152.1→109.8),去簇电压 65 V、射入电压 10.4 V、碰撞电压20.7 eV、碰撞室射出电压11.0 V。气帘气10.0 Psi;碰撞气 9 Psi;喷雾电压 5 500 V;雾化温度550 ℃;雾化气 11.0 Psi;辅助气 0.0 Psi。
1.4.3 标准与质控样品的制备 精密称取白术内酯I、II、III对照品和对乙酰氨基酚(内标)各 1.00、1.38、1.41、1.07 mg,加乙腈溶解并定容至1 mL,得浓度分别为1、1.38、1.41 mg/mL的对照品储备液和浓度为1.07 mg/mL的内标溶液,用乙腈梯度稀释白术内酯I、II、III储备液得白术内酯 I、II、III对照品工作液,稀释内标储备液至10 ng/mL作为内标工作液,-4℃保存备用。
建立标准曲线的质控样品:50 μL空白血浆,加入25 μL内标与一定体积的对照品工作液,按下列浓度制备标准曲线:白术内酯 I、II、III分别为 1.25、2.5、5、10、30、100 ng/mL;1.725、3.45、6.9、13.8、41.4、138 ng/mL;1.765、3.53、7.06、14.12、42.3、141 ng/mL;内标溶液为10 ng/mL。空白血浆中质控样品的浓度为:白术内酯 I、II、III 分 别为 2.5、10、100 ng/mL;3.45、13.8、138 ng/mL;3.53、14.12、141 ng/mL。
1.4.4 血浆样品预处理 取血浆样品50 μL,加入内标(10 ng/mL,25 μL);涡旋混合 30 s,加入 1 mL 乙酸乙酯萃取,涡旋混合3 min,12 000 r/min离心10 min,取上清液50 μL至新的EP管中,于35℃下N2流吹干,残渣用100 μL乙腈复溶,涡旋混合30 s,10 000 r/min离心10 min,取上清液,进样2 μL进行UPLC-MS/MS定量分析。
1.4.5 动物分组与给药 18只大鼠,灌胃给药前禁食不禁水12 h,每组6只。低、中、高剂量组分别为2.1、4.2、8.4 g/kg,一次性灌胃给药。分别于灌胃给药后的 0.083、0.17、0.25、0.33、0.5、1、2、4、6 和 12 h,眼底静脉丛采血 0.3 mL/次;采后的血浆经3 500 r/min,4℃,离心10 min,吸取上清液,-20℃冰箱冻存备用。血浆样品按“1.4.4”项下操作后进样分析,得到各个时间点的白术内酯I、II、III与内标的峰面积。
1.5 数据处理 使用LabSolutions软件进行数据采集和处理,求得血浆校正曲线并且计算每只动物的白术内酯I、II、III浓度数据;血浆药物浓度数据应用DAS 2.1药代动力学软件拟合,计算药代参数 tmax、t1/2、Cmax、AUC0-t。
2 结果
2.1 质谱分析 待测物白术内酯I、II、III及内标在ESI源正离子条件下信号强度优于负离子条件。一级全扫描模式下,待测物白术内酯I、II、III及内标分别主要生成准分子离子[M+H]+m/z 232.9、231.1、248.9、151.9。对相应的准分子离子进行二级质谱全扫描分析,待测物白术内酯I、II、III及内标进一步优化后分别选取 m/z 215.1、185.0、231.0、109.8 二级离子作为定量分析时检测的产物离子。
2.2 方法专属性 取大鼠的空白血浆,每个平行6份,除不加内标溶液外,其余按“1.4.4”项下操作,对本方法学的专属性进行考察,内源性物质不会对分析物白术内酯I、II、III及内标产生信号干扰。白术内酯I、II、III 及内标的保留时间分别为:2.55、3.1、1.8、1.2 min,见图 1。
2.3 标准曲线与灵敏性 样品经过预处理后,使用对照品建立标准曲线。取空白血浆,每个平行操作6份,分别加入白术内酯I、II、III和内标对照品工作液适量,依次测得白术内酯I、II、III和内标的峰面积,以进样浓度(X)为横坐标,峰面积比值(Y)为纵坐标,最小二乘法计算回归方程。测得回归方程为最后建立的标准曲线:白术内酯I:Y=1.447X-2.9396,r=0.9972;白术内酯 II:Y=0.9918X-3.5478,r=0.9936;白术内酯 III:Y=0.4699X-0.3463,r=0.9933;r值均大于 0.99以上,说明白术内酯 I、II、III分别在 0.1~100 ng/mL、0.138~138 ng/mL、0.141~141 ng/mL范围内线性关系良好。白术内酯I、II、III的定量下限分别为 1.25、1.725、1.765 ng/L(S/N=10)。白术内酯 I、II、III的检测限分别为 0.1、0.138、0.141 ng/L(S/N=3)。
2.4 准确度与精密度 取低、中、高3个不同浓度的白术内酯I、II、III的质控样品,每个浓度平行6次,连续进行3天,于日内和日间各测定6次,分别计算日内与日间精密度(RSD)与准确度(RE)。准确度在95%以上,日内和日间精密度均小于10%,均符合检测要求,见表2。
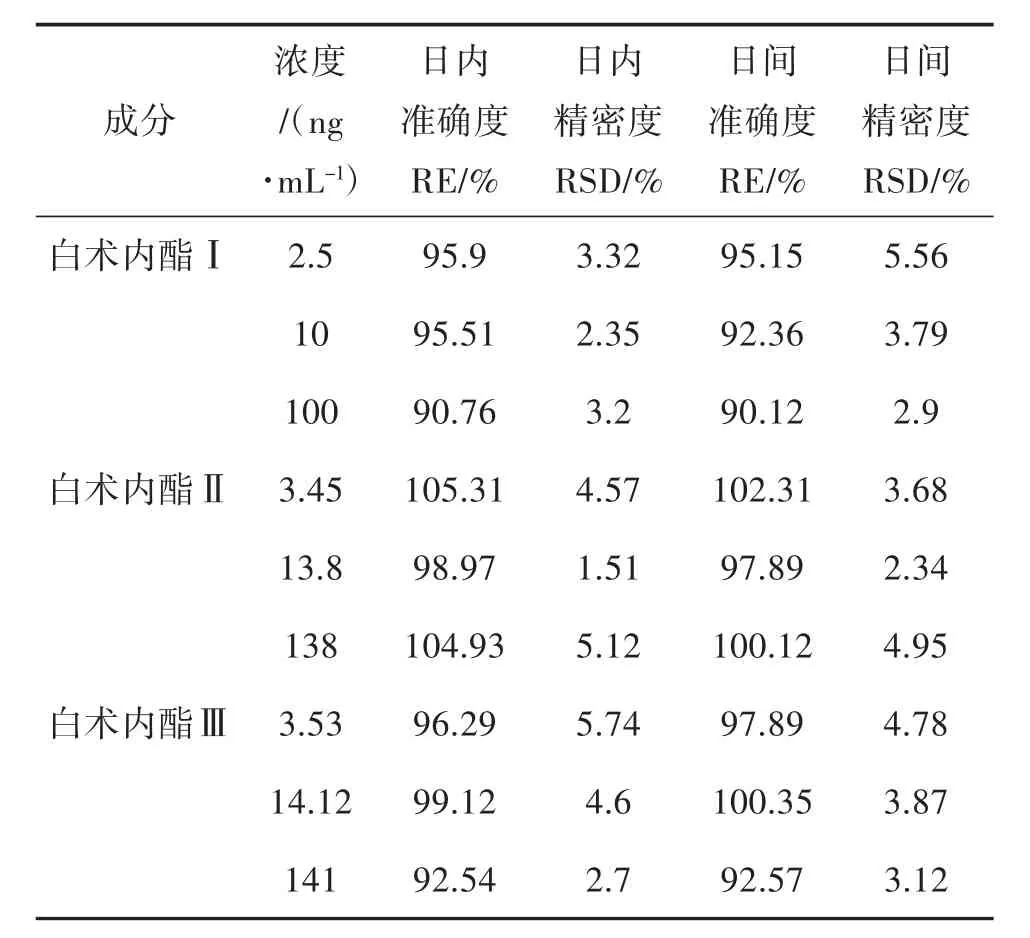
表2 白术内酯I、II、III的日内与日间准确度与精密度(n=6)
2.5 基质效应 取空白血浆,按“1.4.4”项下处理后,加入低、中、高3个不同浓度的对照品系列的工作液,N2流吹干后,乙腈复溶,每个浓度进样6次,记录峰面积A;另取低、中、高3个不同浓度的对照品系列工作液,N2流吹干后,乙腈复溶,每个浓度进样6次,记录峰面积B;基质效应的RSD在10%以下,表明不会对样品的分析产生明显影响,见表3。
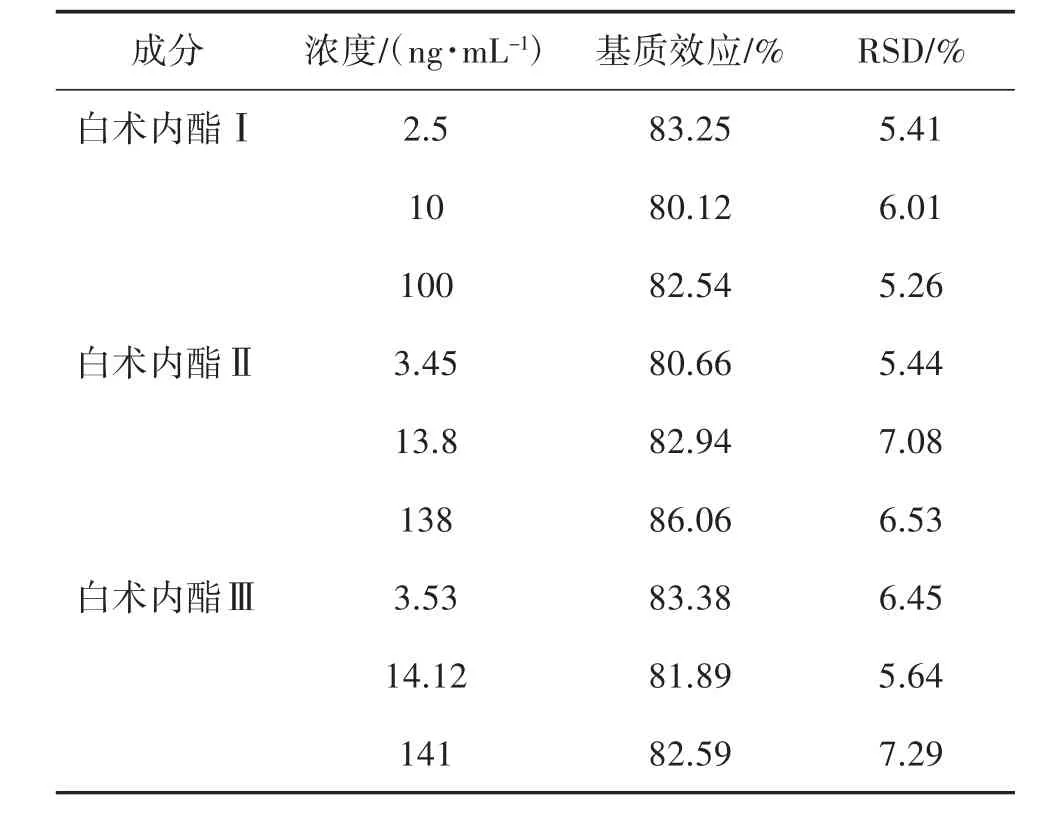
表3 白术内酯I、II、III的基质效应(n=6)
2.6 提取回收率 取空白血浆,按“1.4.4”项下处理后,加入低、中、高3个不同浓度的对照品系列工作液,于35℃下N2流吹干,以100 μL乙腈复溶,每个浓度进样6次,记录峰面积A;另取空白血浆,加入低、中、高3个不同浓度的对照品系列工作液,同样按“1.4.4”项下处理后,于35℃下N2流吹干,以100 μL乙腈复溶,每个浓度进样6次,获得相应峰面积值B,计算提取回收率A/B(%),见表4。
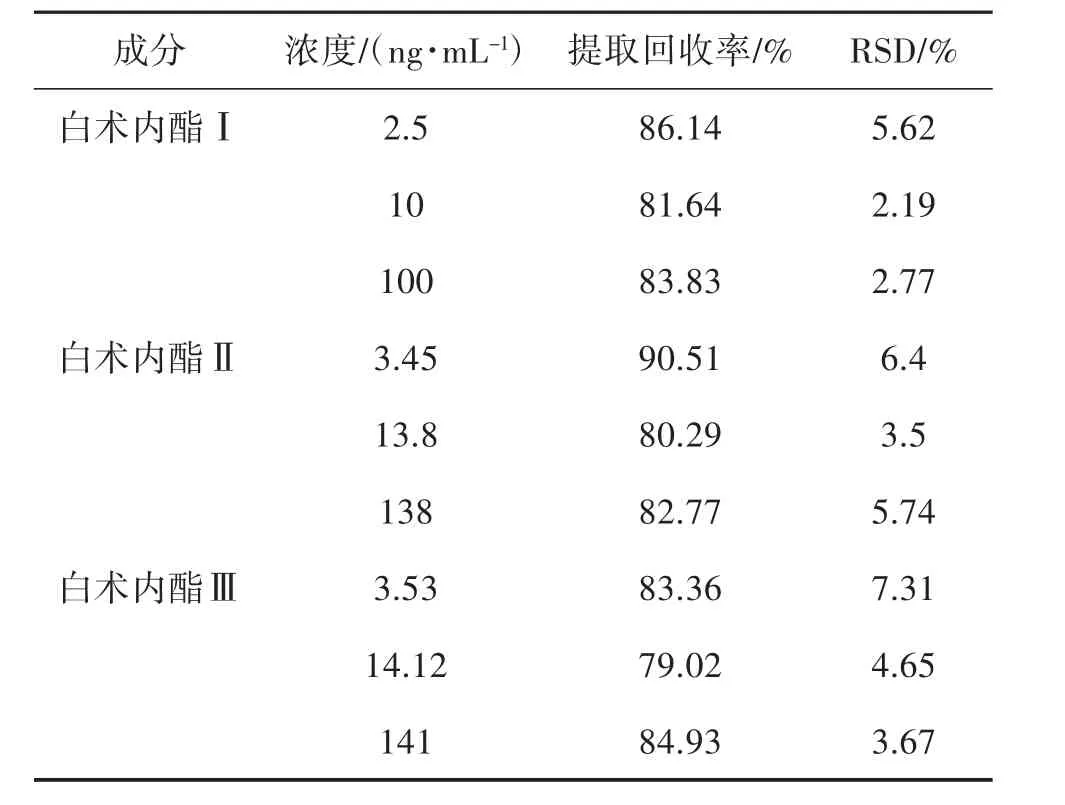
表4 白术内酯I、II、III的提取回收率(n=6)
2.7 稳定性 配制低、中、高3个不同浓度的质控样品,于-20℃冰箱中冷冻1周,室温下解冻后,立即按“1.4.4”项下处理样品后,进样分析,如此重复3次冷冻与解冻过程,考察样品的3次冻融循环稳定性。24 h内重复分析低、中、高3个不同浓度的质控样品,考察样品在进样瓶内的短期稳定性。将配制好的标准样品于 -20℃冰箱中贮存,在第30天取出测定,与样品配制当天所测得的浓度比较,考察样品的长期稳定性,见表5。
表5 白术内酯I、II、III的稳定性(n=6)
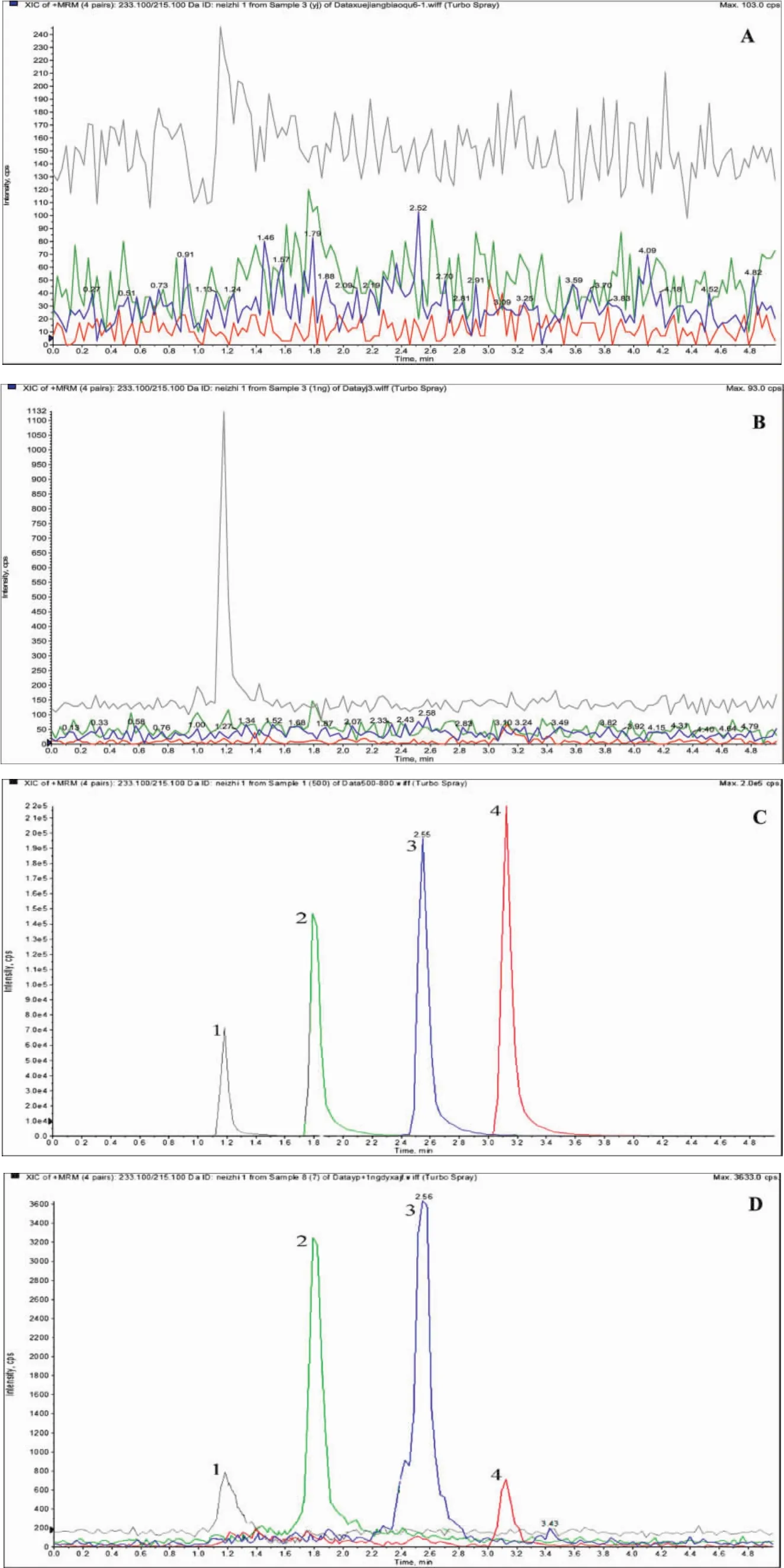
图1 大鼠血浆中白术内酯I、II、III+内标的色谱图
2.8 药动学结果 白术内酯I、II、III的平均血药浓度-时间曲线见图2。白术内酯I、II、III入血吸收较快,在0.0833 h即可检测到,在血浆中可以持续12 h左右;白术内酯I、II成分的首次达峰时间点接近,都在0.5 h左右,白术内酯III成分达峰时间在1 h。
比较表6-1、6-2、6-3发现随着给药剂量的增加,大鼠体内血浆中白术内酯I、II、III的达峰浓度逐渐增加,由图3可以看出白术内酯I、II、III在大鼠体内的AUC0-t和剂量呈正相关。
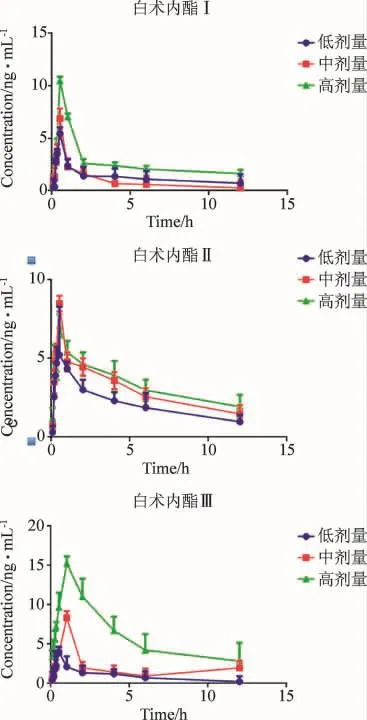
图2 大鼠体内白术内酯I、II、III的药-时曲线

表6-1 低剂量组白术内酯I、II、III的药代动力学参数(n=6)

表6-2 中剂量组白术内酯I、II、III的药代动力学参数(n=6)

表6-3 高剂量组白术内酯I、II、III的药代动力学参数(n=6)
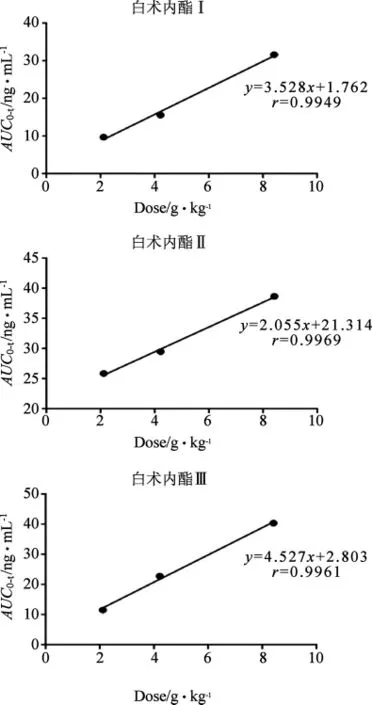
图3 大鼠体内白术内酯I、II、III的AUC0-t和剂量之间的关系
3 讨论
课题组前期已对不同产地的白术进行指纹图谱和含量测定[15],结合实验结果对白术进行分析,综合评分发现祁门产地的白术质量明显优于其它产地。相关文献报道,白术中白术内酯类成分具有改善胃肠功能[16]、抗炎[17]和抗肿瘤[18-19]等作用,大剂量白术水煎剂能促进胃肠运动[20],而且随着剂量的增加作用也增强。因此,本研究通过对报道的白术内酯的药代动力学检测方法进行改进,建立了一个灵敏、快速、可靠的UPLC-MS/MS法,并验证了该方法可以定量大鼠血浆中白术内酯 I、II、III的浓度。
在药代动力学实验中,对于生物样品的处理考察了乙腈沉淀蛋白和乙酸乙酯萃取两种方法,由于白术入血后的浓度极低,故选择通过乙酸乙酯萃取后浓缩复溶法处理生物样品。药动学实验结果可看出,白术内酯在5 min内即可检测到,吸收快、达峰时间长、半衰期长,AUC与剂量呈线性关系,随剂量的增大而增大。
此课题研究还存在一定的局限性,首先是药物作用机制不明确,其次是未能将白术内酯I、II、III的药代动力学与药效学相结合。白术内酯I、II、III的作用机制与发挥健脾益气功效的联系还需要进一步深入研究。
