傣痛消乙醇提取物对高尿酸血症小鼠及痛风性关节炎大鼠的影响*
2020-11-20张光云赵丽娟刘中勇陈胤峰何昕徽王庆淑骆始华
张光云,张 超,赵丽娟,李 易,刘中勇,陈胤峰,何昕徽,王庆淑,陈 普,骆始华△
(1.云南中医药大学云南省傣医药与彝医药重点实验室,云南 昆明 650500;2.云南中医药大学第一附属医院,云南 昆明 650021;3.江西中医药大学附属医院,江西 南昌 3300043)
痛风是由嘌呤代谢紊乱和(或)尿酸在体内堆积过度导致尿酸盐结晶沉淀而引起的临床综合征。临床表现为高尿酸血症及尿酸盐沉积所致反复发作的急、慢性关节炎和软组织损伤,甚至尿酸性肾结石所致的痛风性肾病[1]。随着人们生活水平的提高和饮食结构的改变,痛风的发病率呈升高趋势[2]。傣医学将高尿酸血症和痛风称为“拢蒙沙喉”,主要病因为患者平素喜食香燥性热醇酒厚味之品,积热于内,郁久化热,导致体内四塔功能失调,塔拢(风)偏盛,塔拎(土)壅塞,加之感受外在的冷热病邪,内外相合,阻滞气血使之运行不畅,导致水塔受伤,水不制火,风火偏盛,风夹病邪留滞肢体关节不通而致[3]。“傣痛消”是傣医治疗“拢蒙沙喉”(高尿酸血症和痛风)的有效验方,由“油麻”和“麦别”2味傣药组成,具有调节四塔、除风止痛、清火解毒、行血利水的功效[4]。课题组前期研究显示“傣痛消”具有治疗痛风的作用,但在临床使用过程中发现,采用传统的水煎煮提取法会有部分脂溶性物质漂在水煎液上,导致临床疗效有所差异,推测是由于脂溶性成分提取不完全所致[5]。因此,本研究采用95%的乙醇作为溶剂对傣痛消进行提取,以高尿酸血症小鼠及痛风性关节炎大鼠为动物模型,对傣痛消乙醇提取物防治痛风进行初步研究。
1 材料与方法
1.1 实验动物 清洁级昆明种小鼠60只,雌雄各半,体质量(20±2)g;清洁级 Wistar大鼠 60 只,雌雄各半,体质量(200±20)g,均由昆明医科大学实验动物学部提供,生产许可证号:SCXK(滇)k2015-0002。动物饲养于云南中医药大学医鉴甲楼动物房,温度(22±2)℃,湿度 40%~60%,通风,每日光照约 12 h,环境清洁,自由饮食和摄水。动物饲养和实验均符合《医学实验动物管理实施细则》要求和云南中医药大学动物伦理委员会的相关规定。
1.2 试剂与仪器 酵母(英国OXOID公司,批号1173143);苯溴马隆(宜昌长江药业有限公司,批号:1108003);尿酸钠(美国 Sigma公司,批号:BCBF1330V);秋水仙碱片(昆明制药集团股份有限公司,批号:11BF);UA、XOD、CRE、BUN 试剂盒均购买于南京建成生物工程研究所;IL-6、TNF-α、IL-1β试剂盒均购买于武汉华美生物科技有限公司。Infinite M200 PRO酶标仪(瑞士Tecan公司);HW-80A旋涡混合器(上海精科实业有限公司);微量移液器(eppendorf公司);ME104E/02电子天平(梅特勒-拖利多仪器(上海)有限公司);低温高速冷冻离心机(Thermo公司)。
1.3 实验方法
1.3.1 药物制备 傣痛消乙醇提取物由云南省傣医药与彝医药重点实验室提供。根据传统已有配方及剂量,取1.2 kg生药分3次提取:第1次按8倍量95%乙醇,连续回流提取30 min后过滤;第2次按6倍量95%乙醇,连续回流提取20 min后过滤;第3次按4倍量95%乙醇,连续回流提取15 min后过滤,合并全部滤液,置于蒸发容器内,采用蒸发浓缩的方法,得浸膏即为傣痛消乙醇提取物,生药含量为4 g/mL。
1.3.2 高尿酸血症小鼠模型制备及给药 选取60只小鼠随机分为正常对照组、模型组、苯溴马隆组、傣痛消乙醇提取物低、中、高剂量组,每组10只。除正常对照组外,模型组及各药物组小鼠均于每日清晨按30 g/kg酵母进行灌胃造模,正常对照组小鼠给予等容量的蒸馏水,持续7 d[6]。傣痛消乙醇提取物低、中、高剂量组在造模第4天分别以2.6、7.8、23.4 g/kg灌胃给药,正常对照组和模型组分别给予等体积蒸馏水;苯溴马隆组在造模第6天以0.02 g/kg灌胃给药,每日1次,连续干预4 d。末次给药1 h后,摘眼球取血,37℃水浴中静置至分层后,3 000 r/min离心15 min,取血清备用。
1.3.3 急性痛风性关节炎大鼠模型制备及给药 选取60只大鼠随机分为正常对照组、模型组、秋水仙碱组、傣痛消乙醇提取物低、中、高剂量组,每组10只。在造模前5 d傣痛消乙醇提取物低、中、高剂量组分别以1.8、5.4、16.2 g/kg的剂量灌胃给药;秋水仙碱组在造模前3 d以0.28 mg/kg秋水仙碱灌胃给药;正常对照组和模型组分别给予等体积蒸馏水;每日1次。在末次给药1 h后,根据Coderre造模方法[7],模型组及各药物组大鼠麻醉后,以右侧后肢踝关节后侧为穿刺点插入,针口斜面朝前上方与胫骨成45°夹角刺入踝关节腔,以6号针头将100 g/L的尿酸钠溶液(总体积为0.15 mL)注入关节腔,以关节囊对侧鼓起为注入标准,复制急性痛风关节炎模型,正常对照组大鼠使用相同的方法注射无菌生理盐水。造模5 h后麻醉大鼠,腹主动脉取血,37℃水浴中静置至分层后,3 000 r/min离心15 min,取血清备用。
1.3.4 血清生化指标检测 分别使用不同的试剂盒检测小鼠和大鼠血清中 UA、XOD、CRE、BUN、IL-6、TNF-α和IL-1β的水平,检测过程按试剂盒说明书进行。观察急性痛风性关节炎大鼠模型局部关节的变化并使用2~3 mm宽纸条和游标卡尺测量造模前1 h和造模后1、3、5 h关节周径,计算关节肿胀指数,肿胀指数=[(测定时间点关节周径-初始周径)/初始周径]×100%。
1.4 统计学分析
2 结果
2.1 傣痛消乙醇提取物对高尿酸血症小鼠血清生化指标的影响 与正常对照组比较,模型组小鼠UA、XOD、CRE、BUN、IL-6、TNF-α、IL-1β 水平均明显升高(P<0.05),说明高尿酸血症动物模型复制成功。与模型组比较,傣痛消乙醇提取物低剂量组对CRE改善不明显,其余各药物组UA、XOD、CRE、BUN、IL-6、TNF-α、IL-1β 均有不同程度的降低(P<0.05),提示傣痛消乙醇提取物能降低高尿酸血症小鼠体内的尿酸水平,并且具有改善肾功能和抗炎作用,见表 1、表 2。
表1 傣痛消乙醇提取物对高尿酸血症小鼠UA、XOD、CRE、BUN的影响(±s,n=10)
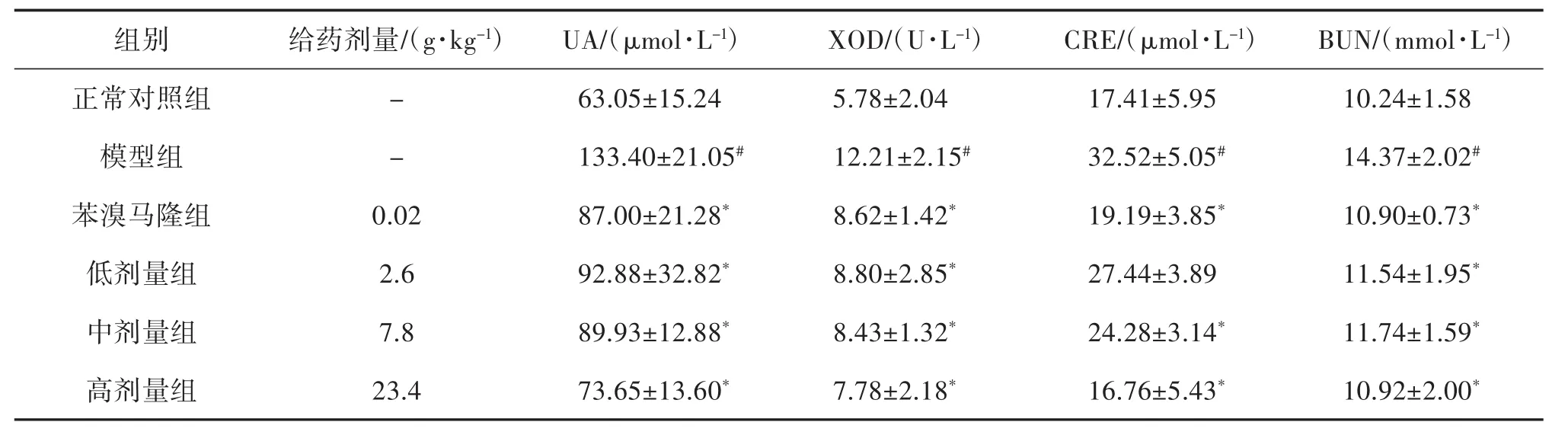
表1 傣痛消乙醇提取物对高尿酸血症小鼠UA、XOD、CRE、BUN的影响(±s,n=10)
注:与正常对照组比较,#P<0.05;与模型组比较,*P<0.05。
组别给药剂量/(g·kg-1)UA/(μmol·L-1)XOD/(U·L-1)CRE/(μmol·L-1)BUN/(mmol·L-1)正常对照组 - 63.05±15.24 5.78±2.04 17.41±5.95 10.24±1.58模型组 - 133.40±21.05# 12.21±2.15# 32.52±5.05# 14.37±2.02#苯溴马隆组 0.02 87.00±21.28* 8.62±1.42* 19.19±3.85* 10.90±0.73*低剂量组 2.6 92.88±32.82* 8.80±2.85* 27.44±3.89 11.54±1.95*中剂量组 7.8 89.93±12.88* 8.43±1.32* 24.28±3.14* 11.74±1.59*高剂量组 23.4 73.65±13.60* 7.78±2.18* 16.76±5.43* 10.92±2.00*
表2 傣痛消乙醇提取物对高尿酸血症小鼠IL-6、TNF-α、IL-1β的影响(±s,n=10)

表2 傣痛消乙醇提取物对高尿酸血症小鼠IL-6、TNF-α、IL-1β的影响(±s,n=10)
注:与正常对照组比较,#P<0.05;与模型组比较,*P<0.05。
组别给药剂量/(g·kg-1)IL-6/(pg·mL-1)TNF-α/(pg·mL-1)IL-1β/(pg·mL-1)正常对照组 - 26.31±3.66 19.67±8.56 23.83±1.32模型组 - 34.41±8.26# 35.89±6.27# 30.85±8.49#苯溴马隆组 0.02 27.36±3.65* 20.65±5.71* 25.01±2.00*低剂量组 2.6 27.19±2.42* 19.65±4.39* 24.97±0.94*中剂量组 7.8 26.12±3.67* 24.48±9.09* 24.99±3.27*高剂量组 23.4 25.38±4.93* 19.62±2.43* 22.79±3.47*
2.2 傣痛消乙醇提取物对急性痛风性关节炎大鼠关节肿胀情况的影响 造模后正常对照组大鼠未见行为异常,右踝关节未见红肿和肤温变高;而模型组及各药物组大鼠出现躁动不安、右足抬高、局部红肿、肤温变高的情况,其中模型组比其他药物组更明显。比较各组大鼠的关节肿胀指数后发现,造模后各药物组关节肿胀指数均较模型组低,其中以造模后3 h和5 h降低显著(P<0.05),提示秋水仙碱和傣痛消乙醇提取物具有抗炎作用,见表3。
表3 傣痛消乙醇提取物对急性痛风性关节炎大鼠关节肿胀指数的影响(±s,n=10)
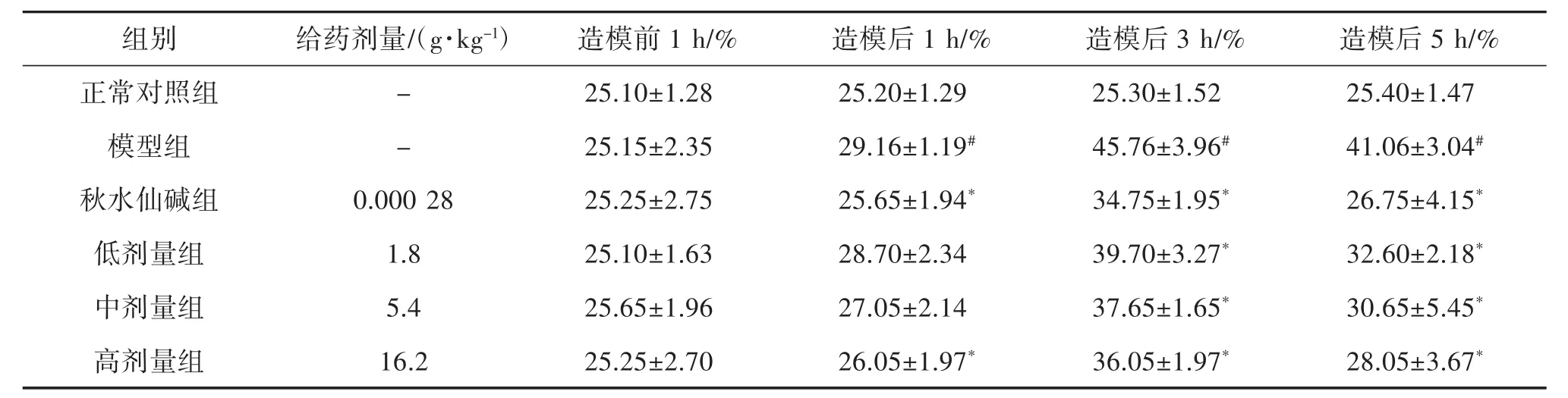
表3 傣痛消乙醇提取物对急性痛风性关节炎大鼠关节肿胀指数的影响(±s,n=10)
注:与正常对照组比较,#P<0.05;与模型组比较,*P<0.05。
组别给药剂量/(g·kg-1)造模前1 h/%造模后1 h/%造模后3 h/%造模后5 h/%正常对照组 - 25.10±1.28 25.20±1.29 25.30±1.52 25.40±1.47模型组 - 25.15±2.35 29.16±1.19# 45.76±3.96# 41.06±3.04#秋水仙碱组 0.000 28 25.25±2.75 25.65±1.94* 34.75±1.95* 26.75±4.15*低剂量组 1.8 25.10±1.63 28.70±2.34 39.70±3.27* 32.60±2.18*中剂量组 5.4 25.65±1.96 27.05±2.14 37.65±1.65* 30.65±5.45*高剂量组 16.2 25.25±2.70 26.05±1.97* 36.05±1.97* 28.05±3.67*
2.3 傣痛消乙醇提取物对急性痛风性关节炎大鼠血清生化指标的影响 与正常对照组比较,模型组UA、XOD、CRE、BUN、IL-6、TNF-α、IL-1β 水平均明显升高(P<0.05),说明急性痛风性关节炎大鼠模型复制成功。与模型组比较,傣痛消乙醇提取物低剂量组对UA、CRE、IL-6和TNF-α改善不明显,其余药物组 UA、XOD、CRE、BUN、IL-6、TNF-α、IL-1β 的水平均不同程度降低(P<0.05),提示傣痛消乙醇提取物对急性痛风性关节炎大鼠模型具有一定的防治作用,见表 4、表 5。
表4 傣痛消乙醇提取物对急性痛风性关节炎大鼠UA、XOD、CRE、BUN的影响(±s,n=10)
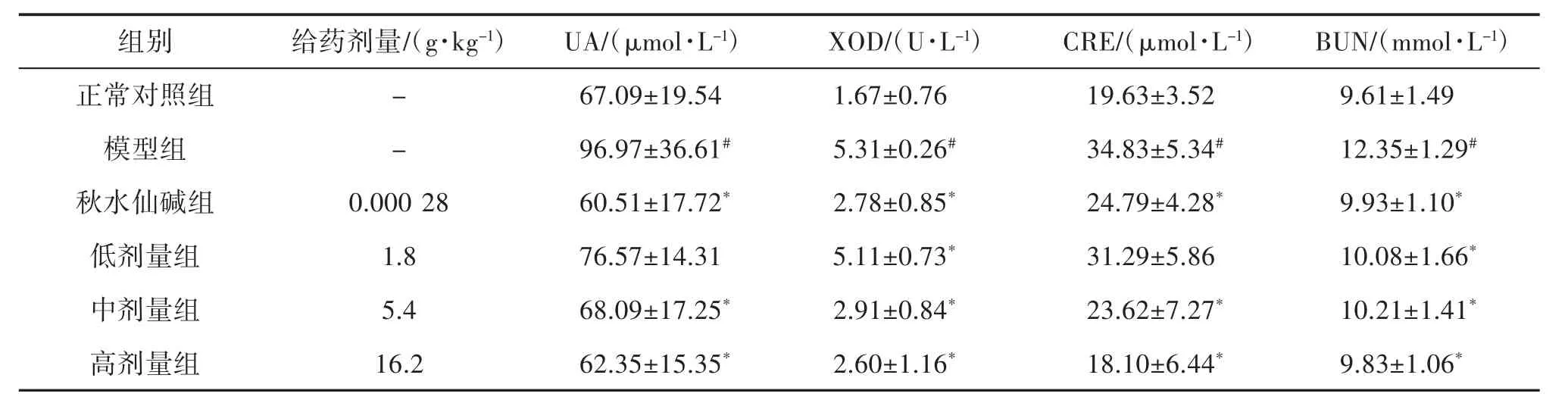
表4 傣痛消乙醇提取物对急性痛风性关节炎大鼠UA、XOD、CRE、BUN的影响(±s,n=10)
注:与正常对照组比较,#P<0.05;与模型组比较,*P<0.05。
组别给药剂量/(g·kg-1)UA/(μmol·L-1)XOD/(U·L-1)CRE/(μmol·L-1)BUN/(mmol·L-1)正常对照组 - 67.09±19.54 1.67±0.76 19.63±3.52 9.61±1.49模型组 - 96.97±36.61# 5.31±0.26# 34.83±5.34# 12.35±1.29#秋水仙碱组 0.000 28 60.51±17.72* 2.78±0.85* 24.79±4.28* 9.93±1.10*低剂量组 1.8 76.57±14.31 5.11±0.73* 31.29±5.86 10.08±1.66*中剂量组 5.4 68.09±17.25* 2.91±0.84* 23.62±7.27* 10.21±1.41*高剂量组 16.2 62.35±15.35* 2.60±1.16* 18.10±6.44* 9.83±1.06*
表5 傣痛消乙醇提取物对急性痛风性关节炎大鼠IL-6、TNF-α、IL-1β的影响(±s,n=10)
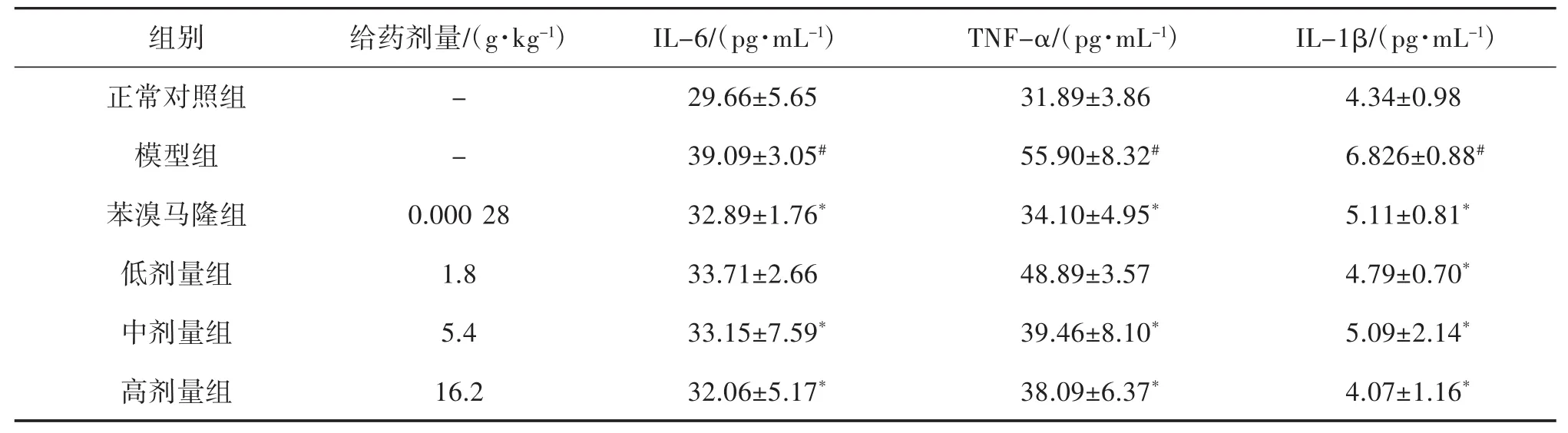
表5 傣痛消乙醇提取物对急性痛风性关节炎大鼠IL-6、TNF-α、IL-1β的影响(±s,n=10)
注:与正常对照组比较,#P<0.05;与模型组比较,*P<0.05。
组别给药剂量/(g·kg-1)IL-6/(pg·mL-1)TNF-α/(pg·mL-1)IL-1β/(pg·mL-1)正常对照组 - 29.66±5.65 31.89±3.86 4.34±0.98模型组 - 39.09±3.05# 55.90±8.32# 6.826±0.88#苯溴马隆组 0.000 28 32.89±1.76* 34.10±4.95* 5.11±0.81*低剂量组 1.8 33.71±2.66 48.89±3.57 4.79±0.70*中剂量组 5.4 33.15±7.59* 39.46±8.10* 5.09±2.14*高剂量组 16.2 32.06±5.17* 38.09±6.37* 4.07±1.16*
3 讨论
课题组前期研究[4]发现复制高尿酸血症模型使用酵母造模具有造价低、重复性好、模型稳定、时效长、肾功能损害较轻等优点,其机制与人类的发病机制较为接近。另外,尿酸钠结晶注入关节腔引起的急性痛风性关节炎动物模型也是一个既成熟又经典的造模方法,该方法成功率极高、快速且简单[8]。因此,本实验分别采用了酵母诱导高尿酸血症小鼠模型和尿酸钠结晶注入关节腔引起的急性痛风性关节炎大鼠模型来观察傣痛消乙醇提取物对痛风的影响。实验结果显示,与正常对照组比较,模型组UA、XOD、CRE、BUN、IL-6、TNF-α、IL-1β 水平均显著升高(P<0.05),其中急性痛风性关节炎大鼠出现躁动不安、右足抬高、局部红肿、肤温变高和关节肿胀指数显著增加的情况,表明酵母诱导高尿酸血症小鼠模型及尿酸钠注入关节腔引起的急性痛风性关节炎大鼠模型造模成功。
高尿酸血症和尿酸盐结晶沉淀是痛风的重要临床特征,高尿酸血症是痛风的重要病理基础,且高尿酸血症与高血压、脂代谢紊乱、糖尿病、向心性肥胖、心脑血管疾病密切相关,长期高尿酸血症会导致肾功能受损而发展为痛风性肾病[9-10]。痛风性关节炎是一种尿酸钠结晶沉淀在关节腔中引起的非特异性炎症反应,其过程复杂,与机体抗炎免疫密切相关[11]。因此,通过观察机体内尿酸代谢、肾功能及炎症的相关指标可以较好的评价药物对痛风的防治作用。
UA是临床上诊断高尿酸血症和痛风的指标之一,XOD是一种重要的嘌呤代谢酶,可催化次黄嘌呤转化为黄嘌呤,再进一步催化黄嘌呤产生尿酸[12]。CRE和BUN是反应肾小球滤过率的两项主要指标[13],尿酸盐在肾间质和肾小管沉积,影响肾小球血管网及细小动脉,最终导致肾功能损伤[14],积极防止尿酸对肾功能的损害是防治高尿酸血症和痛风的主要机制之一。实验研究表明,傣痛消乙醇提取物干预后,高尿酸血症小鼠和急性痛风性关节炎大鼠血清中UA、XOD、CRE和BUN的水平均明显下降,提示傣痛消乙醇提取物对高尿酸血症和急性痛风性关节炎具有降尿酸和改善肾功能的作用。
细胞炎症因子的表达在高尿酸血症及痛风发病机制中起着关键作用[15]。同时,尿酸也可直接刺激单核细胞释放 IL-1、IL-6和TNF-α等炎性因子[16]。IL-1β作为IL-1的一种多肽类型,其与IL-1β受体结合,可触发炎性转录因子,导致中性粒细胞进入关节等尿酸盐沉积部位,进而诱发痛风的炎症发生过程,引起局部的关节破坏并出现红肿热痛[17]。IL-6是炎性反应细胞因子网络中的中枢性调节因子;TNF-α是介导炎症反应及免疫调节反应的重要前炎性细胞因子,也是体内炎症反应和一系列生理病理过程的重要递质,IL-6和TNF-α均具有广泛的生物学活性,且与血液中的尿酸呈正相关[18]。实验结果显示傣痛消乙醇提取物干预后,高尿酸血症小鼠和急性痛风性关节炎大鼠血清中 IL-6、IL-1β、TNF-α水平均不同程度的降低,药物组急性痛风性关节炎大鼠局部关节肿胀情况较模型组改善明显,提示傣痛消乙醇提取物对高尿酸血症和急性痛风性关节炎具有抗炎作用。
综上所述,傣痛消乙醇提取物对高尿酸血症和急性痛风性关节炎具有降尿酸、改善肾功能和抗炎作用。如果开发成傣医常用的院内制剂可以考虑用95%的乙醇进行提取,既可以保证脂溶性成分的提出,又可以保证制剂的有效性。该研究为傣痛消的进一步深入研究提供科学依据,为民族药新药的研发提供科学依据和基础性资料。
