先天性心脏病患儿行体外循环心脏手术围术期死亡危险因素分析
2020-11-20崔晓征沈冬炎邹鹏詹雨李永超杨栩鹏
崔晓征,沈冬炎,邹鹏,詹雨,李永超,杨栩鹏
先天性心脏病(congenital heart disease,CHD)是胎儿心脏血管发育异常形成的心血管畸形,是我国最常见的先天性疾病之一,在新生儿中其发病率可高达7.5%,其中中、重度CHD发病率约为0.6%,同时具有较高的致残率和病死率[1]。手术是目前治疗复杂CHD 的主要手段,尽管手术方案已逐渐成熟,但新生儿心脏手术的早期病死率仍较高,研究报道的手术治疗总体病死率9.96%[2]。围术期积极识别危险因素可以早期有效地对患儿的生理、病理情况进行评估,加强围术期监测和管理,有利于减少并发症及病死率。影响婴幼儿CHD高病死率的危险因素很多,以往研究显示,年龄、手术复杂程度、体外循环时间、术后出血等均可能是其危险因素,但某些因素的影响机制和处理措施尚不明确[3-5]。由于体外循环心脏手术需将静脉血引至体外处理后再输送回体内动脉,可能更易造成患儿血流动力学的不稳定,引起缺血再灌注损伤[6]。因此本研究对行体外循环心脏手术的CHD患儿围术期死亡因素进行分析,以期为日常临床工作提供参考和指导,报道如下。
1 资料与方法
1.1 临床资料 收集北京清华长庚医院、中国人民解放军总医院第三分院和河北医科大学第一医院2018年1月—2019年12月收治的行体外循环开放手术的CHD患儿350例资料,男192例,女158例,患儿平均年龄(15.56± 9.42)个月;ASA分级:Ⅱ级7例,Ⅲ级292例,Ⅳ级51例;RACHS-1分级:1级11例,2级244例,3级47例,4级37例,5级7例,6级4例;手术方式:室间隔缺损修补术238例,房间隔缺损修补术45例,法洛四联症矫治术23例,大动脉调转术13例,肺静脉异位引流矫治术11例,右室双出口矫治术4例,双向格林术(bidirectional Glenn procedure)、房室共同通道矫治术各3例,三尖瓣下移畸形矫治术2例,其他8例。本研究通过各医院伦理委员会批准,所有入选研究的CHD患儿家属均知情同意并签署知情同意书。
1.2 纳入及排除标准 纳入标准:(1) 根据美国胸外科医师学会(STS)/欧洲心胸外科学会(EACTS)先天性心脏病手术命名和数据库工程相关标准[7-8],呼吸困难、心脏异常杂音等临床症状体征,进一步结合心电图、心脏彩色超声、胸部X线片、心脏CT等检查综合评定确诊为CHD;(2) 年龄8~65个月;(3)符合相关手术指征,初次接受心脏手术;(4) 均于体外循环下开放手术治疗矫正畸形。排除标准:(1)未能成功完成手术者;(2)病例资料不完整。
1.3 治疗方法
1.3.1 手术风险评估:(1)美国麻醉医师学会(American college of anesthesiologists,ASA)分级:评估患者在接受需要进行麻醉的外科手术时的医疗风险。Ⅰ级:无系统性疾病患者;Ⅱ级:轻度系统性疾病,无功能受限;Ⅲ级:重度系统性疾病,有一定的功能受限;Ⅳ级:重度系统性疾病,终身需要不间断的治疗;Ⅴ级:濒死患者,不论手术与否,在 24 h 内不太可能存活。(2)先天性心脏病手术风险分级评估(risk adjustment classification for congenital heart surgery,RACHS-1)分级,在先天性心脏缺陷复杂性的基础上比较手术难度及风险的分级系统,根据手术难度分为6个级别,难度随级别递增。1级:房间隔纠治术、主动脉固定术;2级:房间隔、室间隔修补术,法洛四联症根治术等;3级:主动脉瓣置换术、体肺分流术;4级:大动脉换位手术、Rastelli手术;5级:永存动脉干纠治术、主动脉弓离断、三尖瓣移位术(<30 d);6级:Norwood手术、左心室发育不全综合征一期姑息术等。
1.3.2 麻醉方案:所有患儿均于术前30 min 静脉给予预防性抗生素,常规使用头孢替安预防感染,对头孢类药物过敏者使用克林霉素。麻醉诱导予以咪达唑仑0.05~0.1 mg/kg,罗库溴铵0.6 mg/kg,舒芬太尼0.2 μg/kg,1岁以上儿童丙泊酚2~3 mg/kg。诱导后插管行机械通气,潮气量8~10 ml/kg,根据术中呼气末二氧化碳调整呼吸参数,维持在30~40 mmHg范围内。术中持续泵注舒芬太尼和罗库溴铵维持,间断追加七氟烷。术中监测鼻咽温度和肛温,桡动脉或股动脉置管监测动脉压,颈内静脉置双腔管监测中心静脉压。
1.3.3 体外循环方法:体外循环采用德国JostraHL20型人工心肺机,预充液中以胶体为主,心肌保护液采用 HTK液或冷晶体St.Thomas液,必要时加入甘露醇、白蛋白或血制品,釆用滚压泵及微孔中空纤维式膜式氧合器均经主动脉根部灌注。手术过程中根据患儿情况控制流量2.0~3.0 L/m2,平均动脉压30~50 mmHg,温度18~37℃,术中监测以保持红细胞压积≥25%,上腔静脉血氧饱和度≥65%。心内缺损使用Gore-tex 补片修补,脱机时给予必要剂量的心血管活性药物。脱机后常规进行血液超滤,术后常规静脉给予鱼精蛋白以中和肝素。
1.4 观察指标与方法 (1)收集所有患儿基本资料(性别、年龄、体质量,是否伴有心功能不全、气道发育不全、紫绀和肺动脉高压)。(2)根据ASA分级[9]和RACHS-1分级[10]对手术风险进行评估。(3)所有患儿术前抽取空腹静脉血液样本,采用美思康MC6600型全自动生化分析仪检测血清白蛋白(ALB)、血红蛋白(Hb)、丙氨酸氨基转氨酶(ALT)、血肌酐(SCr)和尿素氮(BUN)。(4)术中记录手术时间、麻醉时间、体外循环时间、主动脉阻断时间、尿量、输血量、最低红细胞压积和最低温度。术后记录机械通气时间和ICU治疗天数。
1.5 终点事件判定 以研究对象术后死亡作为观察终点,参考STS和EACTS对手术死亡的定义:手术30 d内院内或院外的死亡。因经济原因或病情加重家属放弃治疗,估计放弃治疗后生存几率不大的患儿也判定为死亡。

2 结 果
2.1 患儿总体生存情况 350例患儿中,手术成功并存活323例(92.29%),死亡27例(7.71%)。死亡病例中前3种疾病类型分别为大动脉转位9例(33.33%),房室间隔缺损8例(29.63%),法洛四联症6例(22.22%)。死亡原因主要为心肺相关原因24例(88.89%),感染原因2例(7.41%),其他原因1例(3.70%)。总体生存曲线见图1。
2.2 2组患儿基本信息比较 根据患儿预后情况将所有CHD手术患儿分为存活组和死亡组,比较2组患儿的基本临床资料,与存活组患儿相比,死亡组患儿体质量较低,多伴有紫绀症状,且ASA分级和RACHS-1分级较高,差异均具有统计学意义(P<0.01或P<0.05),见表1。
2.3 2组患儿围手术期相关指标比较 与存活组患儿相比,死亡组患儿术前血肌酐水平和术中最低温度较低,术中输血量更高,且手术时间、体外循环时间、主动脉阻断时间、术后机械通气时间和ICU治疗天数均长于存活组,差异均具有统计学意义(P<0.01),见表2。
2.4 CHD患儿围术期死亡的独立危险因素 以CHD患儿死亡作为因变量,将上述比较差异有统计学意义的因素作为自变量,纳入多因素Logistic 回归分析模型,ASA分级、RACHS-1分级、紫绀、体外循环时间、术中输血量均是CHD患儿围术期死亡的独立危险因素(P<0.05),其他因素未能进入Logistic回归模型,见表3。
2.5 连续变量分层结果 决策树模型分析结果显示,体外循环时间120 min、术中输血量150 ml时预测性更高,对CHD患儿死亡预后的影响更大(P<0.05)。进而对体外循环时间、术中输血量水平进行分层,体外循环时间分为<120 min和≥120 min,术中输血量分为<150 ml和≥150 ml,结果显示,体外循环时间≥120 min、术中输血量≥150 ml时是CHD患儿围术期死亡的高危因素,见图2。
3 讨 论
据统计[11],全球每年有12万~15万CHD患儿出生,CHD已成为危害儿童健康的主要疾病。近年来随着我国CHD外科手术治疗方案的逐步完善和围手术期护理的进步,早期手术干预可以减少患儿心力衰竭的发生,但术后早期病死率仍较高。本研究中CHD患儿术后30 d病死率为7.71%,与以往研究(9.96%)基本一致[2]。其中死亡排名前3名的疾病分别是大动脉转位、房室间隔缺损和法洛四联症。大动脉转位患儿可存在右心房—左心室—肺动脉连接或左心房—右心室—主动脉连接等情况,包括矫正性大动脉转位和完全性大动脉转位。单纯大动脉转位者较少见,多合并有室间隔缺损、房间隔缺损或瓣膜发育不良等情况。房室间隔缺损也称为心内膜垫缺损或房室通道缺损,是胚胎期由于心室流入道的心内膜垫融合过程中的发育障碍所致。法洛四联症是一种发绀型先天性心脏病,包括右心室流出道狭窄、室间隔缺损、主动脉骑跨、右心室肥厚[12]。Van 等[13]指出法洛四联症、完全性大动脉转位、永存动脉干、右心室双出口和左心发育不良综合征是五大最常见的严重先天性心脏病,不仅预示着患儿术前自身状况,也决定了手术的复杂程度。因而本研究中占比前三位的死亡类型可能与手术的复杂程度存在一定的关联。

注:A.CHD患儿总体生存曲线;B.围术期死亡患儿总体生存曲线

表1 2组患儿基本资料比较 [例(%)]

表2 2组患儿围手术期相关指标比较
本研究还纳入了某些可能引起CHD患儿术后死亡的围手术期因素进行分析,发现ASA分级≥Ⅲ级、RACHS-1分级≥3级、体外循环时间≥120 min、术中输血量≥150 ml并伴有紫绀均是CHD患儿死亡的独立危险因素。ASA分级作为麻醉医生评估患者病情严重程度的指标,能在一定程度上反映患者的预后。Wang等[14]研究发现,ASA分级≥Ⅲ级是小儿各类手术中围术期死亡的主要危险因素。RACHS-1 分级是评估儿童心脏手术最常用的标准之一,在小样本研究中可预测住院病死率和重症监护病房停留时间,同时也能适应治疗上的巨大差异,可预测大型多数据库中住院病死率[15]。Shiyovich等[16]在一项大型CHD研究中也发现RACHS-1分级4~6 级手术只占13.2%,但病死率却占40. 3%,表明RACHS-1分级越高,手术越复杂、死亡风险也相应越高。因而ASA分级和RACHS-1分级可作为术前预测患儿死亡风险的指标。
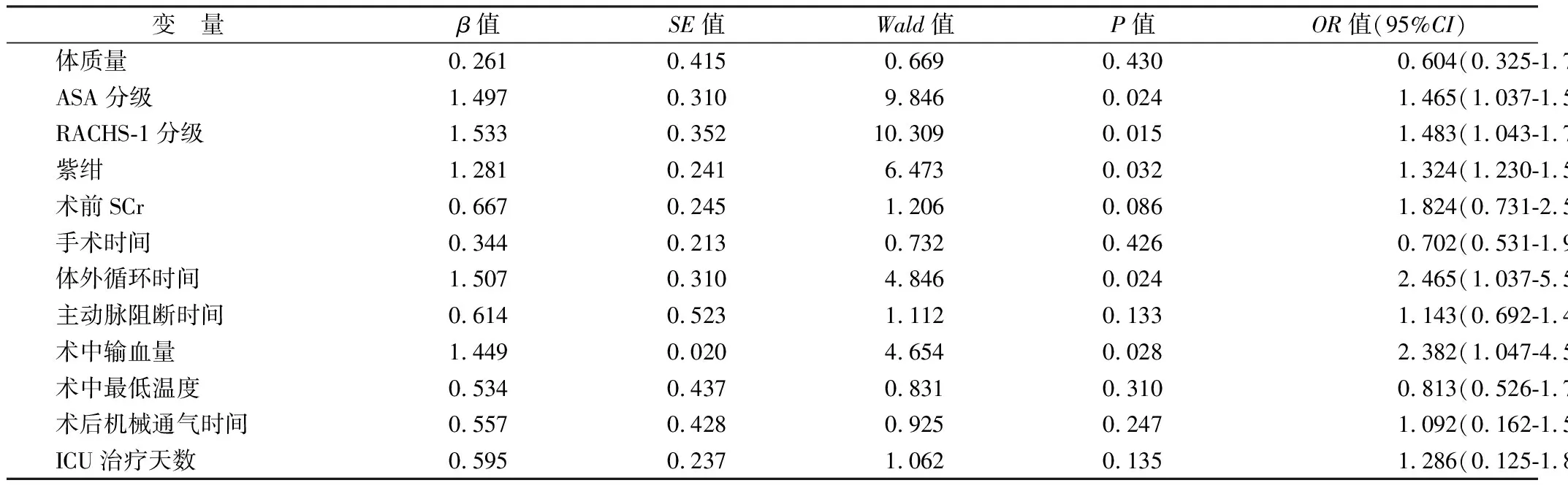
表3 CHD患儿围术期死亡危险因素的多因素Logistic回归分析

注:A节点表示体外循环时间,体外循环时间≥120 min对CHD患儿围术期死亡的影响更大;B节点表示术中输血量,术中输血量≥150 ml对CHD患儿围术期死亡的影响更大
体外循环时间越长,死亡风险越高。这是由于体外循环可对全身各系统产生影响,易引起缺血缺氧性脑损伤、急性呼吸窘迫综合征,并对肾脏、消化和血液系统均造成干扰和损害。此外,Tai等[17]研究发现,体外循环时间延长还会引起机械通气时间、ICU住院时间的延长,这些因素也能够增加患儿病死率。主动脉阻断时间延长往往提示手术复杂程度较高,对患儿术后血流动力学状态影响也更明显,同时还会增加术后低心排血量综合征、心律失常和肺部感染等并发症风险[18]。因而,尽可能缩短体外循环时间和主动脉阻断时间有助于降低围术期病死率。
Gordan等[19]研究显示,输血会伴随着体内铁负荷加重,催化氧自由基产生,引发氧化应激反应。输血还存在免疫调节作用,体外循环中血液与人工材料的接触使血液中的组分被激活并相互作用分泌大量炎性介质,使机体处于促炎状态。同时体外循环时心肺仍面临缺血再灌注损伤,导致白细胞激活,炎性介质产生,随主动脉进入体循环使疾病加重。Patel等[20]研究发现,体质量越小的患儿出血风险越高,对输血需求更大,同时低体质量患儿大动脉转位、完全性肺静脉异位引流、肺动脉闭锁合并室间隔缺损病死率均更高,提示低体质量患儿输血量大可能具有更高的病死率。因此临床应进行术中安全评估,根据患儿具体状况,采用适当的节约用血策略。
本研究中死亡组伴有紫绀的患儿也占有较高比例,紫绀型CHD患儿由于长期处于低血氧内环境,脑部神经元在缺氧、缺血、炎性介质和氧自由基等共同作用下出现代谢障碍、功能异常[21]。因而早期给予适当的神经营养药物,或其他改善脑组织的供氧方法,改善紫绀CHD患儿脑损伤,有利于患儿的术后生存。血肌酐水平降低在一定程度上反映了肾脏功能受损,以往研究显示,成人心脏手术肾功能不全是死亡的独立因素,可能与多器官功能衰竭有关,但在儿童中尚需进一步大样本研究证实。此外,低温可影响血小板及凝血功能,且该效应可持续至ICU,深低温停循环也可引起患儿生理的极度紊乱,因此需要注意术中复温及术后ICU的保温。
总之,本研究发现死亡排名前3的疾病类型分别是大动脉转位、房室间隔缺损和法洛四联症。ASA分级、RACHS-1分级、体外循环时间、术中输血量和伴有紫绀均是患儿死亡的独立危险因素,临床手术中尽可能缩短体外循环时间、主动脉阻断时间,采取适当的节约用血策略同时注意保温,对于紫绀患儿早期还应给予适当的神经营养药物以降低患儿围术期死亡风险,同时可采用ASA分级和RACHS-1分级对患儿围术期死亡风险进行预测。
引起体外循环术后CHD患儿死亡的危险因素众多,本研究只是以单中心研究发现了其中的部分可能危险因素,仍亟待多中心、大样本的临床研究进行论证。
利益冲突:所有作者声明无利益冲突
作者贡献声明
崔晓征:设计研究方案,实施研究过程,论文撰写,论文修改;沈冬炎:实施研究过程;邹鹏、詹雨:提出研究思路,分析试验数据,论文审核;李永超、杨栩鹏:资料搜集整理,进行统计学分析
