子宫非典型息肉样腺肌瘤49例临床分析
2020-11-20郭银树
王 欣 金 佟 郭银树
(首都医科大学附属北京妇产医院妇科微创中心,北京 100006)
子宫非典型息肉样腺肌瘤(atypical polypoid adenomyoma,APA)是一种罕见的子宫腔内息肉样占位病变,目前临床治疗尚无“金标准”,为进一步探讨治疗方案, 本研究回顾性分析2005年6月~2019年9月我中心诊治49例APA的临床资料,报道如下。
1 临床资料与方法
1.1 一般资料
本组49 例,年龄27~74岁,(46.5±12.1)岁。绝经前34例,绝经后15例。孕次0~5次,(1.9±1.2)次。产次0~3次,(1.2±0.6)次。异常子宫出血40例,包括月经改变29例(月经紊乱11例,经期延长8例,经量增多5例,经间期出血5例),合并不孕9例,痛经2例,下腹痛2例;同房后出血1例;绝经后出血10例。无明显症状,体检超声提示宫内异常回声或子宫内膜非均质增厚7例;阴道流液2例。妇科检查均无明显异常。盆腔超声检查(图1):子宫腔或宫颈管内异常回声29例,内膜增厚或回声不均19例,未提示明显异常1例;超声提示血流信号21例,表现为星点状血流或RI 0.32~0.47。合并症:子宫肌瘤9例,均为壁间肌瘤,直径1.1~3.2 cm,数目1~2个;卵巢良性肿瘤1例,直径3.1 cm;异常子宫出血-排卵障碍10例;原发性高血压12例;糖尿病4例;甲状腺功能亢进3例。有宫腔镜子宫内膜息肉/宫颈息肉切除术史7例,乳癌术后服用枸橼酸托瑞米芬5年1例。
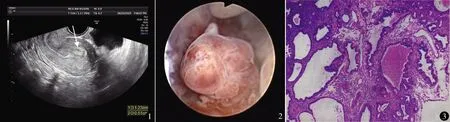
图1 B超见子宫内膜1.0 cm,宫腔内偏强回声团1.7 cm×1.2 cm 图2 宫腔镜术中见病变位于宫腔后壁,直径2.0 cm,形态欠规划 图3 腺体密集伴分支状腺管结构,符合APA,子宫内膜不伴非典型子宫内膜增生(HE染色 ×40)
1.2 方法
均行宫腔镜检查+宫腔内占位病变切除术。膀胱截石位,静脉麻醉。术中使用双极电切镜,灌流液使用0.9%氯化钠。切除方法采用宫腔镜“四步诊疗法”。第一步:从根蒂部完整切除占位病变;第二步:切除根蒂部周围0.2~0.5 cm内膜组织;第三步:切除占位病变根蒂下方约0.3 cm子宫肌层组织;第四步:宫腔其余部位子宫内膜切除少许行活检。将上述各步切除的组织分别送病理检查,根据病理结果决定下一步治疗。
2 结果
2.1 宫腔镜术中所见(图2)
49例占位病变均位于宫腔内:单发病变45例,8例病变表面可见丰富血管,2例病变表面可见粗大异型血管;多发病变4例。病变直径0.5~6 cm,平均2.0 cm。
2.2 病理诊断
49例病理均为APA(图3),根据APA表面腺体组织的异型程度将APA分为高度结构异型指数APA(a high architecture index APA,APA-H)和低度结构异型指数APA(a low architecture index APA,APA-L)2种类型[1],其中APA-H(含分支及出芽等复杂结构腺体成分≥30%)9例,APA-L 40例。宫腔镜活检子宫腔其他部位子宫内膜合并轻/中度非典型增生7例。
2.3 治疗
32例保守治疗:32例27~42岁,均有保留子宫愿望,其中19例有生育愿望。4例APA-H、2例APA-L合并子宫内膜轻度非典型增生:口服高效孕激素500 mg/d治疗3~6个月,行宫腔镜检查+子宫内膜多点活检,内膜均表现为子宫内膜部分腺体呈分泌期样,部分腺体萎缩,符合孕激素治疗效应,停用高效孕激素,月经第14天开始口服地屈孕酮20 mg/d×12天,3个月后再次复查宫腔镜检查+子宫内膜活检,子宫内膜均无异常。26例APA-L:口服高效孕激素治疗3个月8例,月经后半周期口服孕激素(地屈孕酮/黄体酮软胶囊)12天共3个月9例,口服短效避孕药(妈富隆/优思明)4例,未药物治疗定期随访5例。均间隔3~6个月行宫腔镜检查+子宫内膜活检术评估子宫内膜,如果连续2次评估子宫内膜无异常,不再定期行宫腔镜检查随访,观察月经情况及复查超声。
17例手术治疗:1例因宫腔镜活检宫腔其他部位子宫内膜复杂性增生,术后4周行宫腔镜子宫内膜切除术。16例年龄44~74岁,无保留子宫愿望,宫腔镜手术后4周行全子宫切除术+双附件/双输卵管切除术,包括APA-H 5例,宫腔镜活检宫腔其他部位子宫内膜合并轻/中度非典型增生7例,4例合并子宫肌瘤、异常子宫出血-排卵障碍。切除子宫后病理:子宫内膜轻度非典型增生6例,轻-中度非典型增生1例,其余9例子宫内膜均为良性改变。
2.4 随访
49例定期随访3~174个月,中位数35.0月。32例接受保守治疗均无复发:有生育愿望19例,宫腔镜切除占位病变术后妊娠16例,其中9例自然妊娠,7例接受内分泌促排卵或辅助生育技术治疗成功妊娠;3例辅助生育失败放弃生育愿望,因合并排卵障碍,放置左炔诺孕酮宫内缓释系统长期治疗。合并异常子宫出血-排卵障碍8例,再次出现月经异常,口服孕激素后半周期治疗4例,放置左炔诺孕酮宫内节育系统治疗3例,1例宫腔镜保守性手术后52个月,宫腔镜检查+子宫内膜活检术后病理提示子宫内膜轻度非典型增生,行全子宫+双输卵管切除术。其余保守治疗的13例无生育要求,有保留子宫愿望,术后定期随访无不适症状。17例接受宫腔镜子宫内膜切除术及全子宫切除术后患者均无不适症状。
3 讨论
3.1 发病原因及临床表现
APA患病率低,目前发病原因尚不明确。APA发病年龄18~81岁[1],多发生于绝经前女性[2]。本组患者年龄27~74岁,(46.5±12.1)岁,其中绝经前34例(69.4%),绝经后15例(30.6%)。最常见临床表现为异常子宫出血(40/49),其次为无明显症状,B超提示宫内异常回声(7/49)。本组合并不孕9例,异常子宫出血-排卵障碍10例,糖尿病4例,乳腺癌术后服用枸橼酸托瑞米芬5年1例,宫腔镜活检子宫内膜合并轻/中度非典型增生9例,考虑APA的发生与雌激素持续刺激有关。
3.2 诊断与鉴别
APA没有典型的特异性临床表现,最常见临床表现为异常子宫出血[3],B超可提示子宫内膜非均质增厚、宫内异常回声,彩超的血流改变亦无特异性,因此,需要与子宫内膜息肉、子宫内膜癌、子宫腺肌病、子宫腺纤维瘤及恶性苗勒氏管混合瘤等疾病鉴别。APA可合并子宫内膜癌前病变及子宫内膜癌[4],因此,对异常子宫出血、宫内异常回声、不孕等有明确宫腔镜检查指征的患者,一定要进行宫腔镜检查。宫腔镜检查中应仔细观察子宫内膜厚度、质地、血管形态及宫腔内有无占位病变,占位病变的大小、位置、质地、表面血管特点等。
本组病变直径0.5~6 cm,平均2.0 cm,与Ma等[5]报道一致。APA的外观形态在宫腔镜下并无特异性,常与子宫内膜息肉或黏膜下肌瘤混淆,但APA多>1 cm,表面可能有丰富、粗大血管,因此,对直径>1 cm的宫腔内占位,宫腔镜手术时应按照“四步诊治法”[2]完整、彻底切除,同时对基底部及其周围的子宫内膜与浅肌层进行相应活检,并追访病理诊断,以免漏诊误诊。
3.3 治疗与随访
Wong等[6]报道妊娠期间APA无复发,妊娠结束后复发,提示孕激素可能起到一定保护作用。Chen等[7]报道有生育愿望的APA患者宫腔镜病灶切除术后继续孕激素治疗。张颖等[8]报道APA按“四步诊疗法”经宫腔镜切除病变后未予药物治疗无复发,但APA复发率高达28.9%~35.1%[2,4],且反复复发易发生子宫肌层浸润。APA的恶变率远高于子宫内膜息肉(0.8%)[9]。因此,APA治疗可按年龄及病理分型进行分类处理:绝经期或围绝经期患者,且宫腔镜术后病理确诊为APA-H,建议行全子宫切除术,宫腔镜术后确诊为APA-L,可考虑患者年龄及保留子宫愿望决定下一步治疗;对于生育年龄患者,如果宫腔镜术后确诊为APA-H,建议行高效孕激素治疗,如果宫腔镜术后病理确诊为APA-L,可单纯随访。本组APA-H或APA-L合并子宫内膜非典型增生患者接受保守治疗,选用药物均为高效孕激素,APA-L患者术后月经后半周期口服孕激素、短效避孕药及单纯随访均无复发。无论保守治疗或手术治疗,随访都很重要。对于APA-H和(或)子宫内膜非典型增生,有生育愿望或保留子宫愿望的患者,随访尤为重要,宫腔镜检查和子宫内膜多点活检可大大降低子宫内膜病变的漏诊几率,指导患者下一步治疗。
本组患者预后较好的原因分析如下:①宫腔镜检查+宫腔内占位病变切除术坚持采用“四步诊疗法”,完全、彻底切除病变,减少根蒂部和根蒂周围病变残留,降低患者合并子宫内膜病变的漏诊率,为下一步的治疗方案提供可靠依据。②对保守治疗的患者强调随访的重要性,且随访中不仅使用B超评估子宫内膜,宫腔镜检查+子宫内膜活检更有利于全面评估宫腔内膜,并提高子宫内膜活检的准确率,避免假阴性结果。1例在随访过程中,宫腔镜检查+子宫内膜活检诊断为子宫内膜轻度非典型增生,行手术治疗,避免了癌变的发生。③APA患者可能存在雌激素持续刺激,缺乏孕激素保护,因此,对于合并排卵障碍的患者建议长期管理,首选左炔诺孕酮宫内缓释系统。
APA复发高峰时间在术后2~5年[10,11],故建议在5年内应密切随访。间隔3~6个月行宫腔镜检查+子宫内膜活检,连续2次子宫内膜无异常,患者有生育要求,可根据年龄、有无其他不孕因素等建议患者积极试孕或选择辅助生育技术,随后对子宫内膜的评估可选用B超。如再次出现异常子宫出血、子宫内膜回声异常等仍需宫腔镜检查+子宫内膜活检评估。连续2次评估子宫内膜均不能逆转,存在癌前病变或子宫内膜癌,根据患者年龄、病理结果及有无生育要求决定是否进一步手术治疗。
本组样本量小且为回顾性分析,保守治疗方案不统一,因此,对于APA的保守治疗方案及随访方式仍需长期大样本进一步观察验证。