ATP生物荧光增幅法在微生物检测中的可行性研究─应用于化妆品领域
2020-11-20翟磊葛媛媛洪海军刘吉泉李婷沈颖林雅芳蔡俊松刘骥刘瑞娜王旭姚粟
翟磊,葛媛媛,洪海军,刘吉泉,李婷,沈颖,林雅芳,蔡俊松,刘骥,刘瑞娜,王旭,姚粟*
1(中国食品发酵工业研究院有限公司,北京,100015)2(联合利华(中国)有限公司,上海,200335) 3 (Procter & Gamble International Operations,新加坡,138547) 4(北京宝洁技术有限公司,北京,101312)5(查士利华微生物应用技术(上海)有限公司,上海,201708)
近年来,我国化妆品质量显著提升,据不完全统计,2015年至今我国化妆品市场抽检合格率平均达到95%以上,但不合格产品中的微生物污染问题仍然存在并被社会重点关注[1-4]。《化妆品安全技术规范》[5](2015年版)(以下简称《规范》)将菌落总数、霉菌和酵母菌纳入常规检验项目,检测方法为平板计数法,该方法检验周期较长、使用人工计数,效率较低,目前已无法完全适应化妆品行业产能扩大、流通加速的迅猛发展需求[6]。当前微生物快速检验新兴技术不断涌现[7-10],新方法开发、验证、适用性评价及标准化应用成为微生物安全控制领域的研究热点并取得显著进展[11-14]。各国药典和国际组织陆续颁布并不断完善替代方法验证相关指南。借鉴国内外食品和制药等微生物检验领域的成功运用经验,对我国化妆品微生物检验方法开展系统性研究[15],将有力推动化妆品微生物检测效率和过程控制水平提升,并在保障产品安全和消费者权益方面发挥重要作用。
本课题组前期基于ATP生物荧光技术[16-19]建立了一套适用于微生物快速检测的ATP生物荧光增幅法,具有检测速度快,准确度高的特点,可在48 h内实现样品中细菌、霉菌和酵母菌的定性检验。该方法利用微生物体内的腺苷酸激酶AK,催化添加的二磷酸腺苷ADP转换为三磷酸腺苷ATP,短时间内实现ATP增幅;通过添加荧光素酶和荧光素,将ATP高能键在断裂过程中产生的能量转化为生物荧光信号,通过计算生物荧光信号强度判断样品中是否含有微生物。为评价ATP生物荧光增幅法在化妆品微生物检测中应用的可行性,本研究收集了与化妆品原料及其生产环境相关的47株代表性菌株,进行了富集培养基MTAT的促生长能力测试;选取了清洁类、护理类、美容修饰类6种化妆品,通过样品影响测试和接菌试验来评价化妆品产品的适用性,探究ATP生物荧光增幅法在化妆品及相关领域开展微生物快速筛选与检测的应用前景。
1 仪器与材料
1.1 试验仪器
Celsis®Ad ance II 光度计,Charles Ri er Laboratories;恒温振荡摇床THZ-98AB,上海一恒科学仪器有限公司;往复式摇床,EBERBACH;恒温培养箱GHP-9270,上海一恒科学仪器有限公司;生物安全柜AC2-4S1,ESCO。
1.2 试验菌株
通过文献调研,结合微生物分类学特征和生长特性,本研究收集了与化妆品原料及其生产环境相关的47种细菌、霉菌和酵母菌代表菌株,用于促生长能力测试和产品适用性试验,具体菌株信息见表1。
1.3 试验样品
根据化妆品分类标准[20],选取了清洁类、护理类、美容修饰类6种化妆品,包括洗发水、沐浴液、护发素、定型水、面霜和面膜,每种产品选取3个不同生产批次。
1.4 试验试剂
改良TAT(MTAT)培养基:TAT肉汤 22.50 g/L,硫代硫酸钠 0.50 g/L、组氨酸 0.10 g/L、蛋白胨 7.50 g/L、葡萄糖 15.00 g/L、氯化钠 0.85 g/L、卵磷脂1.43 g/L和吐温80 39.00 g/L,pH 值调至7.0±0.1;ATP生物荧光增幅法试剂,Charles Ri er Laboratories Celsis®AMPiScreenTM;消泡剂,J.T.Baker®Antifoam B®Silicone Emulsion;0.5 mm玻璃珠,BioSpec Product。
2 实验方法
2.1 促生长能力测试
将试验收集的细菌和酵母菌制备成10~100 CFU/10 mL的菌悬液,霉菌制备10~100 CFU/10 mL的孢子悬液,接种到90 mL富集培养基MTAT,置于(30±2) ℃摇床,200 r/min,振荡培养24~48 h。在24或48 h取样,使用ATP生物荧光增幅法对富集培养物进行上机检测,若样品为霉菌,则需使用玻璃珠破壁处理30 min后再上机检测。同时,将细菌富集培养物接种于卵磷脂吐温80-营养琼脂培养基,置于(36±1) ℃培养箱,培养(48±2) h;酵母菌和霉菌富集培养物接种于虎红培养基,置于(28±2) ℃培养箱,培养5 d,确认接种物是否有微生物生长。
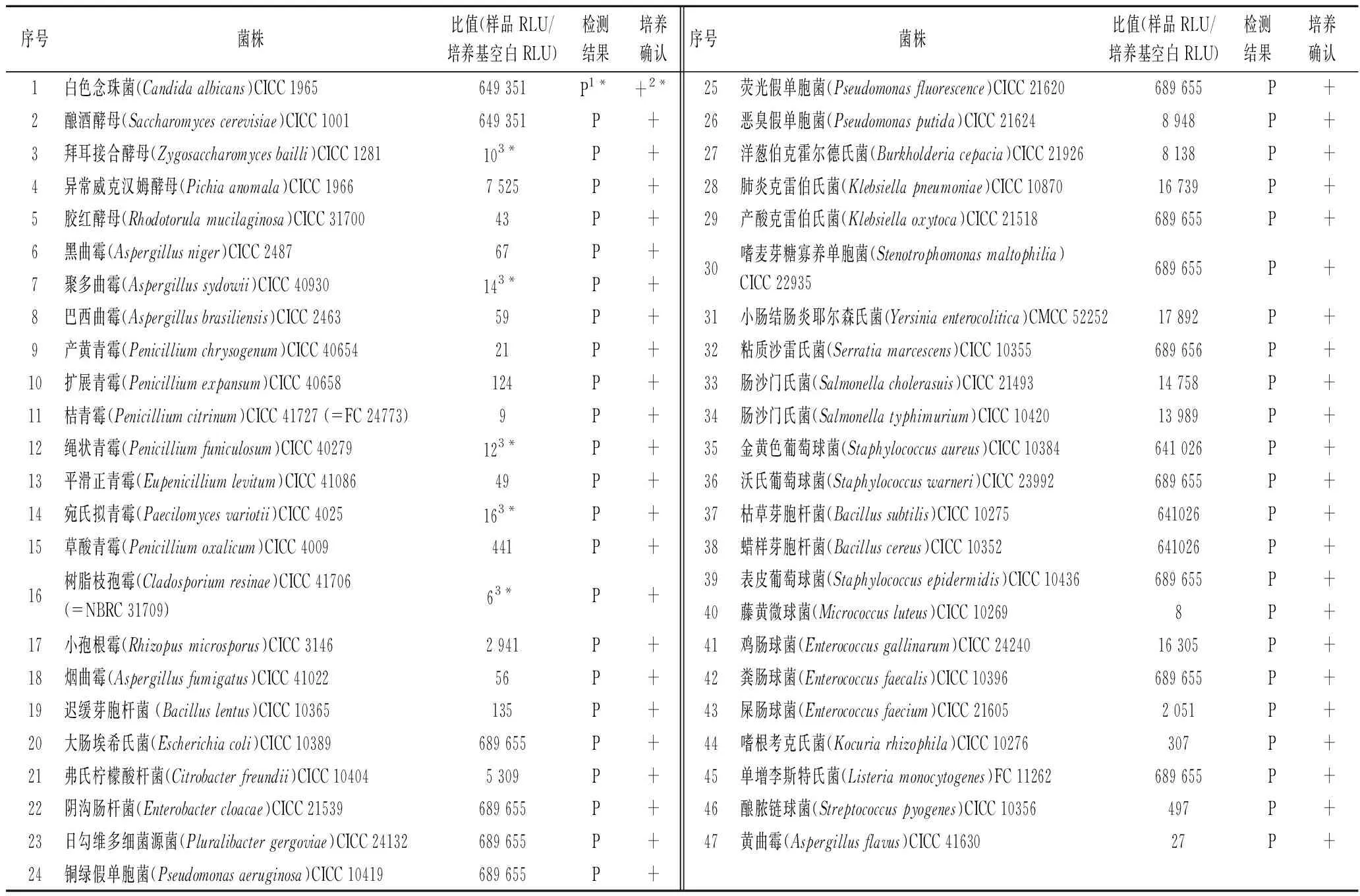
表1 促生长能力测试结果Table 1 Growth promotion test results
促生长能力测试通过的标准为,试验收集的47株微生物菌株均能在富集培养基MTAT中生长良好,且ATP生物荧光增幅法检测结果均为阳性。若促生长能力测试不能通过上述标准,需要对富集培养基的配方和培养条件进行优化。
2.2 产品适用性试验
产品适用性试验包括样品影响测试和接菌试验。化妆品产品在应用ATP生物荧光增幅法检测前,应先进行产品适用性试验来确定ATP生物荧光增幅法是否适用于待检产品。本研究选择大肠埃希氏菌(Escherichiacoli)CICC 10389、铜绿假单胞菌(Pseudomonasaeruginosa)CICC 10419、金黄色葡萄球菌(Staphylococcusaureus)CICC 10384、枯草芽胞杆菌(Bacillussubtilis)CICC 10275、白色念珠菌(Candidaalbicans)CICC 1965和黑曲霉(Aspergillusniger)CICC 2487用于产品适用性试验研究。
2.2.1 样品影响测试
样品影响测试的目的是确保化妆品中的配方成分不会影响ATP生物荧光增幅法检测,每种产品检测3个不同生产批次。操作步骤为:将10~100 CFU试验菌株接种于10 mL富集培养基MTAT中制备菌悬液 (黑曲霉制备孢子悬液),同时将等量的菌液涂布于卵磷脂吐温-80营养琼脂培养基或虎红培养基上确认实际接种量。称取10 g产品,加至90 mL富集培养基MTAT中,充分振荡混匀,取10 mL 1∶10稀释液加到90 mL富集培养基MTAT制备成产品样品,同时将不接菌的富集培养基MTAT作为培养基空白。将上述制备的菌悬液、产品样品和培养基空白置于(30±2) ℃摇床,200 r/min,振荡培养48 h。取样,对富集培养后的产品样品进行上机检测,并使用平板培养方法确认产品中是否含有微生物;取900 μL培养基加入100 μL ATP标品,制备成ATP对照;取900 μL培养基空白加入100 μL富集培养物的100倍稀释液,制备成微生物对照;取900 μL产品样品加入100 μL ATP阳性对照标品,制备为ATP样品;取900 μL产品样品加入100 μL富集培养物的100倍稀释液,制备成微生物样品。将上述制备的样品和对照进行ATP生物荧光增幅法检测,同时取100 μL涂布于卵磷脂吐温80-营养琼脂培养基或虎红培养基上确认相应样品中是否含有微生物。样品影响测试结果的通过标准见表2。

表2 样品影响测试通过标准Table 2 Success criteria for sample effect tests
2.2.2 接菌试验
接菌试验主要用于确认加入样品中的防腐剂能否被富集培养基有效中和,每种产品检测3个不同生产批次。操作步骤为:称取10 g产品,加入90 mL富集培养基MTAT,充分振荡混匀,取10 mL 1∶10稀释液加到90 mL富集培养基MTAT制备成产品样品,同时将不接菌的富集培养基MTAT作为培养基空白。将试验菌株制备成10~100 CFU/100 μL的菌悬液(黑曲霉制备孢子悬液)备用,同时取100 μL涂布于卵磷脂吐温80-营养琼脂培养基或虎红培养基上以确认实际接种量。接种100 μL菌悬液或孢子悬液于产品样品中制备成微生物样品,同时接种100 μL菌悬液或孢子悬液于培养基空白中制备成微生物对照;将制备的产品样品、培养基空白、微生物样品和微生物对照置于(30±2) ℃摇床,200 r/min振荡培养48 h。对富集培养后的样品进行ATP生物荧光增幅法检测,若样品为霉菌,则需使用玻璃珠破壁处理30 min后再上机检测。同时取100 μL富集液涂布于卵磷脂吐温80-营养琼脂培养基或虎红培养基上确认样品中是否含有微生物。接菌试验通过的标准为,微生物样品和微生物对照的检测结果为阳性,未接菌的产品样品检测结果应为阴性。
3 结果与分析
3.1 促生长能力测试
促生长能力测试结果见表1。本研究收集的47株微生物菌株在富集培养基MTAT中生长良好,ATP生物荧光增幅检测结果均为阳性,并且在卵磷脂吐温80-营养琼脂培养基或虎红培养基上生长良好,表明富集培养基MTAT的促生长能力测试符合要求。
促生长能力测试主要考察MTAT培养基对菌株的富集培养能力,试验菌株的选择尤为关键。本研究结合微生物分类学特征和生长特性,选取与化妆品原料与生产环境相关的47种细菌、酵母和霉菌代表菌株,用于考察MTAT培养基的富集能力。从微生物分类特征上看,选取的菌株包括28株细菌(15株革兰氏阴性细菌和13株革兰氏阳性细菌),5株酵母菌和14株霉菌,具有良好的代表性。从生理特性上看,既有生长速度快的代表菌株,又有对营养苛求、生长较为缓慢的代表菌种,如聚多曲霉(Aspergillussydowii)CICC 40930,绳状青霉(Penicilliumfuniculosum)CICC 40279,宛氏拟青霉(Paecilomycesariotii)CICC 4025,拜耳接合酵母(Zygosaccharomycesbailli)CICC 1281和树脂枝孢霉(Cladosporiumresinae)CICC 41706,在富集培养基MTAT中培养48 h后,ATP生物荧光增幅检测结果才为阳性。这5株真菌是生长缓慢的菌株的代表,为今后研究中生长缓慢代表菌株的选择提供了重要的依据。
3.2 产品适用性试验
3.2.1 样品影响测试
样品影响测试主要测试化妆品产品的本底信号值,确保化妆品配方成分不会影响ATP生物荧光增幅法的检测。检测结果见表3,培养基空白的信号值在167~285 RLU,远低于检测方法规定的 1 000 RLU,表明富集培养基MTAT本底信号符合要求。产品样品的信号值在87~199 RLU,也远低于3倍培养基空白信号值的要求,并且通过涂布平板确认化妆品样品中未见微生物污染。此外,ATP对照、微生物对照、ATP样品和微生物样品的信号值均大于3 倍培养基空白的信号值,并且测试产品中ATP回收率在73.8%~106.8%,高于25%的标准推荐值,表明本研究选取的6种产品均通过样品影响测试。
3.2.2 接菌试验
接菌试验主要是证明化妆品中的抑菌作用能否被富集培养基有效中和,检测结果见表4。培养基空白的信号值在145~178 RLU,远低于检测方法规定的1 000 RLU,产品样品的信号值在86~198 RLU,检测结果为阴性,并且涂布平板确认化妆品样品中未见微生物污染。而接种试验菌悬液的微生物对照和微生物样品,ATP生物荧光增幅法检测结果均为阳性,并且通过平板确认微生物对照和微生物样品中微生物生长良好,表明本研究选取的6种产品均通过接菌试验。
综合样品影响测试和接菌试验的检测结果,ATP生物荧光增幅法适用于本研究所选洗发水、沐浴液、护发素、定型水、面霜和面膜中微生物的快速筛选与检测,为后续该方法进行方法验证和方法适用性研究奠定了基础。
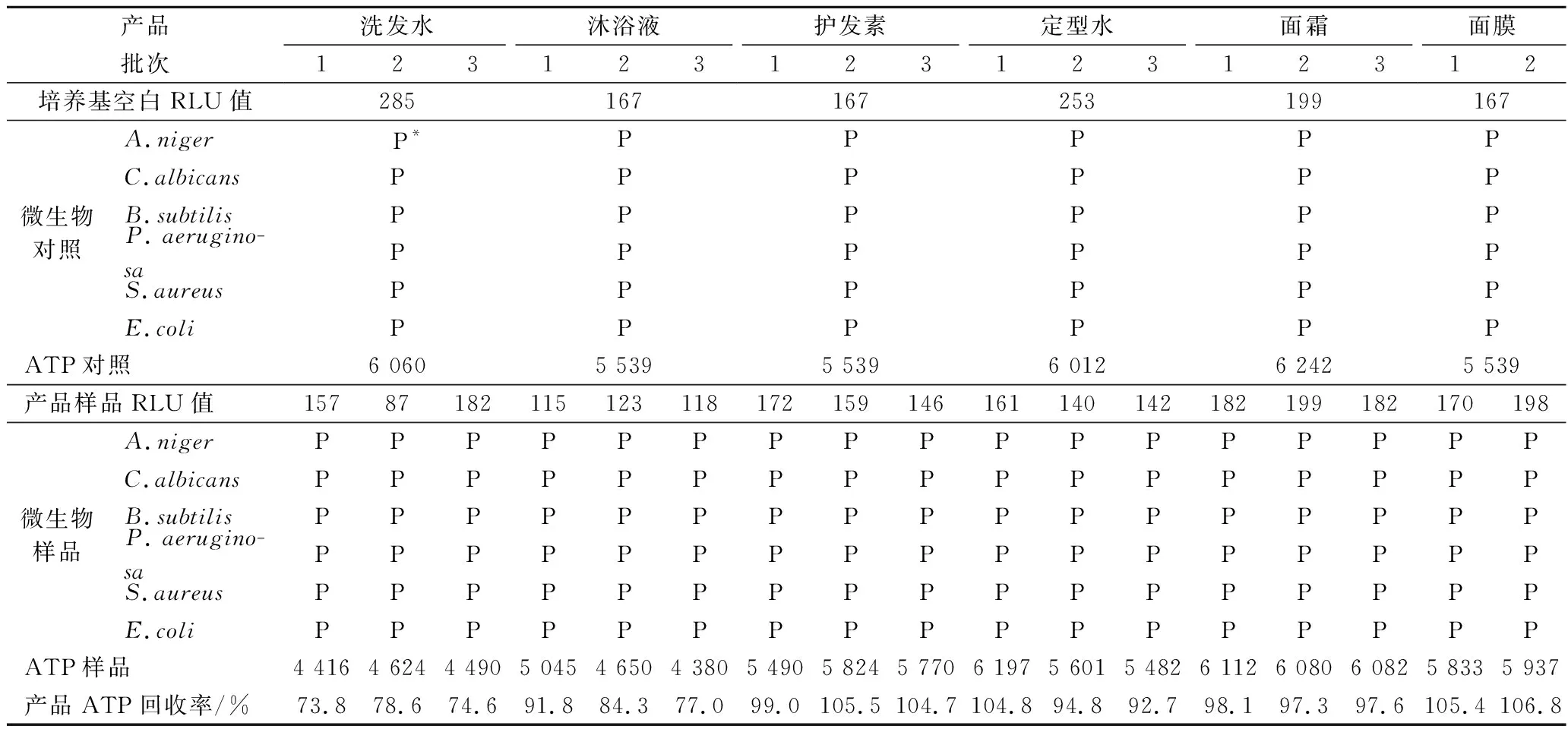
表3 样品影响测试结果Table 3 Sample effect test results
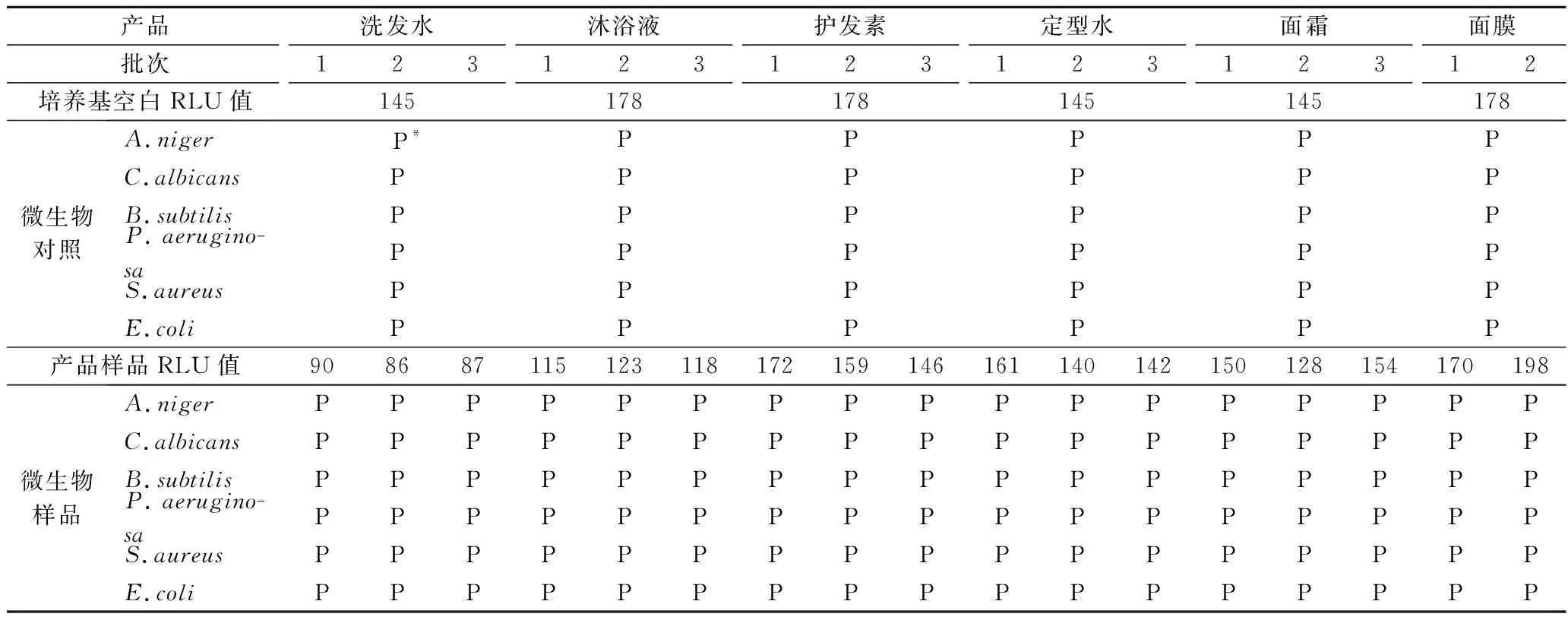
表4 接菌试验结果Table 4 Spiking test results
4 结论
本研究收集的与化妆品原料及其生产环境相关的47株代表性菌株,在富集培养基MTAT中生长良好,均通过了促生长能力测试;选取的清洁类、护理类、美容修饰类中6种化妆品均符合样品影响测试和接菌试验检测方法的要求。因此,ATP生物荧光增幅法具有在化妆品及相关领域开展微生物快速筛选与检测的良好应用前景。
