不同干燥方式对发芽青稞活性成分的影响
2020-11-20廖超谢勇覃小丽叶正荣陈沁滨刘雄
廖超,谢勇,覃小丽,叶正荣,陈沁滨,刘雄,*
1(西南大学 食品科学学院,重庆,400715)2(昌都市农业科学研究所,西藏 昌都,854000) 3(淮安嘉穗食品科技有限公司,江苏 淮安,223400)
青稞是我国西藏地区的主要粮食作物,在青藏高原的农业生产和经济发展中起着重要的作用[1]。发芽青稞中含有丰富的营养成分,如碳水化合物、蛋白质、脂肪、维生素、矿物质等,同时还包含一些植物化学成分,如β-葡聚糖、酚类化合物、黄酮、γ-氨基丁酸、类胡萝卜素等[2]。发芽青稞已被证明是一种具有抗氧化活性、降低胆固醇、控制血糖和辅助降血脂等功能的杂粮[3-4]。但是,新鲜发芽的青稞水分含量较高,呼吸活性较强,极易腐败变质,导致营养损失,需要干燥保藏。
食品的干燥技术对食品的理化品质有着重要的影响[5-8]。但目前,关于发芽青稞干燥工艺的研究鲜见报道,特别是不同干燥条件下发芽青稞的活性化学成分的变化还未研究清楚。
本实验选取热风干燥、微波干燥、冷冻干燥、热泵干燥和真空干燥5种干燥方式,以收缩率、复水率、色泽、质构、微观结构、黄酮、多酚、核黄素、β-葡聚糖和γ-氨基丁酸为指标,考察不同干燥方法对发芽青稞的品质和功能性成分的影响,并采用综合系数法进行综合评分,以期选出合适的干燥方法,为发芽青稞的生产加工提供合理的科学依据。
1 材料和方法
1.1 材料和仪器
材料:青稞,昌都市农业科学研究所。
试剂:色谱级甲醇、乙腈、乙酸钠,美国Sigma Aldrich公司;次氯酸钠、甲醇、NaNO2、AlCl3、NaOH、正己烷、乙酸乙酯、三氯乙酸、硼酸钠及其他常规试剂(分析纯),重庆跃翔化工有限公司。
仪器设备:HWS-128型恒温培养箱,宁波江南仪器厂;U -B型中波紫外线灯管,北京中仪博腾科技有限公司;U -B型紫外辐照计,北京师范大学光电仪器厂;FD-1A-50型真空冷冻干燥机,北京松源华兴科技发展有限公司;DZF-6090Z电热恒温真空干燥箱,上海跃进医疗器械有限公司;WB-KQ01型热泵 (移动除湿烘干机),广州温伴节能热泵有限公司;EG823LA6-NR型微波炉,美的公司;DHG-9070型电热恒温鼓风干燥箱, 上海齐欣科学仪器有限公司;Phenom Pro-17A00403型扫描电镜,荷兰Phenom World公司;TA-XT plus质构仪,英国Stable Micro Systems公司;UltraScan PRO型测色仪,美国HunterLab公司;U -2450型紫外分光光度计、LC-20A型高效液相色谱,日本岛津公司。
1.2 实验方法
1.2.1 青稞的发芽
挑选优质的青稞种子,按1∶5(g∶mL)的比例在5 g/L 的次氯酸钠中浸泡15 min,达到灭菌的目的,并用纯净水洗涤至中性。将种子和纯净水以1∶5(g∶mL)的比例浸泡6 h。然后将浸泡后的种子用纯净水冲洗2次。将种子放入带有2层加湿滤纸的培养箱中,在25 ℃下发芽。在发芽期间每天利用中波紫外线(20 μW/cm2)辐照6 h[9-10],以提高活性成分的含量。同时每4 h喷1次纯水,使滤纸保持湿润。
1.2.2 干燥处理
取新鲜发芽的青稞80 g,采用热风干燥、微波干燥、冷冻干燥、热泵干燥和真空干燥进行干燥处理,使样品的水分含量低于10%。参考何玉倩等[11]和XU等[12]的干燥方法,真空干燥的温度为50 ℃,压力为15 Pa;热泵干燥的温度为50 ℃,相对湿度为40%;热风干燥的温度为50 ℃;微波干燥的功率为500 W;冷冻干燥的冷阱温度为-55 ℃,真空压力为45 Pa。
1.2.3 复水率
根据WANG等[13]的方法,将一定量干燥样品颗粒浸入60 ℃的蒸馏水中,时间间隔为30 min记录样品的质量,直至恒重为止。复水率按公式(1)计算,每组样品至少重复测定3次,取其平均值。
(1)
式中:R,复水率;m1,复水前青稞的质量,g;m2,复水后青稞粒质量,g。
1.2.4 收缩率
根据SONG等[14]的珠粒位移法确定青稞样品收缩引起的体积变化,样品收缩率按公式(2)计算,每组样品至少重复测定3次,取其平均值。

(2)
式中:0,干燥前青稞体积;d,干燥后青稞体积。
1.2.5 色差
使用色差仪测定干燥青稞粉末色度值L*、a*、b*,其中L*代表明度指数,a*是红绿值,b*是黄蓝值,每个样品至少重复测定3次,取其平均值[12]。
1.2.6 质构
使用质构仪在TPA模式下测定干燥青稞的硬度。采用P/2探头,测定前速度2 mm/s,测定中速度1 mm/s,测定后速度1 mm/s,样品承受力为5.0 g,记录样品的硬度[11]。
1.2.7 微观结构
将干燥的青稞样品固定在铜桩上,在镀金之后,通过扫描电子显微镜在高真空条件下以10 k 的加速电压进行观察,使用300倍捕获放大图像[12]。
1.2.8 黄酮含量测定
根据TOHIDI等[15]的方法,称取1.00 g发芽青稞样品置于试管中,加8 mL甲醇溶液(体积分数80%)。超声振荡1 h后,8 000 r/min离心10 min,取上清液置于10 mL的容量瓶中,定容至刻度线。取250 μL的样品液和50 g/L 的NaNO2溶液150 μL混合,放置6 min。加100 g/L的AlCl3溶液300 μL,摇匀,放置5 min。加1 mol/L的NaOH 1.50 mL,水2.80 mL。振荡混匀后,静置15 min,在波长510 nm下,测定吸光度。总黄酮的含量以每克干物质中芦丁当量计算。
1.2.9 多酚含量的测定
根据MA等[4]的方法并稍做修改,将1.00 g样品溶解于20 mL正己烷当中,于黑暗处振摇15 min。将混合液在4 ℃,8 000 r/min的条件下离心20 min。除去上清液,得到残渣,重复以上步骤2次。用体积分数80%的甲醇8 mL萃取离心的残渣, 在室温下晃动1 h。以4 ℃,8 000 r/min的条件离心20 min,得到上清液,重复以上步骤3次,将3次得到的上清液定容至25 mL,作为游离酚提取物。甲醇萃取后收集的残余物在室温下用 20 mL浓度2 mol/L的NaOH水解2 h。使用摇床在室温和黑暗条件下摇动混合物,用6 mol/L的HCl溶液将其pH调节至1.5~2.0。使用25 mL正己烷将上清液脱脂,8 000 r/min离心10 min,弃去上清液。并用 25 mL乙酸乙酯萃取3次(总共75 mL),8 000 r/min离心10 min,收集上清液。将合并的乙酸乙酯在35 ℃下用旋转真空蒸发器在真空下蒸发至干。将干燥的提取物重新溶解在体积分数80%的甲醇中,并定容至10 mL,作为结合酚提取物。
将400 μL适当稀释的粗提取物与3.0 mL 10倍新鲜稀释的福林酚试剂混合,将溶液涡旋并平衡5 min。然后加入75 g/L的Na2CO3溶液3.0 mL并充分混合。在室温和黑暗条件下静置2 h, 使用分光光度计在765 nm 波长处测量吸光度。总酚含量以每克干物质中没食子酸的当量计算。
1.2.10 核黄素含量的测定
根据参考文献[16]和GB 5009.85—2016的方法,称取2~10 g(精确至0.01 g)干燥后的样品粉末于100 mL具塞锥形瓶中,加入60 mL 0.1 mol/L HCl溶液,充分摇匀,塞好瓶塞。将锥形瓶放入高压灭菌锅内,在121 ℃下保持30 min,冷却至室温后取出。用1 mol/L NaOH溶液将样品液的pH调至6.0~6.5,加入2 mL木瓜蛋白酶和高峰淀粉酶混合酶溶液,摇匀后,置于37 ℃恒温水浴锅中酶解。将酶解液转移至100 mL容量瓶中,加水定容至刻度,使用滤纸过滤得到滤液,滤液再通过0.45 μm 水相滤膜作为待测液。
色谱柱:C18柱(250 mm×4.6 mm,5 μm);流动相A:0.05 mol/L乙酸钠溶液,流动相B:甲醇;洗脱程序:流动相A∶流动相B=65∶35( ∶ );流速1 mL/min;柱温30 ℃;检测波长:激发波长462 nm,发射波长522 nm;进样体积20 μL。
1.2.11 β-葡聚糖含量的测定
根据美国谷物化学家协会(American Association of Cereal Chemists,AACC)(AACC 32-23.01)和美国分析化学家协会 (Association of Official Analytical Chemists,AOAC)(AOAC 995.16)的方法,取0.200 g样品,加入5 mL 体积分数50%乙醇,沸水浴5 min,涡旋片刻,再加入体积分数50%乙醇5 mL,于1 800×g下,离心10 min,弃去上清液。加入4.00 mL pH 6.5的磷酸缓冲液,于50 ℃下水浴5 min,再加入0.20 mL 10U的β-葡聚糖苷酶,并在50 ℃下水浴1 h,其中在水浴过程中涡旋3~4次。水浴结束后,加入2.00 mL pH 4.0磷酸缓冲液,于1 000×g的条件下离心10 min。取3份0.10 mL的上清液和1份0.1 mL的葡萄糖标准液置于反应试管中,其中在2个样品液和葡萄糖标准液中加入0.10 mL的β-葡萄糖苷酶,第3个样品液做为空白对照,于50 ℃下水浴10 min。再加入3.00 mL的葡萄糖氧化酶和过氧化物酶的混合液,于50 ℃下水浴20 min。在510 nm波长处测定吸光度。
1.2.12 γ-氨基丁酸含量的测定
根据LIU等[17]的方法,将0.500 g的干燥样品与5 mL 100 g/L三氯乙酸混合,并将样品提取物在振荡器上振摇1 min,以充分混匀。将混合物在40 ℃下保持2 h以提取γ-氨基丁酸。将振摇后的混合物以10 000 r/min离心15 min,然后通过0.45 μm过滤器得到上清液。将80 μL样品提取物与400 μL的0.4 mol/L硼酸盐缓冲液混合,再加入80 μL衍生试剂,在室温下放置5 min,立即进样。
色谱柱 C18柱(250 mm×4.6 mm,5 μm);流动相A 0.02 mol/L乙酸钠,每升溶液中含200 μL三乙胺,用乙酸将pH调至7.3,流动相B 乙腈;洗脱梯度 流动相A∶流动相B=80∶20(∶);流速0.8 mL/min;检测器 紫外检测器;检测波长 338 nm;柱温40 ℃;进样量20 μL。
1.2.13 综合评分
综合评分参考文献[18-19]的方法,利用变异系数法确定各项指标的权重系数,将数据进行标准化处理,对于值越小越好的指标,标准化后需要加负号,然后将不同干燥方式下各指标标准化值与权重相乘,得到综合评分。各指标的变异系数计算如公式(3)所示:
(3)
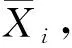
各项指标的权重计算如公式(4)所示:
(4)
采用Z-score标准化法对各项指标的数据进行标准化处理,计算公式如(5)所示:
(5)
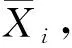
1.3 数据分析
2 结果与分析
2.1 干燥方式对发芽青稞微观结构的影响
为了研究干燥方式对发芽青稞细胞水平的影响,使用了300倍的扫描电子显微镜观察,发现不同干燥方式下发芽青稞的微观结构有着显著的区别。热风干燥和热泵干燥样品显示出多孔和蜂窝状的超微结构,并出现了严重的收缩。微波干燥的发芽青稞,细胞的结构被严重破坏,同时淀粉颗粒形态也被损坏。短时的微波干燥引起了一定程度的组织扩张,这导致样品有更少的收缩体积,同时有利于增强再水化过程中的吸水,这与下文中的复水能力和收缩率的研究结果一致。冷冻样品显示出清晰的多孔结构和较少的塌陷,保持了较好的细胞结构,这表明冷冻干燥对维持多孔结构具有重要的意义,与下文中收缩率和复水比结果一致[20]。真空干燥中的水分散失和压力差使细胞间堆积更加紧密,这也将导致样品有更高的硬度。

a-热风干燥;b-微波干燥;c-冷冻干燥;d-热泵干燥;e-真空干燥图1 干燥方式对发芽青稞微观结构的影响Fig.1 Effect of drying methods on microstructure of germinated highland barley
2.2 干燥方式对发芽青稞物理特性的影响
颜色是影响消费者认可度和市场价值的关键质量参数之一,干燥会影响产品的色泽[13]。通过精密色差分析仪进行测定,干燥处理显著影响了干燥产品的颜色参数(P<0.05)。冷冻干燥的亮度最高,微波干燥的亮度最低(表1)。相比热风干燥、冷冻干燥、热泵干燥和真空干燥,微波干燥的红绿值和黄蓝值最高,这可能是因为微波干燥破坏了细胞结构,促进了氨基酸与糖类物质之间的美拉德反应[21],从而促进了棕色物质的增加,引起了较低的亮度和较高的红绿值、黄蓝值。
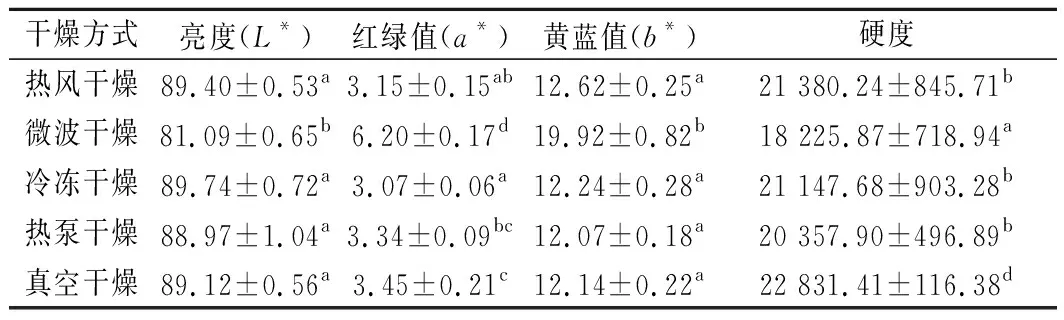
表1 干燥方式对发芽青稞色泽和硬度的影响Table 1 Effect of drying methods on color and hardness of germinated highland barley
硬度与果蔬组织结构直接相关,是评价干燥制品品质的重要指标之一[22],同时也是衡量颗粒物品易粉碎程度的重要参考。如表1所示, 5种发芽青稞硬度大小依次为:真空干燥>热风干燥>冷冻干燥>热泵干燥>微波干燥。这是因为在微波干燥过程中发芽青稞保持了原有的多孔结构,其体积膨胀保持了有限的收缩。同时在微波的高温条件下导致了细胞间膨化和细胞黏附力的降低。真空干燥和热风干燥有较高的硬度值,这可能与干燥过程细胞严重收缩和原有组织结构塌陷有关。
发芽青稞在干燥期间会将水分从细胞处转移到周围环境中,导致发芽青稞的体积发生不规则的变化,而体积的收缩很大程度上会影响产品的品质特征[23]。图2比较了不同干燥方法对发芽青稞收缩率的影响,发现真空冷冻干燥的发芽青稞收缩率最小,为(7.75±1.11)%,其次是微波干燥,为(8.07±0.95)%,2种干燥方式都显示出了较好的质量特征。冷冻干燥经过升华直接除去青稞中的水分,从而使样品保持了原有的体积、形状和基本形态[11]。微波干燥有着更高的干燥速率,干燥时间较短,干燥过程中的高温辐射引起了一定程度上的组织扩张,这将大大弥补水分散失引起的体积收缩[24]。真空干燥的收缩率最大(63.80± 1.87)%,是冷冻干燥的8.23倍,其次是热泵干燥(57.51±0.54)%,然后是热风干燥(49.96±0.34)%。热风干燥、热泵干燥和真空干燥的高收缩率可能与发芽青稞中的结合水损失有关,结合水的流失导致发芽青稞的细胞壁发生不可逆的破裂,致使青稞的体积发生了改变。此外,真空干燥收缩率最高还可能与真空状态下内外部间压力差有关[25]。
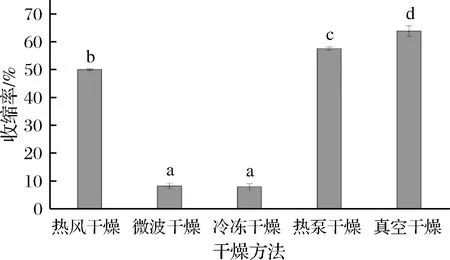
图2 干燥方式对发芽青稞收缩率的影响Fig.2 Effect of drying methods on olume shrinkage ratio of germinated highland barley注:不同字母表示显著性差异(P<0.05)(下同)
复水是干燥食品的重新湿润过程,复水比是评价干燥产品质量特征的重要属性之一[26]。图3描述了不同干燥方式下发芽青稞样品的复水能力,微波干燥和冷冻干燥相对热风干燥、热泵干燥和真空干燥具有较高的复水率,分别为(1.56± 0.049)、(1.50±0.10)。冷冻干燥期间发芽青稞中的水分升华促使其保持了较好的多孔结构,这种现象可能有利于补水过程中水的渗透,从而使冷冻干燥产品具有较高的补水速度和较高的复水率。微波干燥使样品保持了较小的体积收缩,及在干燥过程中导致部分淀粉糊化,增加了吸水性,从而使微波干燥具有较高的复水率[24]。热风干燥、热泵干燥和真空干燥复水率较低,且无显著性差异(P<0.05),可能是因为在干燥期间,发芽青稞表皮发生皱缩硬化,形成了致密的结构导致复水率较低。

图3 干燥方式对发芽青稞复水率的影响Fig.3 Effect of drying methods on rehydration capacity of germinated highland barley
2.3 干燥方式对发芽青稞活性成分的影响
2.3.1 对发芽青稞γ-氨基丁酸含量的影响
γ-氨基丁酸是脊椎动物神经系统的一种重要的神经递质,它具有降低胆固醇,改善大脑机能等多种保健功能[20],现有的研究表明,γ-氨基丁酸在发芽过程中会保持较高的水平[2]。不同干燥方式下,各个样品的γ-氨基丁酸含量如图4所示。

图4 干燥方式对发芽青稞γ-氨基丁酸含量的影响Fig.4 Effect of drying methods on γ-aminobutyric acid content of germinated highland barley
冷冻干燥的γ-氨基丁酸含量最高,达到(7.51±0.20) mg/g,这是因为冷冻干燥中较低的温度有效地保护了氨基酸,避免其损失。微波干燥的γ-氨基丁酸损失最大,含量仅为(2.70±0.24) mg/g,在实验中发现微波干燥的温度可达110~120 ℃,γ-氨基丁酸对热不稳定,在高温条件下,可能会发生脱羧、脱氨等反应[27]。热风干燥比热泵干燥和真空干燥的γ-氨基丁酸含量低,热泵干燥和真空干燥的γ-氨基丁酸含量差异不显著(P>0.05)。
2.3.2 对发芽青稞多酚含量的影响
如图5所示,不同的干燥方式对发芽青稞的多酚含量有不同的影响,微波干燥的多酚含量最高,为(3.58±0.19) mg/g。该结果与韩姝葶等[28]的研究结果一致,其次是冷冻干燥,为(3.08±0.32) mg/g。热风干燥、热泵干燥和真空干燥的多酚含量较小,且无显著性差异(P<0.05)。酚类属于生物活性物质,它们的化学性质不稳定,在受到热、O2和光等条件下都易分解,这就导致了多酚在热风干燥、热泵干燥和真空干燥中损失较多。此外,多酚氧化酶和过氧化物酶在干燥过程中的活化也可能导致酚类的损失[7]。微波干燥产生的热量强烈而迅速,这可能导致多酚氧化酶和过氧化物酶发生热降解,减少酶促氧化的进行,更有利于保存酚类化合物。
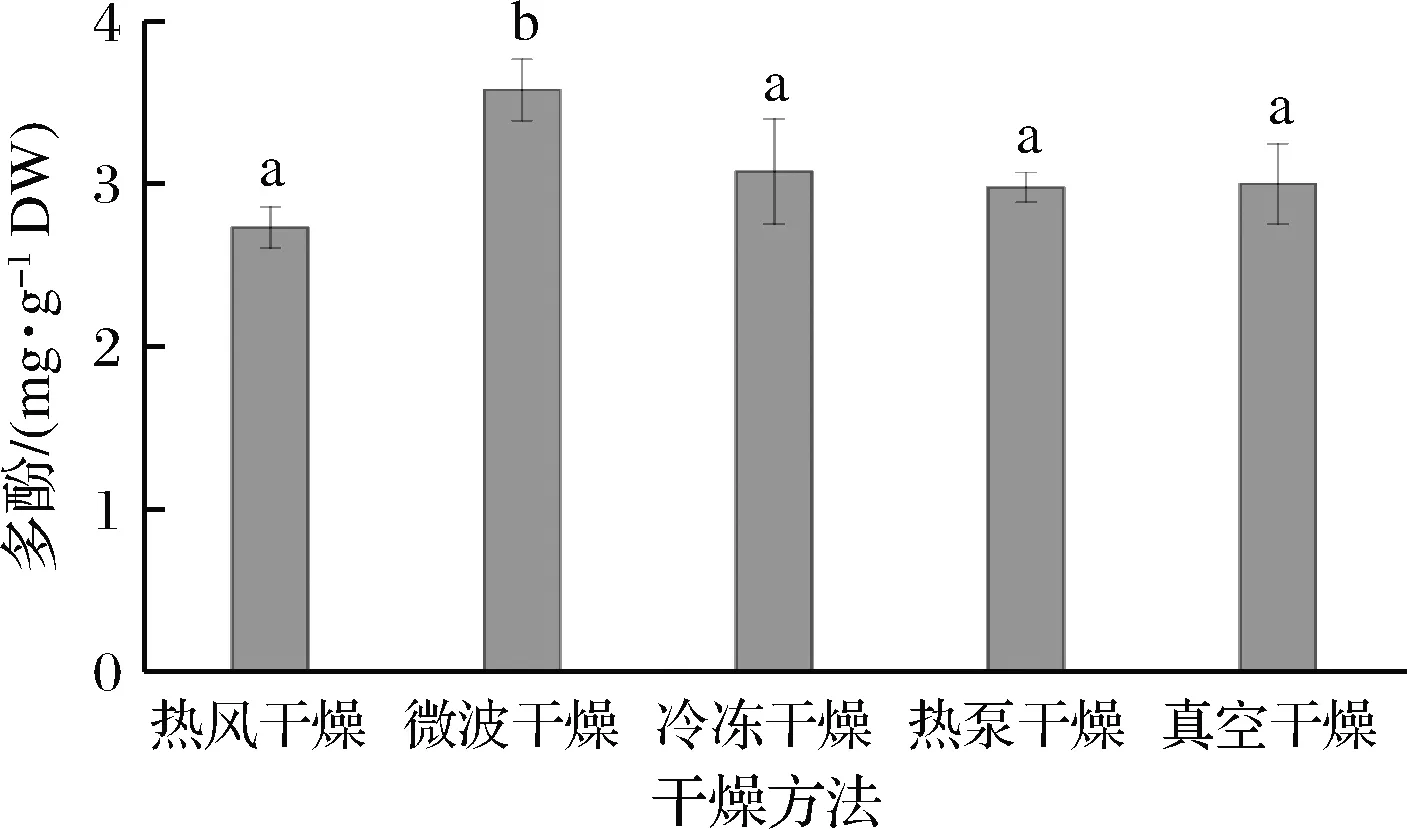
图5 干燥方式对发芽青稞多酚含量的影响Fig.5 Effect of drying methods on the total phenols content of germinated highland barley
2.3.3 对发芽青稞黄酮含量的影响
黄酮具有广泛的医学和营养功效,如抗氧化、抗炎、抗过敏反应、抗菌、抗病毒和抗癌等功能[29-30]。如图6所示,真空冷冻干燥处理下发芽青稞的黄酮含量最高,为(3.21±0.11) mg/g。说明低温真空对黄酮有很好的保护作用。真空干燥与热风干燥、热泵干燥的黄酮含量无显著性差异(P<0.05),这说明在干燥过程中,O2对青稞黄酮含量的影响不大。发芽青稞经微波干燥后的黄酮含量最低,为(2.62±0.14) mg/g。微波干燥的时间虽然较短,但干燥中较高的辐射温度造成了黄酮的损失。

图6 干燥方式对发芽青稞黄酮含量的影响Fig.6 Effect of drying methods on the total fla onoids content of germinated highland barley
2.3.4 对发芽青稞核黄素含量的影响
核黄素是人类饮食中必不可少的化学成分,在人体中作为辅酶起作用,它涉及到碳水化合物,脂质和蛋白质的代谢[16]。如图7所示,微波干燥和冷冻干燥具有相同的核黄素含量,为2.24 g/g。核黄素含量依次为微波干燥=冷冻干燥>热泵干燥>真空干燥>热风干燥。核黄素在中性和酸性条件下对热稳定,在碱性条件下受热易分解,同时核黄素在光照条件下也易分解。在干燥过程中造成核黄素损失的主要原因是光照,微波干燥的时间较短,受到的光照时间较短,热风干燥、热泵干燥和真空干燥在干燥过程中时间较长导致了核黄素的损失。
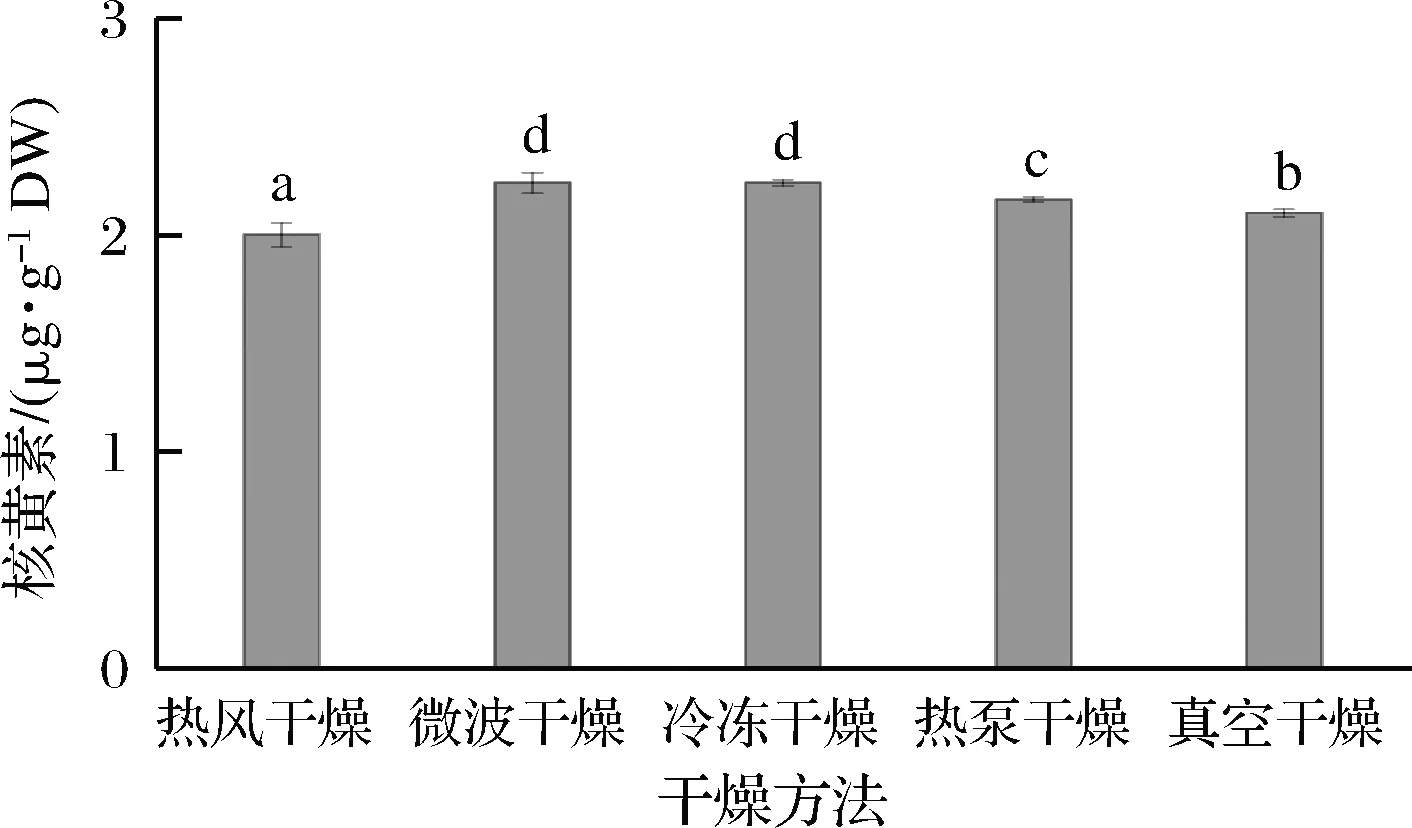
图7 不同干燥方式对发芽青稞核黄素含量的影响Fig.7 Effect of different drying methods on the ribofla in content of germinated highland barley
2.3.5 对发芽青稞β-葡聚糖含量的影响
β-葡聚糖是青稞中主要活性物质之一,具有调节血糖浓度、降低血液中胆固醇水平、调节肠道菌群、增强机体免疫力等功能[31]。如图8所示,冷冻干燥β-葡聚糖含量最高,为(4.90±0.16)%,说明冷冻干燥能够有效的保护β-葡聚糖的活性。微波干燥β-葡聚糖含量较低,为(3.09±0.16)%,微波干燥特殊的热辐射会加速β-葡聚糖的分解和向其他化合物的转化[9],多糖在富氧环境或在高温条件下,也会使分子间氢键断裂和羟基氧化,从而影响多糖的质量。经热风干燥后的发芽青稞β-葡聚糖含量为(2.98±0.12)%,这可能是因为多糖分子在高温条件下,特别是在湿热的空气中,容易聚集,从而破坏了多糖的结构[32]。
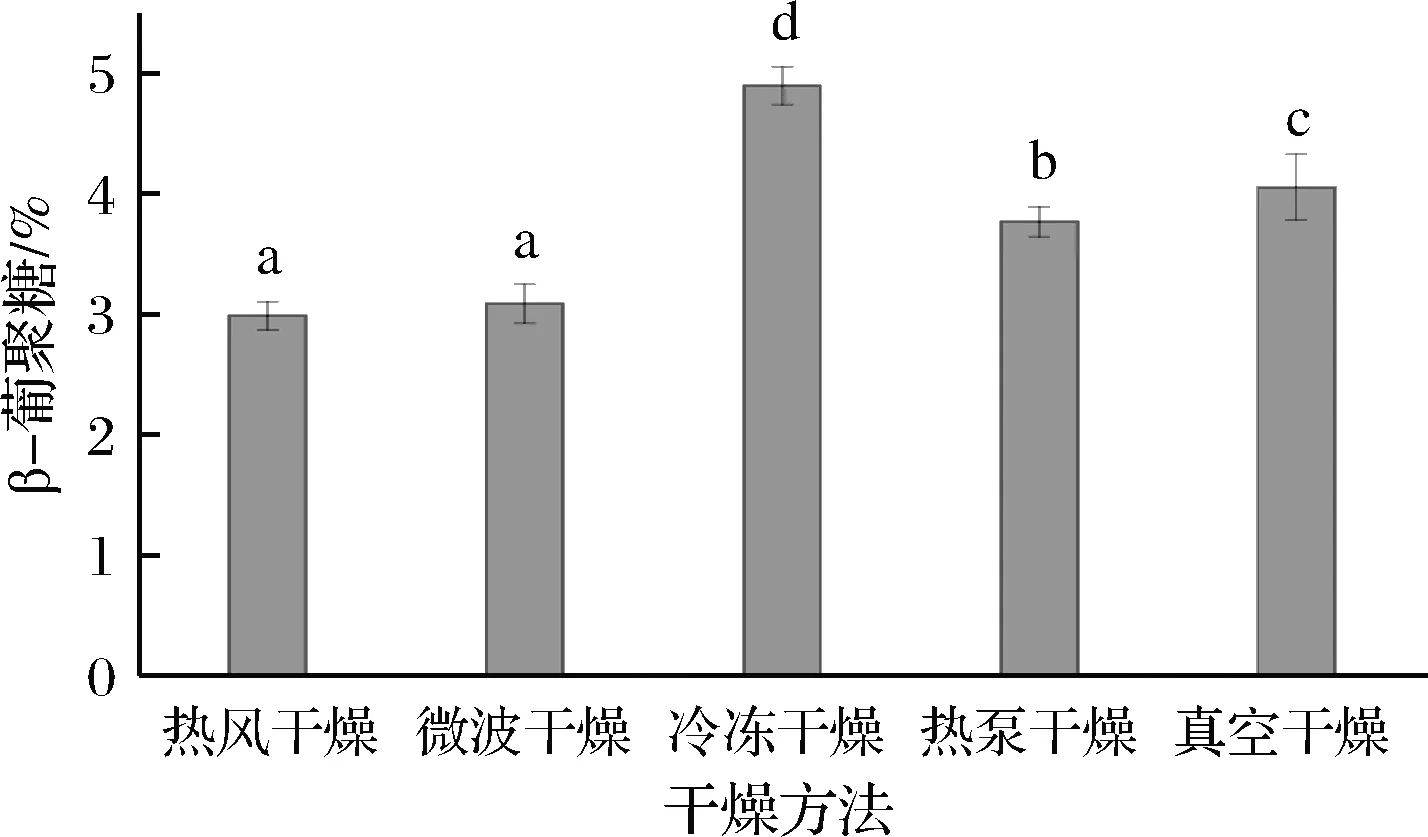
图8 干燥方式对发芽青稞β-葡聚糖含量的影响Fig.8 Effect of drying methods on the-glucan content of germinated highland barley
2.4 不同干燥方式下发芽青稞的加权综合评分
以发芽青稞的色泽、收缩率、复水率、硬度、γ-氨基丁酸、多酚、黄酮、核黄素、β-葡聚糖为指标,运用变异系数法求出了各项的平均值、标准差、变异系数和权重,结果如表2所示,干燥方式对收缩率、色泽、γ-氨基丁酸、β-葡聚糖影响比较大。
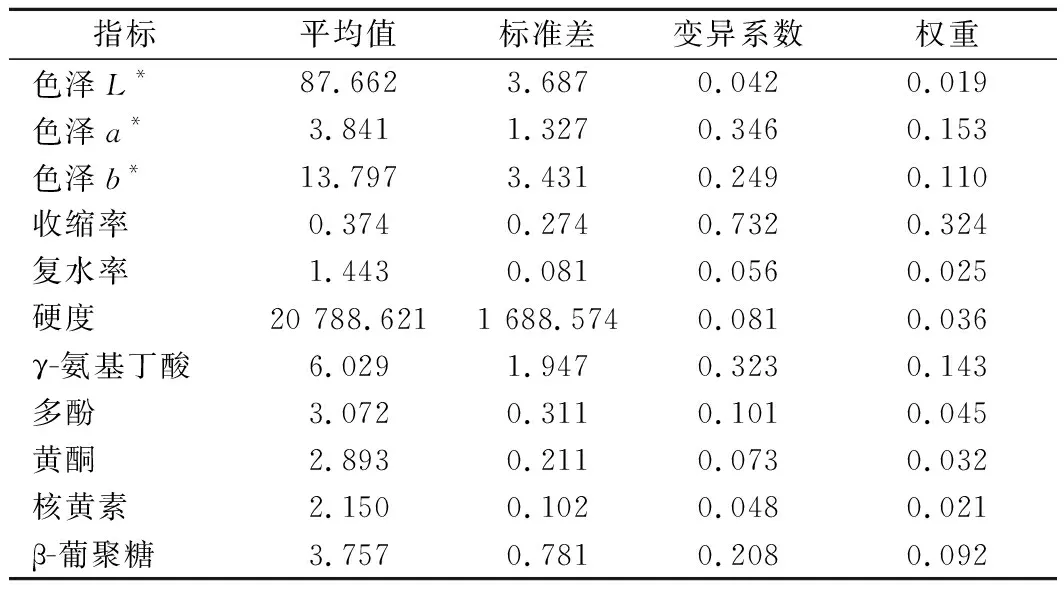
表2 不同干燥方式下发芽青稞各指标的权重Table 2 Proportions of indicators of germinated highland barley subjected to different drying methods
将5种干燥方式所得的11项指标进行标准化,将标准化值与各指标的权重相乘得到综合评分,由表3可知,发芽青稞产品品质的高低顺序为:冷冻干燥>热泵干燥>真空干燥>热风干燥>微波干燥。

表3 发芽青稞的品质评价Table 3 Quality e aluation of germinated highland barley
3 结论
通过研究发现,干燥方式对发芽青稞的品质有着显著的影响。冷冻干燥有着相对最小的收缩率、最高的复水率和功能性成分含量,同时还保留了完整的细胞结构,但是冷冻干燥的成本较高,难以适用于实际生产。微波干燥保持了较低的收缩率和硬度,还有最高的复水率和多酚含量,但是微波干燥减少了其他成分的含量,破坏了青稞细胞的完整结构。热风干燥、热泵干燥和真空干燥有着较高的收缩率、硬度,更为致密的微观结构和较低的复水率,同时它能较好地保持生物活性成分。综合评分表明,热泵干燥既能较好地保留青稞的化学成分,又能减少对青稞物料的破坏,具有较好的应用价值。
