豌豆种皮水溶性多糖的提取优化、动力学与分子特征
2020-11-20瞿琳艾连中赖凤羲张汇
瞿琳,艾连中,赖凤羲,张汇
(上海理工大学 医疗器械与食品学院,上海食品微生物工程技术研究中心,上海,200093)
豌豆(Pisumsati umL.)是世界第四大食用豆类作物,根据联合国粮食及农业组织统计[1],2018年我国豌豆种植面积约为100.01万公顷,年产量约占全球产量的11.3%,位居世界第四[1]。豌豆在加工生产豌豆淀粉和豌豆蛋白的过程中会产生豌豆种皮(通称为壳)废弃物,如何提高豌豆种皮的应用价值并减少加工废弃物是产业界亟待解决的课题。豌豆种皮富含膳食纤维,包括纤维素(68.8%)、半纤维素(7.5%)以及果胶(16.8%)[2],故开发豌豆种皮中的膳食纤维[3-4]、果胶[5-6]或高附加值的单糖(木糖、阿拉伯糖)[7]为可行的解決方案。
豌豆种皮的可溶性多糖组成相当复杂,包括果胶和半纤维素[8]。LE等[9]依序以冷碱液、酸液加热及中性溶液进行提取,发现6种多糖区分,其中碱提取多糖主要为聚阿拉伯糖和果胶(为第一型鼠李糖聚半乳糖醛酸RG-I);酸提取物主要为不含阿拉伯糖的果胶和果胶酸;而中性溶液提取物为果胶酸。以酸液直接提取豌豆种皮的多糖以果胶为主,GUTÖHRLEIN等[6]发现温和酸液所得果胶含有同型聚半乳糖醛酸、木糖聚半乳糖醛酸以及RG-I;高酸高温提取会提高产物的糖醛酸含量,但降低分子量和得率; 所得皆为低甲氧基果胶。采用乙二胺四乙酸加聚半乳糖醛酸酶和纤维素酶辅助提取时,14种商业豌豆种皮可提取的果胶得率为9%~12% (以半乳糖醛酸为指标)[5]。
然而,上述豌豆种皮多糖提取方法工艺复杂,成本高,高附加值的多糖(聚阿拉伯糖和聚木糖)易被酸降解而损失等。本研究针对豌豆种皮水溶性多糖进行探讨,建立热水提取工艺的优化条件,阐明提取动力学参数以及解析多糖产物的单糖组成与分子特性等。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
豌豆(Pisumsati umL.)种皮,山东烟台鼎丰生物科技有限公司;单糖标准品—岩藻糖(Fuc)、鼠李糖(Rha)、阿拉伯糖(Ara)、半乳糖(Gal)、葡萄糖(Glc)、木糖(Xyl)、核糖(Rib)、半乳糖醛酸(GalA)、葡萄糖醛酸(GlcA),美国Sigma-Aldrich化学公司;间羟基联苯,上海源叶生物科技有限公司;苯酚、浓硫酸、四硼酸钠、三氟乙酸、硝酸钠、醋酸钠、NaOH,分析纯,国药集团化学试剂有限公司;无水乙醇,分析纯,上海泰坦科技股份有限公司。
1.1.2 仪器设备
725型紫外分光光度计,上海光谱仪器有限公司;8400型凯氏定氮仪,美国FOSS有限公司;DionexTMICS-5000+离子交换色谱系统,美国 Thermo ScientificTM公司;AligentTM1260高效分子筛色谱仪-多角度激光光散射(high performance size exclusion chromatography-multiangle laser-light scattering,HPSEC-MALLS),美国 Wyatt Technology 公司。
1.2 实验方法
1.2.1 豌豆种皮水溶性多糖提取物的制备
将豌豆皮烘干、粉碎后过筛,称取20 g豌豆种皮粉末,以一定的液料比混合,在一定温度下进行一定时间提取。粗提取液经6 000 r/min离心 10 min得上清液,旋转蒸发溶液至原体积的1/3~1/2,然后加入2倍体积的体积分数为95%的乙醇,搅拌均匀于4 ℃下过夜静置后,6 000 r/min离心10 min取下层沉淀物,由乙醇脱水2次后,真空干燥,制得豌豆皮水溶性多糖提取物。优化条件下提取所得的多糖以PPW代号表示。
1.2.2 单因素试验
以原料粒度80目、液料比25∶1 (mL∶g)、提取温度90 ℃和提取时间1.5 h为中心条件,探讨改变其中一个因素的影响,设计条件如下: 原料粒度 40、60、80、100及120筛目;液料比 15∶1、20∶1、25∶1、30∶1及35∶1 (mL∶g);提取温度80、85、90、95及100 ℃;提取时间0.5、1、1.5、2及2.5 h。以豌豆皮水溶性多糖提取物的得率作为评价指标。
1.2.3 响应面试验设计
根据单因素试验的结果,选取对提取物得率影响较大的3个因素(液料比、提取温度及提取时间)作为自变量,采用3因素3水平Box-Behnken响应面试验设计,因素水平设计如表1所示。其中中心条件(0,0,0)5平行,采用随机顺序进行试验以减少实验环境的误差。以豌豆皮水溶性多糖提取物的得率作为评价指标。

表1 豌豆种皮水溶性多糖提取条件的三因素与三水平Table 1 Three factors and three le els for extraction of water-soluble polysaccharides from Pisum sati um L.seed pericarp
1.2.4 提取动力学参数分析
假设豌豆种皮粉粒呈球状,多糖分子均匀地扩散溶出以及多糖从豌豆皮粉末材料内部溶出速率的主要限制因子为扩散速率,根据菲克(Fick)第二定律一级扩散动力学模式,多糖溶出浓度和提取时间的动力学关系可用公式(1)[10]表示,其中Ct为提取时间t(min)时溶液中多糖的浓度;Ceq为长时间下最终达平衡的最大多糖浓度;k1为一级扩散速率常数(min-1),类似声波辅助提取韭菜多糖[11]、甘草多糖[12]和地木耳多糖[13]的情況。假设溶出的多糖大部分被乙醇沉淀收集得到,则公式(1)的多糖提取动力学模型可以得率替代浓度,则可得到公式(2), 其中Yt为时间t(min)下的得率(%);Ym为最终平衡所得的最大得率(%)。公式(2)经整理得公式(3),其中(Ym-Yt)/Ym为相对提取率(Rext)。公式(3)经倒数和对数处理得公式(4),将ln[Ym/(Ym-Yt)]对时间t作图,即得斜率k1(min-1)。则可求得半数提取时间(t1/2, min)如公式(5)所示。
Ct=Ceq×(1-exp-k1·t)
(1)
Yt=Ym×(1-exp-k1·t)
(2)
(Ym-Yt)/Ym=exp-k1·t
(3)
ln[Ym/(Ym-Yt)]=k1·t
(4)
t1/2=ln 2/k1
(5)
如果豌豆多糖的溶出提取受到多种因素影响,不是遵循理想的一级扩散动力学模式,而是n级动力学模式,类似海藻油的提取情况[14],则可以公式(6)表示,其中dYt/dt为时间t(min)下的得率增加速率;kn为n-级提取速率常数;Yu为尚未溶出的可溶性多糖的得率。公式(6)取对数得公式(7),ln (dYt/dt) 对lnYu作图,可得斜率n及截距lnkn,kn单位为min-1。
(6)
ln(dYt/dt)=lnkn+n·lnYu
(7)
1.2.5 总糖含量的测定
采用苯酚-硫酸法[15]测定总糖含量。根据主要单糖组成决定混合糖标准品为M(阿拉伯糖)∶M(木糖)∶M(葡萄糖)∶M(半乳糖醛酸)的=1∶0.5∶0.6∶0.65。4种糖预先混合后,称取10 mg混糖标准品,去离子水定容至10 mL容量瓶得标准液,并将标准液稀释成质量浓度为0.02~0.1 mg/mL标准液。配制10 mL 0.1 mg/mL PPW样品溶液,经80 ℃加热15 min以完全溶解并冷却。取标准液及样品液各1 mL于试管中,加入0.5 mL 30 g/L苯酚溶液,混合均匀后迅速加入5 mL浓硫酸,振荡混匀放入85 ℃水浴锅中反应30 min,在波长490 nm处测定吸光度,以混糖标准品质量浓度X(mg/mL)为横坐标,吸光度Y为纵坐标,绘制标准曲线,计算后获得回归方程为Y=7.365X-0.003 8 (R2=0.999)。将样品PPW的吸光度带入回归方程中,求出样品中总糖质量浓度,样品中的多糖含量按公式(8)计算。

(8)
1.2.6 糖醛酸含量的测定
采用间羟基联苯法[16]测定糖醛酸含量。配制10 mL 0.1 mg/mL的PPW样品溶液,以及0.01~0.1 mg/mL半乳糖醛酸标准品溶液,各取1 mL于试管中,在冰水浴下加入6 mL四硼酸钠/浓硫酸溶液,充分振荡混合均匀,沸水浴10 min后取出,冷却至室温,加入0.1 mL 1.5 mg/mL间羟基联苯溶液,反应20 min后,测定在波长525 nm下的吸收值并建立标准曲线方程:Y=14.92X-0.020 4(R2=0.999)。将样品PPW的吸光度带入计算所得的回归方程中,求出其中糖醛酸质量浓度,样品中糖醛酸含量按公式(9)计算。

(9)
1.2.7 蛋白质含量的测定
采用凯氏定氮法[17]测定蛋白质含量。称取2.000 g固体PPW样品至消化管中,加入5粒催化粒后于消化炉中进行消化。蛋白质含量按公式(10)计算:
蛋白质含量/%=氮含量×6.25
(10)
1.2.8 灰分含量的测定
采用GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》[18]。准确称量瓷坩埚质量(m1),反复灼烧至前后2次称量相差不超过0.5 mg为恒重。称取5.000 0 g样品于瓷坩埚中,先在200 ℃下灼烧1 h,使样品充分炭化至无烟,再在550 ℃下灼烧6 h后,冷却至200 ℃取出,放入干燥器中冷却30 min,准确称取其恒重(m2)。样品中灰分的含量按公式(11)计算:

(11)
1.2.9 单糖组成测定
称取10 mg多糖样品于具塞试管中,加入2 mL去离子水,在80 ℃下加热磁力搅拌30 min,使样品充分溶解,再加入0.4 mol/L三氟乙酸溶液,密封后于110 ℃烘箱中反应3 h,使其充分水解。取出冷却至室温后,用氮吹仪吹干,并反复3次加入甲醇至吹干,最后加入2 mL的超纯水溶解水解物,稀释20倍,经0.22 μm微孔膜过滤后,进行高效阴离子交换色谱分析。
采用Thermo ICS-5000+高效阴离子交换色谱串联脉冲安培检测器分析样品的单糖组成。色谱柱:串连保护管柱(3 mm×30 mm)的CarboPacTMPA20(3 mm×150 mm);进样量25 μL;洗脱条件:20 mmol/L NaOH溶液 20 min,然后提高醋酸钠浓度梯度50~200 mmol/L 10 min;流速0.5 mL/min;管柱温度30 ℃。采用Chromeleon 7 软件进行数据采集、处理和分析。经对照9种单糖标准品的洗脱尖峰和标准检量线进行样品单糖组成的定性和定量分析。
1.2.10 分子质量、分子粒径与固有黏度的测定
多糖样品用0.1 mol/L NaNO3溶液配制1 mg/mL的溶液,经0.22 μm微孔膜过滤后进行高效体积排阻色谱(hight performance size exclusion chromatography,HPSEC)系统分析。色谱柱:OH-pak SB-805HQ (8.0 mm×300 mm)和OH-pak SB-803HQ (8.0 mm×300 mm)串联;流动相0.1 mol/L NaNO3溶液(含0.02% NaNO3);流速0.6 mL/min;柱温40 ℃;进样量100 μL。采用ASTRA 7.1.3软件进行数据采集、处理和分析。
1.2.11 数据处理与统计分析
实验重复3次,数据以平均值±标准偏差表示。采用Origin Pro 8.0软件进行绘图与动力学参数的计算。以SPSS statistics 17.0软件对单因素试验提取结果进行one-way ANO A显著差异分析。以Design-Expert 8.0.6 软件进行响应面的多项式模型分析、方差分析和绘图。
2 结果与讨论
2.1 单因素提取条件对豌豆种皮水溶性多糖得率的影响
图1-a显示随着筛网目数从40目提高到80目时, 以90 ℃、1.5 h提取条件所得多糖得率由2.63%增加到4.32%(最高值),提高目数到100~120目时无利于提高得率且轻微地降低得率,可能与粉体太细、黏附性太高导致得率降低[19]有关。由于通过40、60、80、100和120目的粉粒粒径分别是0.38、0.25、0.18、0.15和0.12 mm,故知提取豌豆种皮多糖的最佳粉粒粒径为0.18 mm。因此本研究选择过80目的原料粒度进行后续所有的多糖提取试验。图1-b显示,随着液料比从15∶1增加到25∶1(mL∶g)时,以90 ℃、1.5 h提取的得率从2.35%增加到4.23%,达到最大值,而液料比30∶1~35∶1 (mL∶g)时得率没有显著增加或减少,说明液料比增加有利于提高多糖的扩散溶出率[20],但多糖的溶出率有极限,过高的液料比对于多糖得率无显著帮助,因此选择液料比为25∶1进行后续多糖提取。在提取温度方面(图1-c),固定提取时间1.5 h下,随着提取温度从60 ℃升高到90 ℃,所得多糖提取物的得率从1.34%显著上升到4.21%,达到最大值,故高温促使多糖更易于溶出[21],100 ℃的得率没有显著异于90 ℃,所以选择提取温度为90 ℃进行不同提取时间的探讨。图1-d显示随着提取时间从0.5 h到1.5 h,多糖得率显著上升达到最大值(4.23%),更长的提取时间(2~2.5 h)所得得率无显著差异,趋向平衡此表明多糖的得率在提取时间增加到1.5 h之后达到动态平衡[22]。综合以上结果,决定液料比25∶1 (mL∶g)、提取温度90 ℃和提取时间1.5 h为后续响应面优化试验设计的中心条件。

a-原料粒度;b-液料比;c-提取温度;d-提取时间图1 原料粒度、液料比、提取温度及提取时间对豌豆种皮水溶性多糖得率的影响。Fig.1 Effects of granular size, liquid-solid ratio, extraction temperature and extraction time on the yield of water-soluble polysaccharides from P.sati um L. seed pericarps注:不同字母(a-d)表示数据之间有显著差异(P<0.05)
2.2 豌豆种皮水溶性多糖的提取条件的优化
表2显示17组响应面优化试验设计的提取条件所得多糖的得率,以第16组(提取条件为液料比25 mL/g、80 ℃、2 h)的1.47%最低;第15组(液料比25 mL/g、100 ℃、2 h)的4.45%最高;5个平行的中心条件 (第8、10、11、12和17组,液料比25 mL/g、90 ℃、1.5 h)所得提取物得率介于4.22%~4.36%之间。
表2的得率经多项式回归模型与方差分析结果显示于表3。最小平方差的回归方程式为:Y=-71.98+0.649X1+1.439X2-1.98X3+ 3.55×10-3X1X2+ 3.00×10-3X1X3+ 0.124X2X3-1.86×10-2X12-9.05×10-3X22-2.84X32。该模型的F值为245.69;P值<0.000 1,达到非常显著的水平。从F值和P值判断可知所有一次项和大部份的二次项都极显著,除了X1X3项不显著之外; 影响因子的显著性为提取温度(X2和X22)> 提取时间(X3和X32)> 液料比(X1和X12)。模型的失拟项P> 0.05,不显著,说明模型预测值与实际值拟合度达到显著水平; 模型的决定系数R2=0.997,表示该模型可描述实际数据的变化程度达99.7%。
根据表3的回归方程,将各项因素对多糖得率的交互作用解析如图2所示。图2-a为固定提取时间1.5 h下,提取温度和液料比对多糖得率的曲面图和等高线图。曲面图的对称性表明提取温度和液料比对多糖得率有明显的交互作用;等高线图呈横向椭圆形,显示温度的作用大于液料比的作用, 且在液料比27.5 mL/g和95 ℃条件下得率极大化达4.23%。由图2-b可知,当固定提取温度90 ℃时,曲面图显示提取时间和液料比对多糖得率也有显著的交互作用;等高线图也呈横向椭圆形,显示提取时间的影响大于液料比,且得率极大化(4.21%)是在液料比26.2 mL/g和1.65 h条件下。由图2-c可知,在固定液料比25 mL/g下,曲面图显示得率极大化方向是朝向高温度长时间的组合,即提取温度与时间的影响相当;等高线图清楚显示得率极大化的条件是96 ℃、1.8 h。

表2 不同提取条件下豌豆种皮水溶性多糖的得率Table 2 Yields of water-soluble polysaccharides from P.sati um L. seed pericarp under different extraction conditions
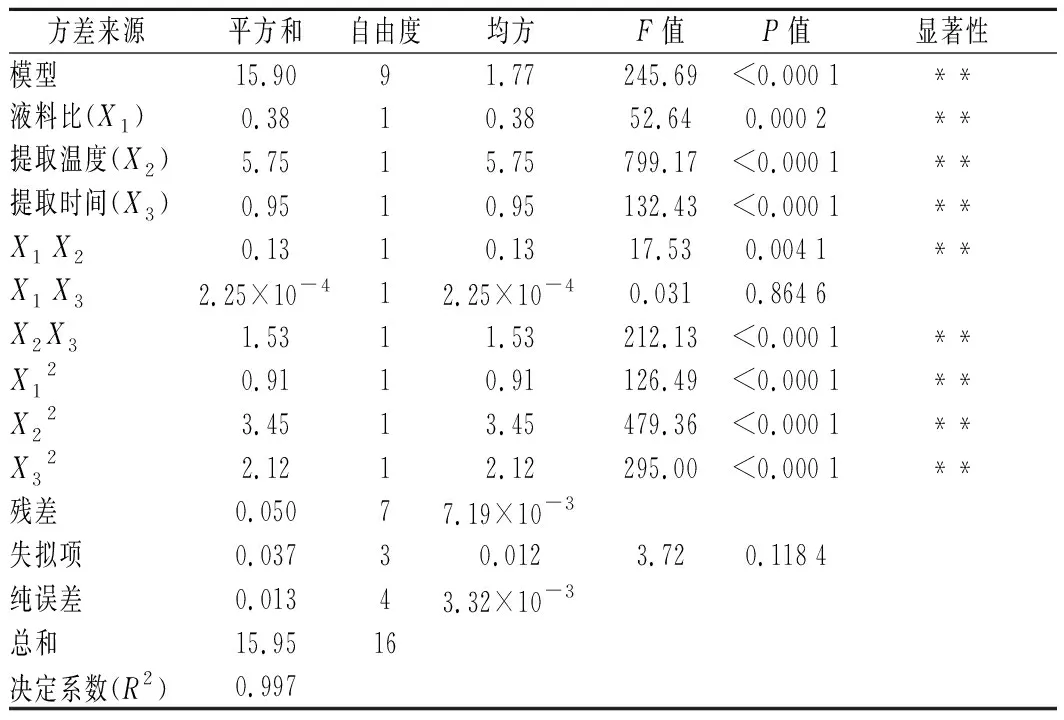
表3 豌豆种皮水溶性多糖得率的多元回归模型与方差分析结果Table 3 Predicted regression model and ANO A results for yields of polysaccharides from P.sati um L.seed pericarp

a-固定提取时间为1.5 h的曲面图和等高线图;b-固定提取温度为90 ℃的曲面图和等高线图;c-固定液料比为25 mL/g的曲面图和等高线图图2 提取因子对豌豆种皮水溶性多糖得率的交互作用响应面图Fig.2 Response surface plots and counter plots for interacti e effects of extraction factors on the yields of water-soluble polysaccharides from P.sati um L. seed pericarp
综合观之,响应面回归方析预测得出最优化的提取条件为:液料比为25.67 mL/g,提取温度为91.33 ℃,提取时间为1.57 h,预估可得水溶性多糖最大得率为4.46%。为了验证该模型的可靠性,采取容易操控的优化提取条件:液料比25∶1 (mL∶g),提取温度91 ℃,提取时间1.5 h,以40 g样品量进行3次提取试验验证,得到多糖得率为(4.39±0.41)%,实际值与理论值接近,说明回归分析方程式可靠,可以适切地预测实际值。本文发现提取因子对豌豆水溶性多糖得率的描述模型(表3)与鹰嘴豆(CicerarietinumL.)水溶性多糖[23]相似,模型的R2值皆高于0.99,且大部份的提取因子项的贡献非常显著(P<0.001)。
2.3 豌豆种皮水溶性多糖的提取动力学
由于图1-d为近似优化条件(液料比25 mL/g和90 ℃)下的多糖得率与提取时间的关系,可进一步数学处理以了解优化条件下的提取动力学参数,所得结果如图3所示。图3-a显示豌豆水溶性多糖的相对提取率Rext(公式(3))随提取时间(t)有降低的趋势,可以多项式Rext= 0.008 5t2-1.863t+100.7(R2=0.999)适切地描述。图3-b为一级扩散动力学关系(公式(4)),显示豌豆水溶性多糖的提取反应呈现两阶段速率常数,前期(0~60 min)的速率常数k1(即斜率)为0.028 8 min-1;后期(60~120 min)的k1为0.090 7 min-1,大约为前期的3倍,线性回归的相关系数都很高(R2= 0.971);求得前期和后期的半数提取时间(t1/2) (公式(5))分别为24.1和7.6 min。这后期提取速率常数高于前期的现象可能与后期豌豆种皮粉粒充分水合膨润、促进多糖扩散溶出有关。图3-c为假设多糖的提取反应为n级动力学(公式(7))所得的线性关系, 斜率(n值)为0.809,截距(lnkn)为-3.742 5,即kn= 0.023 7 min-1,相关系数R2高达0.987;得半数提取时间(t1/2)为29.2 min。
综合而言,在本研究范围内,豌豆种皮水溶性多糖的提取动力学为两阶段的一级扩散控制的动力学模式,但整体上为一阶段的伪一级(n=0.81)动力学模式,可能受原料因素(包括粒径大小、几何形状、组成成分和结构)等所影响。其中一级扩散反应的前期k1值接近于n级反应的kn值。图3-b和图3-c的动力学回归线具有很高的相关系数,显示在本研究分析范围内多糖提取主要受扩散控制的溶出行为所主导,热降解反应[11-13]并不明显,可忽略。本研究的豌豆种皮热水可溶性多糖的一级提取速率常数, 前期k1(0.029 min-1)接近超声波辅助提取甘草多糖的速率常数(k=0.015~0.046 min-1,在温度323~353 K、声波功率420~600 W下)[12],而后期k1(0.091 min-1)接近超声波辅助提取韭菜多糖的速率常数(k=0.088~0.097 min-1,在温度303~323 K、声波功率240~480 W下)[11]。

a-相对提取率;b-一级扩散反应模式;c-n级反应模式图3 豌豆种皮水溶性多糖的提取动力学Fig.3 Extraction kinetics for water-soluble polysaccharides from P.sati um L. seed pericarps注:得率数据来自图1-d的平均值
2.4 豌豆种皮水溶性多糖的化学成分及单糖组成
上述优化提取条件所得水溶性多糖PPW经化学组成分析,结果如表4所示。豌豆种皮多糖PPW的总糖质量分数为68.68%,糖醛酸质量分数为23.55%,蛋白质质量分数为8.03%,灰分质量分数为2.13%。在单糖组成方面,PPW的单糖组成种类多,摩尔分数最高的是阿拉伯糖(40.13%),其次是木糖(22.39%),半乳糖醛酸(17.53%),以及少量的葡萄糖(8.07%)、半乳糖(7.51%)及鼠李糖(4.36%)。
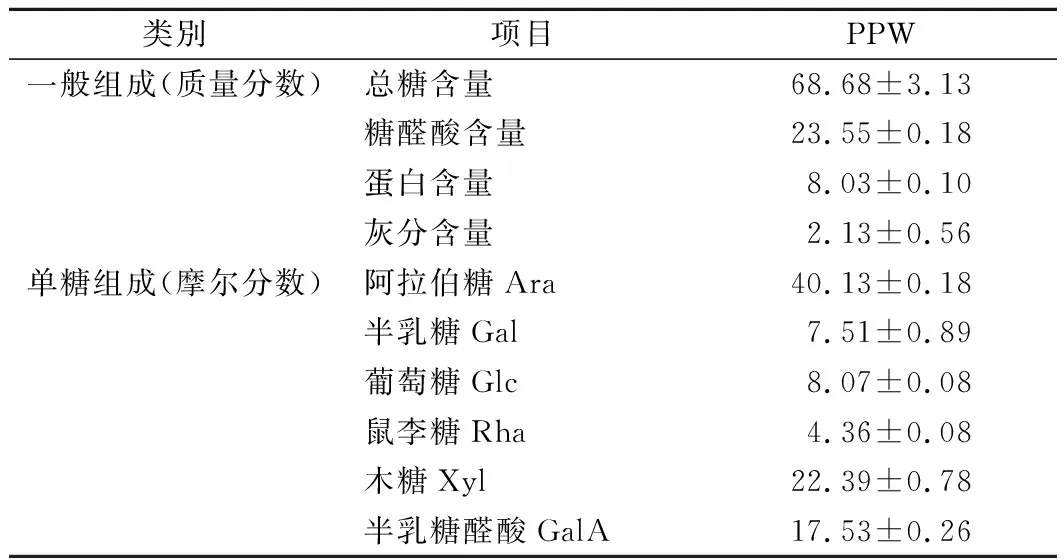
表4 豌豆种皮水溶性多糖的一般组成及单糖组成 单位:%
2.5 豌豆种皮水溶性多糖的分子质量分布、分子粒径与固有黏度
图4为PPW在0.1 mol/L NaNO3溶液中分子质量分布的HPSEC-MALLS 色谱图,示差检测器(RI)信号(溶质浓度的指标)尖峰分布宽广,呈现3个色谱尖峰在22、27和33~34 min, 尖峰占比分别为18.6%、61.7%、和19.7%。光散(LS)信号(分子粒径的指标)显示1个主要尖峰在21 min处,伴随1个肩峰在18 min处。基于RI和LS信号计算所得分子质量(Y坐标)在18~27.5 min (即分子质量为7×104~7×106g/moL)之间呈直线性的关系,显示此区段的多糖分子构形特征有一致性,分子的色谱层析行为符合体积排阻分析原理,可正确地检测样品的分子性质参数;而27.5~35 min区呈不规则波动,可能因LS信号太弱导致计算得的分子质量线波动或不准所致。3个尖峰所对应的分子质量分别为1.3×106、7×104和6×104g/mol,即 1 300、70和60 kDa。

图4 豌豆种皮水溶性多糖的HPSEC-MALLS 色谱图谱Fig.4 HPSEC-MALLS chromatogram for water-soluble polysaccharides from Pisum sati um L.seed pericarp
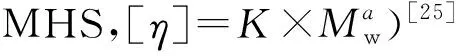
构形参数ρ值和MHS参数α值均与多糖在溶液中的构象有关。理论上,ρ值为0.775时多糖构象为紧密球体;1.5~1.8时呈柔软无规则卷曲状;≥2时为伸展性杆状;ρ值越大反应链的刚性越大[24]。而MHS参数 α值为0~0.33时多糖呈球状; 0.5~0.8时呈柔软无规则卷曲状; >0.8时呈半柔软申展性链;1.8~2时为硬短杆状[25]。PPW的ρ值1.38、α值0.372, 反映其在HPSEC分析时(0.1 mol/L NaNO3溶液中)的分子链构象呈柔软无规则卷曲松散的球状。
2.6 不同提取条件和豆科种类的影响
针对豆科种皮水溶性多糖提取的优化条件,本研究的豌豆水溶性多糖的提取条件(液料比25 mL/g, 91 ℃, 1.5 h)与鹰嘴豆水溶性多糖(液料比24 mL/g, 99 ℃, 2.8 h)[23]及大豆水溶性多糖(液料比25 mL/g, 90 ℃, 68 min, pH 5.5)[26]的提取条件部分相近似。
比较豌豆种皮以不同溶液直接提取的多糖,在得率方面,本研究的水溶性多糖得率(4.4%)接近高酸中温提取(3.3%~4.8%)[6],但低于柠檬酸液提取的(9.8%)[6]以及采用乙二胺四乙酸加聚半乳糖醛酸酶和纤维素酶辅助提取的果胶得率(9%~12%)[5]。在单糖组成方面,本研究的水可溶性多糖(阿拉伯糖∶木糖∶半乳糖醛酸摩尔比=1∶0.55∶0.45)比冷碱溶性多糖(阿拉伯糖∶木糖∶半乳糖醛酸摩尔比=1∶0.28∶0.79)[2]具有相似的阿拉伯糖比率、较高的木糖比率及较低的半乳糖醛酸比率,显示热水可溶多糖含有较多聚木糖、较少的果胶含量,但聚阿拉伯糖在热水和冷碱溶提得的多糖中存在量相似。且豌豆水可溶性多糖的中性糖含量高达82.5%,高于高酸提取得的多糖(为低甲氧基果胶)的中性糖含量(15%~36%)[6]。
比较不同豆科种皮的热水可溶性多糖,本研究的豌豆水溶性多糖比鹰嘴豆水溶性多糖(半乳糖醛酸∶半乳糖∶阿拉伯糖摩尔比=42∶23∶13)[27]和大豆水溶性多糖SHP-1[M(半乳糖醛酸)∶M(半乳糖)∶M(阿拉伯糖)∶M(鼠李糖)=47∶18∶14∶15][28]具有较多的聚阿拉伯糖和聚木糖、较少果胶。不同地,绿豆(ignaradiataL.)水溶性多糖含有M(甘露糖)∶M(半乳糖醛酸)∶M(半乳糖)=34∶22∶18[29]。WANG等[30]发现大豆种皮水溶性多糖的乙醇区分物含多量的甘露糖摩尔分数较高(27%~61%)[30],而非YANG等[28]所发现的富含半乳糖醛酸,可能是提取条件不同所致。大致上,豌豆种皮水可溶性多糖富含聚阿拉伯糖和聚木糖; 鹰嘴豆种皮水溶多糖富含果膠; 綠豆种皮水溶性多糖富含聚甘露糖; 而大豆种皮水溶性多糖富含果胶或聚甘露糖。
3 结论
本研究利用响应面试验设计和统计分析法,优化制备豌豆种皮热水溶性多糖的最佳条件为:液料比25 mL/g,提取温度91 ℃,提取时间1.5 h,最大得率为4.4%,所得回归方程式模型的适用性非常显著(P<0.001)。多糖得率与提取时间的关系可以两阶段的一级扩散动力学模式,或以一阶段的伪一级(n=0.8)动力学模式来描述都非常适切。所得多糖的主要单糖组成摩尔比为阿拉伯糖∶木糖∶半乳糖醛酸=1∶0.55∶0.45。整体分子的Mw为338.9 kDa;PDI为3.67;Rg为46.8 nm;ρ值为 1.38;[η]为85.8 mL/g;MHS参数α为0.372。分子链构象呈柔软无规则卷曲松散的球状。比较多种豌豆种皮多糖的单糖组成和分子量分布图,可推知该水可溶性多糖含有聚阿拉伯糖、聚木糖和果胶,非常适合用来制备高附加值的聚阿拉伯糖和聚木糖,不同于其他豆科。本研究成果可为将来量产功能性豌豆多糖和产业应用提供理论基础,为豌豆加工企业资源综合利用提供新的有效途径。此外,分离、纯化和规格化豌豆在种皮多糖区分物、解析其结构-生物活性关系的研究也值得深入探讨。
