嵌合蛛丝蛋白Flag-MaSp1重复模块的表达及二级结构分析
2020-11-19田露阳
田露阳,孟 清,林 瑛
(东华大学化学化工与生物工程学院,中国上海201620)
蜘蛛丝是一种综合性能优越的天然生物材料,具有优异的机械强度和生物学特性。与蚕丝和目前的人造纤维材料相比,蜘蛛丝有着更为巨大的潜在应用价值,在生物材料和组织工程等领域具有广阔的应用前景[1~4]。
圆网蜘蛛具有7种类型的特殊分泌腺,它们分泌产生7种具有不同特定功能的蛛丝和胶状物质[4],这些功能包括防止坠落、束缚猎物、编织蛛网、包裹卵袋等[5~6]。不同类型的蛛丝蛋白在氨基酸序列、物理性质及功能上各不相同[7]。蛛丝蛋白的一级结构均包括高度保守的非重复的N端(N-terminal domain,NT)、C 端(C-terminal domain,CT)以及占比达90%以上的重复区域[8]。蛛丝蛋白的机械性能主要与重复模块(repetitive module,R)的序列有关[8~9]。
在7种类型的蛛丝蛋白中,鞭状腺丝蛋白(flagelliform spidroin,Flag)的一级结构具有3个特征:1)含有多个Gly-Pro-Gly-Gly-X结构域;2)含有多个带电和亲水性氨基酸的高度保守间隔区;3)具有非重复的C端,这些结构的组合赋予鞭状腺丝最高的弹性,使其可以拉伸至自身长度的 200%[10~11]。主壶腹腺丝蛋白 1(major ampullate spidroin,MaSp1)的氨基酸序列分为三类,包括多聚丙氨酸的结构域(poly Ala/Gly-Ala)、富含甘氨酸的结构域(Gly-Gly-X)以及非重复的N端和C端[7]。Gly-Gly-X参与形成的310-螺旋在β-折叠片层之间以及蛋白质分子中相邻的Gly-Gly-X螺旋之间起连接作用,以促进纤维的排列[12]。Poly-Ala自发形成反向平行的β-折叠,赋予拖丝优越的机械性能[13],这与其他蛛丝蛋白中的报道相一致,成丝过程中由无序及其他结构形成的β-折叠结构,被认为是丝纤维具有高拉伸强度的原因[14~15]。Teulé等[16]构建了含Flag和MaSp2共有重复序列的嵌合蛋白,并发现嵌合蛋白共有重复序列的总体结构决定了纤维的机械性能。因此,为制备具有人们所需机械性能的嵌合蛛丝纤维,了解嵌合蛛丝蛋白的二级结构至关重要。
本文首先构建重组蛋白嵌合体,它包含长度相近的两个模块,即Flag蛋白的重复模块与MaSp1蛋白的重复模块。将重组蛋白嵌合体纯化后去除外源标签,并利用手工拉丝的方法制备嵌合丝纤维。然后,使用圆二色谱(circular dichroism spectrum,CD spectrum)及傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)对成丝前后的嵌合蛛丝蛋白的二级结构进行分析;利用扫描电子显微镜(scanning electron microscope,SEM)对丝纤维的表面形态进行表征,进而分析并预测其潜在的力学性质。研究结果为制备嵌合蛛丝纤维提供了研究方向和理论基础。
1 材料与方法
1.1 材料
分子克隆使用的DNA小量抽提试剂盒、DNA胶回收试剂盒、PCR产物纯化试剂盒等均购于上海生工生物工程股份有限公司;DNA分子量标准Trans 2K PlusⅡ购于北京全式金生物技术有限公司;限制性内切酶以及T4 DNA连接酶购于美国ThermoFisher Scientific公司;PCR中用到的Taq DNA聚合酶购于南京诺唯赞生物科技有限公司。重组蛋白质表达所使用的宿主菌E.coli T1和BL21(DE3)购于北京全式金生物技术有限公司。重组蛋白质纯化所用的镍柱购于德国Qiagen公司。Western-blot所用的PVDF膜购于德国Merck公司,ECL化学发光底物购于美国Invitrogen公司,6×His标签的特异性抗体及HRP标记的羊抗鼠IgG二抗购于天津迈基生物科技有限公司。pGHScRp1及pGH-MaSp1R质粒委托上海捷瑞生物工程有限公司进行全基因合成。引物合成和DNA测序由上海生工生物工程股份有限公司完成。
1.2 重组质粒的构建
以pGHScRp1质粒(含FlagR序列)为模板,表1中的Flag-P1及Flag-P2为引物,PCR扩增得到FlagR片段。PCR条件如下:95℃预变性5 min;95℃变性30 s,65℃退火30 s,72℃延伸30 s,72℃补平10 min,循环数30个。对PCR产物进行BglⅡ和XhoⅠ双酶切,对本课题组改造的pET-32a表达载体pEHS(含6×His-SUMO标签)及上述获得的FlagR片段同时进行BamHⅠ和XhoⅠ双酶切,使用T4 DNA连接酶将片段和载体相连接,得到过渡质粒pEHS-FlagR。根据大腹园蛛(Araneus ventricosus)MaSp1的mRNA序列(GenBank登录号:JN857964.2),取一个长696 bp、编码232个氨基酸的完整重复区,记作MaSp1R,对完整序列进行大肠杆菌密码子优化后委托上海捷瑞生物工程有限公司进行全基因合成,并在两端加入BamHⅠ和SpeⅠ酶切位点。对合成质粒pGH-MaSp1R及过渡质粒pEHS-FlagR同时进行BamHⅠ和SpeⅠ双酶切,随后连接得到重组质粒pEHS-FlagR-MaSp1R。
1.3 嵌合蛛丝蛋白的表达与纯化
将重组质粒pEHS-FlagR-MaSp1R转化至E.coli BL21(DE3)中,37℃培养过夜。挑取单克隆,接种于含氨苄青霉素(ampicillin,Amp)抗性的10 mL LB培养基中,于37℃、180 r/min条件下过夜培养;将菌种转接于Amp(终质量浓度为100 μg/mL)抗性的LB培养基中,培养至OD600为0.6~0.8,随后加入终浓度为0.5 mmol/L的异丙基硫代-β-D-半乳糖苷(isopropylthio-β-D-galactoside,IPTG)进行诱导表达,诱导条件为:20℃,180 r/min,过夜。在4℃条件下4 000 r/min离心20 min收集菌体,并用50 mL 20 mmol/L Tris-HCl(pH 8.0)将其充分重悬;细胞重悬液使用高压破碎仪(JN-3000 plus,JINBO)进行细胞破碎(120~130 MPa);随后,4 ℃、10 000 r/min离心30 min收集上清液。根据Qiagen镍柱使用说明进行蛋白质的纯化:将上清液与Ni2+-NTA柱子置于冰上孵育1 h,使其充分结合;随后使用冲洗缓冲液(20 mmol/L Tris-HCl、5 mmol/L咪唑、300 mmol/L NaCl,pH 8.0)对柱子进行冲洗;最后使用洗脱缓冲液(20 mmol/L Tris-HCl、250 mmol/L咪唑、300 mmol/L NaCl,pH 8.0)对蛋白质进行洗脱并收集。向蛋白质溶液中加入SUMO蛋白酶(体积比100︰1)并在4℃条件下过夜透析于20 mmol/L Tris-HCl(pH 8.0)中,以去除NaCl以及咪唑。透析后的蛋白质溶液再次与镍柱结合,收集得到嵌合蛛丝蛋白。
1.4 嵌合蛛丝蛋白的检测
使用紫外分光光度计测量280 nm处的吸光度,以确定嵌合蛛丝蛋白的浓度和产率;使用15%的SDS-PAGE检测蛋白质的表达纯化情况,并通过考马斯亮蓝R-250染色后采用Image J进行分析,以确定蛋白质的纯度;通过Western-blot检测嵌合蛛丝蛋白有无标签污染:15%的SDSPAGE凝胶300 mA恒流转膜60 min后,先后使用6×His标签的特异性抗体及二抗孵育结合,随后进行ECL底物反应,暗室显色后压片扫描保存。
1.5 圆二色谱分析
嵌合蛛丝蛋白在4℃条件下过夜透析于10 mmol/L的磷酸缓冲液(pH 8.0)后,使用超滤离心管进行浓缩,并将浓缩产物溶于pH 7.0的10 mmol/L磷酸缓冲液中。将200 μL蛋白质溶液加入0.1 cm光程的200 μL石英比色皿中,使用Chirascan光谱仪(Applied Photophysics Ltd.,England)于25℃条件下记录260~190 nm的嵌合蛛丝蛋白FlagR-MaSp1R溶液的CD光谱。扫描步长为0.5 nm,响应时间为1 s,带宽为1 nm。CD光谱取3次扫描的平均值。测试蛋白质样品的终质量浓度为0.12 mg/mL。
1.6 手工拉丝
参照文献[11]报道的方法进行丝纤维的制备,主要操作如下:室温下将200 μL纯化后的蛋白质溶液(含20 mmol/L Tris-HCl,pH 8.0)以适当的质量浓度(0.8~1.0 mg/mL)置于载玻片上,使用小针头以约6 mm/s的速度连续将丝状纤维从溶液中拉出,并缠绕在特制的纸片上。制备好的样品可用于后续测试。
1.7 傅里叶变换红外光谱分析
使用Nicolet iN 10 MX傅里叶红外显微成像光谱仪(ThermoFisher Scientific,USA)测定嵌合蛛丝纤维位于600~4 000 cm-1范围内的红外光谱图。使用Peakfit v4.12软件对位于酰胺Ⅰ带(1 600~1 700 cm-1)的光谱进行处理,根据子峰面积计算蛋白质二级结构的百分比例。
1.8 扫描电子显微镜观察
使用扫描电子显微镜(Phenom XL,USA)观察嵌合蛛丝纤维的表面形态。选择5~15 kV电压和电子背散射衍射(electron backscattering diffraction,EBSD)模式进行观察并拍照。
2 结果与分析
2.1 重组质粒pEHS-FlagR-MaSp1R的构建
为构建表达嵌合蛛丝蛋白的重组质粒,首先PCR扩增获取FlagR片段,DNA电泳结果见图1A,目标条带与预期大小(728 bp)相符,说明成功扩增获得FlagR片段。随后将FlagR片段与pEHS载体进行酶切、连接及转化,得到过渡质粒pEHS-FlagR,再对过渡质粒及合成质粒(含MaSp1R)进行酶切、连接及转化,得到重组质粒pEHS-FlagR-MaSp1R。重组质粒的NdeⅠ及XhoⅠ双酶切鉴定结果如图1B所示。此外,我们将双酶切鉴定阳性结果送往上海生工生物工程股份有限公司测序,测序结果证实重组质粒pEHS-FlagR-MaSp1R构建成功。
2.2 嵌合蛛丝蛋白的表达与纯化
嵌合蛛丝蛋白所涉及到的不同重复模块的氨基酸序列见图2A,Flag和MaSp1的重复模块均来源于大腹园蛛,模块的组合方式见图2B。蛛丝蛋白在大肠杆菌中表达时常以包涵体形式存在,为增加嵌合蛛丝蛋白的可溶性及方便后续纯化,在两种重复模块序列的N端添加6×His-SUMO标签。纯化后使用SUMO蛋白酶将标签切除。

图1 FlagR片段的PCR扩增及重组质粒的酶切鉴定结果(A)FlagR片段PCR扩增产物的琼脂糖凝胶电泳图。M:DNA分子量标准,泳道1:阴性对照(使用等体积的H2O作为PCR扩增模板),泳道2:FlagR片段的PCR扩增产物(箭头所示);(B)重组质粒pEHS-FlagR-MaSp1R的双酶切验证图谱。M:DNA分子量标准,泳道1:经NdeⅠ和XhoⅠ双酶切后的重组质粒(箭头所示)。Fig.1 PCR amplification of FlagRfragment and double digestion of the recombinant plasmid(A)PCR amplification product of FlagRDNA was separated on agarose gel electrophoresis.M:DNA marker,Lane 1:Negative control(equal volume of H2O was used as PCR amplification template),Lane 2:FlagRPCR amplification product(as indicated by the arrow);(B)Double digestion map of recombinant plasmid pEHS-FlagR-MaSp1R.M:DNA marker,Lane 1:Recombinant plasmid after double digestion with NdeⅠand XhoⅠ(as indicated by the arrow).
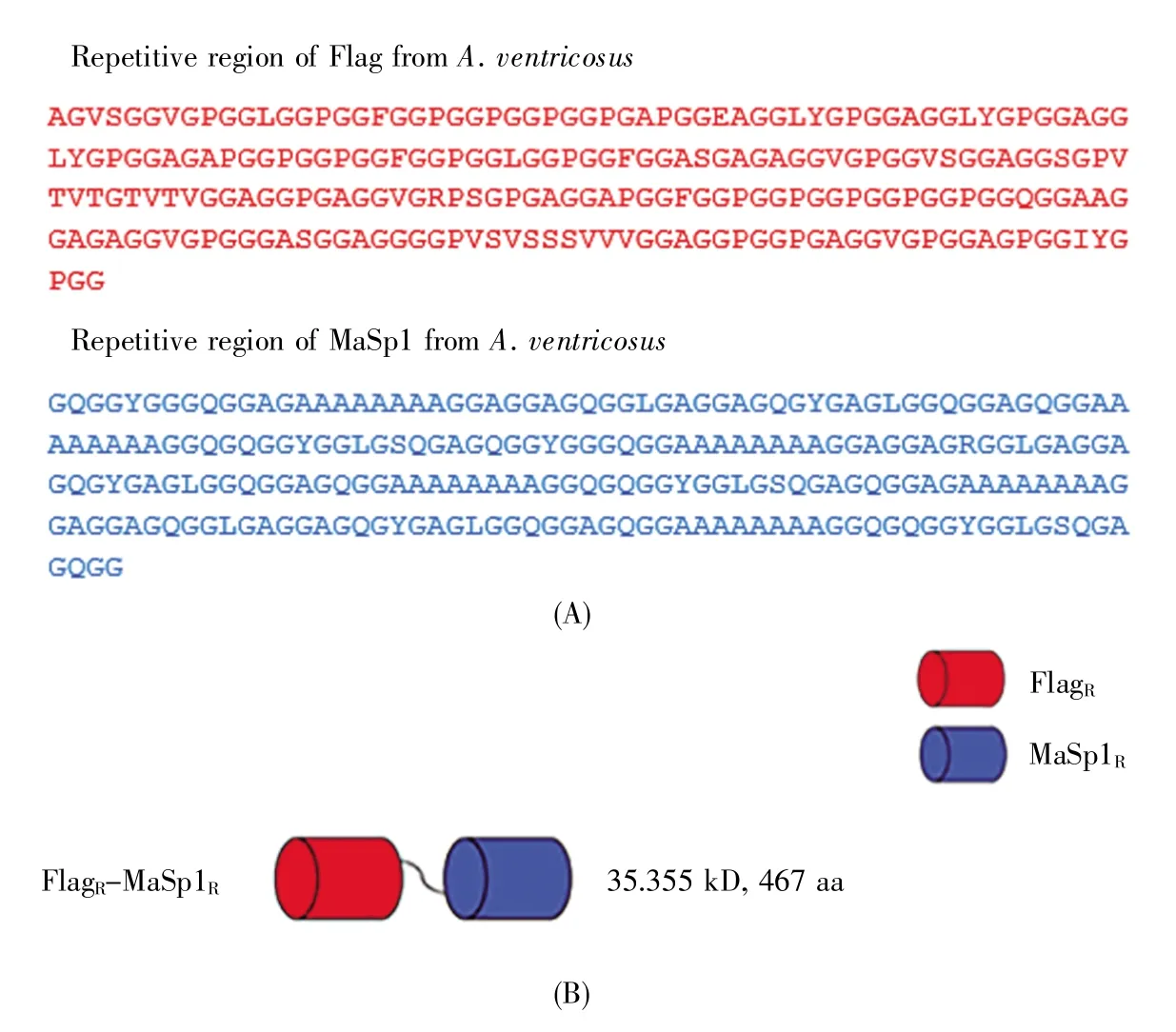
图2 嵌合蛛丝蛋白的氨基酸序列及示意图(A)嵌合蛛丝蛋白的氨基酸序列组成;(B)嵌合蛛丝蛋白的模块示意图。Fig.2 Amino acid sequence and schematic diagram of chimeric spidroin(A)Amino acid sequence of chimeric spidroin;(B)Schematic diagram of chimeric spidroin.
将重组质粒pEHS-FlagR-MaSp1R转化至表达菌株,并用IPTG诱导其表达重组蛋白质。重组蛋白质的诱导表达结果见图3A,与诱导前的菌裂解液(图3A泳道1)相比,诱导后的菌裂解液(图3A泳道2)在45 kD到66.2 kD之间有一显著增强的表达条带,且该条带大小与预期重组蛋白质的大小相符合。此外,从图3A的电泳结果可知,上清(图3A泳道4)中含有较多的重组蛋白质,而沉淀(图3A泳道3)中仅有少量重组蛋白质存在,说明重组蛋白质主要以可溶的形式存在于上清中。表达产物经镍柱亲和纯化后的SDS-PAGE检测结果如图3B泳道1所示,带有6×His-SUMO标签的重组蛋白质纯度较高。为减少标签对蛋白质结构及功能的影响,将镍柱亲和纯化后的产物进行SUMO蛋白酶消化,以去除6×His-SUMO标签。SUMO蛋白酶消化液的SDS-PAGE检测结果如图3B泳道2所示。对消化液再次进行镍柱亲和纯化,以去除外源标签及剩余的SUMO蛋白酶,收集的流穿液即为纯化后的嵌合蛛丝蛋白。去除标签后的嵌合蛛丝蛋白的相对分子质量与理论值35.355 kD相符,且纯度好(图3B泳道3)。将图3B泳道1~3的蛋白质样品进行Western-blot检测,结果如图3C所示,说明嵌合蛛丝蛋白无6×His-SUMO标签污染(图3C泳道3)。
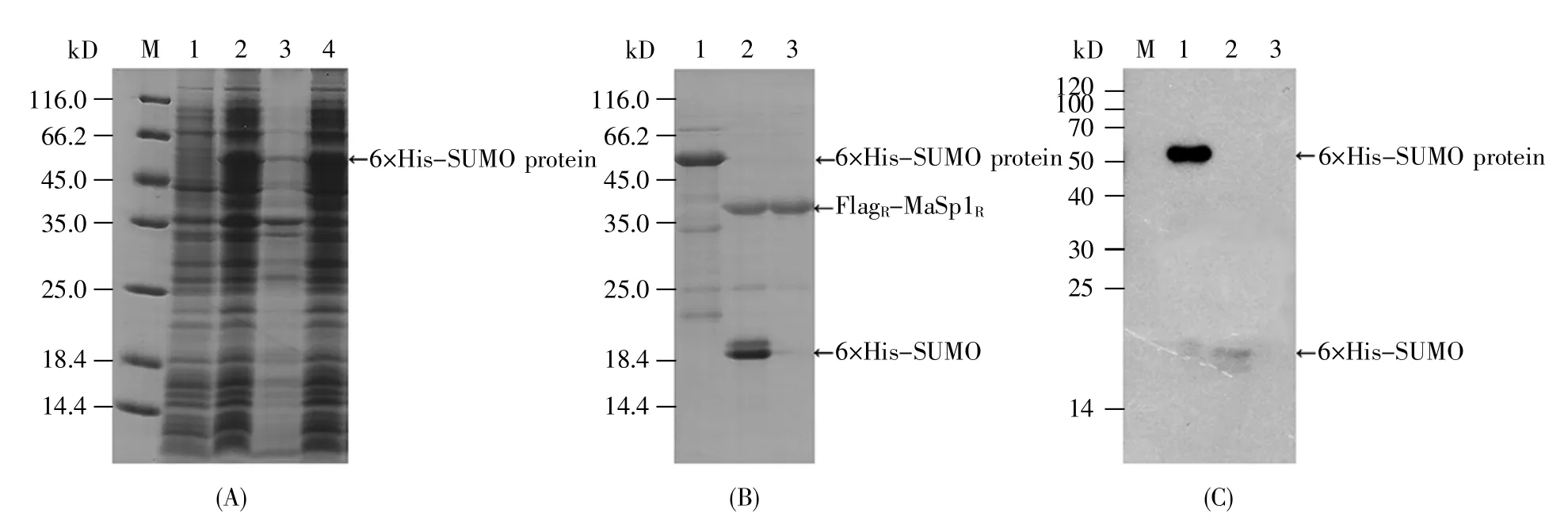
图3 嵌合蛛丝蛋白的SDS-PAGE及Western-blot分析结果(A)重组蛋白质(含有6×His-SUMO标签)诱导表达的SDS-PAGE结果。泳道1:诱导前,泳道2:诱导后,泳道3:沉淀,泳道4:上清;(B)嵌合蛛丝蛋白纯化后的SDS-PAGE结果。泳道1:重组蛋白质(含有6×His-SUMO标签),泳道2:SUMO蛋白酶消化液,泳道3:纯化后的嵌合蛛丝蛋白;(C)嵌合蛛丝蛋白纯化后的Western-blot分析结果。泳道1:重组蛋白质(含有6×His-SUMO标签),泳道2:SUMO蛋白酶消化液,泳道3:纯化后的嵌合蛛丝蛋白。泳道M均为蛋白质分子量标准。Fig.3 SDS-PAGE and Western-blot analysis of chimeric spidroin(A)SDS-PAGE results of induced expression of recombinant protein(containing 6×His-SUMO tag).Lane 1:Non-induced,Lane 2:Induced,Lane 3:Precipitation,Lane 4:Supernatant;(B)SDS-PAGE results of purified chimeric spidroin.Lane 1:Recombinant protein(containing 6×His-SUMO tag),Lane 2:SUMO protease digestion solution,Lane 3:Purified chimeric spidroin;(C)Western-blot analysis of purified chimeric spidroin.Lane 1:Recombinant protein(containing 6×His-SUMO tag),Lane 2:SUMO protease digestion solution,Lane 3:Purified chimeric spidroin.All the M lanes represent protein markers.
2.3 嵌合蛛丝蛋白的二级结构分析
为了解嵌合蛛丝蛋白溶液状态下的二级结构特征,我们测定了嵌合蛛丝蛋白在pH 7.0磷酸盐溶液条件下的CD光谱,结果见图4。从图中可以观察到,FlagR-MaSp1R蛋白在192 nm处呈现正吸收峰,在208 nm及222 nm处呈现负吸收峰,均为典型的α-螺旋特征吸收峰。为进一步确定溶液状态下各二级结构的百分含量,使用CDNN v2.1对CD光谱进行分析,结果见表2,α-螺旋占比为47.1%,表明在溶液状态下嵌合蛛丝蛋白以α-螺旋构象为主。
为了解手工拉丝获得的丝纤维的二级结构,我们对其进行了FTIR测定,FTIR位于酰胺Ⅰ带的光谱结果见图5。从图中可以观察到,β-折叠的区域峰集中在 1 610.1 cm-1、1 620.0 cm-1、1 628.8 cm-1、1 637.2 cm-1及1 694.3 cm-1附近;无规卷曲集中在1 644.6 cm-1附近;α-螺旋集中在1 653.3 cm-1附近;β-转角集中在 1 661.7 cm-1、1 670.1 cm-1、1 679.3 cm-1及1 687.3 cm-1附近。丝纤维二级结构的百分含量见表2。结合圆二色谱分析得到的二级结构百分含量结果可知,丝纤维中α-螺旋的百分含量明显下降,β-折叠与β-转角明显增多,表明在成丝过程中蛋白质的二级结构发生了由α-螺旋向β-折叠的转变。
2.4 嵌合蛛丝纤维的形态特征
为了解嵌合蛛丝纤维的形态特征,使用SEM对丝纤维的表面形态进行观察。图6的显微结果显示,1 000倍条件下,丝纤维十分纤细(图6A);放大丝纤维的局部至5 000倍时,可以清晰地看到丝纤维的轮廓(图6B);选取视野的中心位置继续放大至10 000倍,可以观察到丝纤维具有类似天然蛛丝纤维的形态,直径1~2 μm,接近天然蛛丝纤维的尺寸,且整体较为光滑均匀(图6C)。
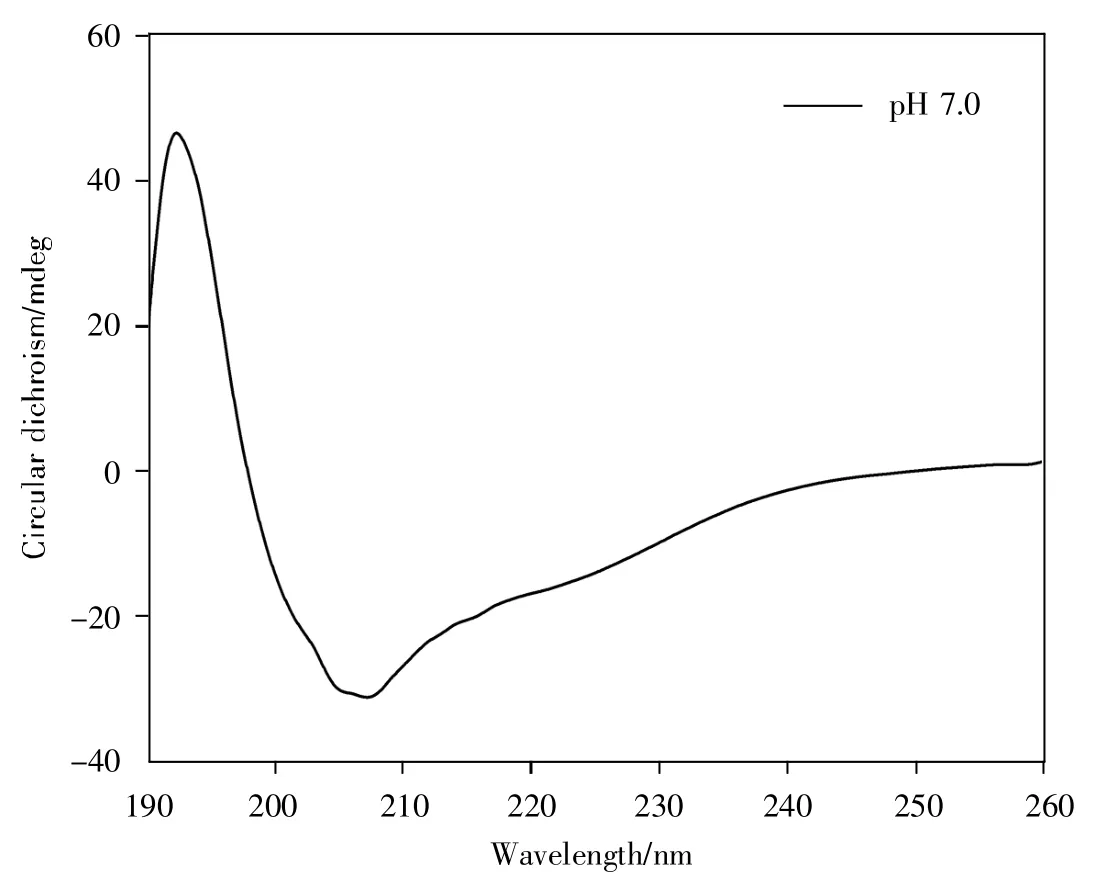
图4 嵌合蛛丝蛋白的圆二色谱分析Fig.4 CD analysis of chimeric spidroin
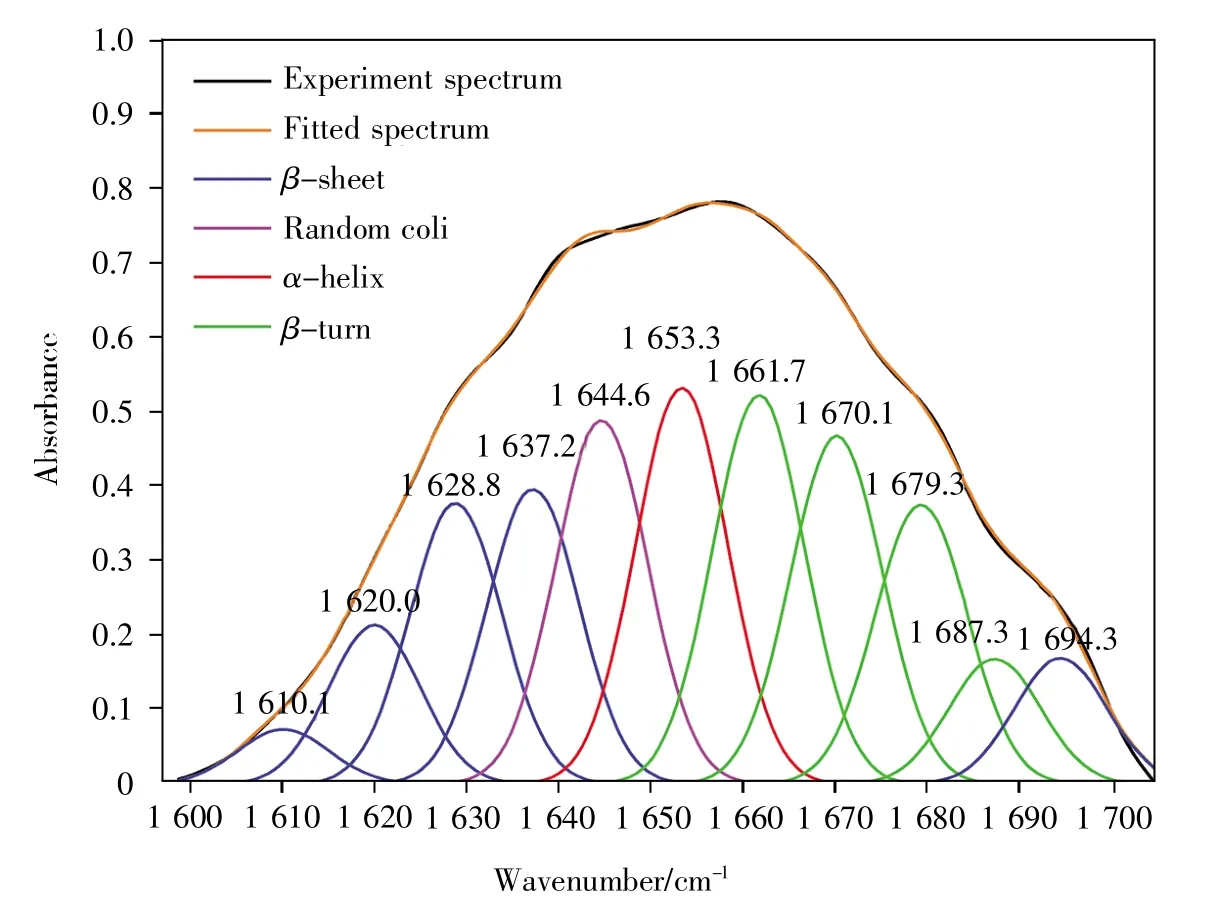
图5 嵌合蛛丝蛋白位于酰胺Ⅰ带的傅里叶变换红外光谱Fig.5 FTIR of chimeric spidroin in amideⅠband

表2 FlagR-MaSp1R成丝前后的二级结构百分含量Table 2 The contents of secondary structure before and after FlagR-MaSp1Rsilk formation
3 讨论
已有研究报道,蛛丝蛋白可以在一定条件下自组装形成丝状纤维。Xu等[17]研究发现葡萄状腺丝蛋白(aciniform spidroin 1,AcSp1)至少需要两个重复模块才可以自组装形成丝纤维。Zhou等[18]将来源于不同种蜘蛛的MaSp1的NT、次壶腹腺丝蛋白(minor ampullate spidroin,MiSp)的CT及 AcSp1的重复模块进行了组合,所得到的嵌合蛛丝蛋白可以自组装形成丝纤维。在本研究中,我们设计了同种蜘蛛不同类型丝蛋白重复模块相嵌合的嵌合蛛丝蛋白,并在大肠杆菌中获得高效表达(约50 mg/L)(图3B)。纯化后不含外源标签的蛋白质可于室温中性pH生理溶液中经手工拉丝获得丝状纤维,表明在不含有蛛丝蛋白的NT及CT的条件下,不同类型的丝蛋白也能够发生自组装现象。CD光谱分析表明,嵌合蛛丝蛋白溶液在室温及中性pH条件下的二级结构以α-螺旋为主(图4),这与已有报道提及的蛛丝蛋白溶液状态下的二级结构主要为α-螺旋构象[19]相吻合;FTIR酰胺Ⅰ带的蛋白质二级结构分析结果显示,手工拉丝获得的丝纤维以β-折叠与β-转角为主(图5),表明嵌合蛛丝蛋白的成丝过程具有与其他蛛丝蛋白[17~18]类似的二级结构变化,即蛋白质的二级结构由α-螺旋向β-折叠转变。现有研究显示,Flag中含有的特征模块Gly-Pro-Gly-Gly-X结构域成丝后进一步形成β-转角结构[10];MaSp1中含有的poly-Ala模块较长,且占比高,可产生大量的β-折叠,从而赋予丝纤维优越的强度[20];Flag及MaSp1中共有的Gly-Gly-X结构域形成的310-螺旋结构与Gly-Pro-Gly-Gln-X一同形成α-螺旋和β-转角的混合结构,并进一步形成β-spiral构象,构成无定型区域,共同赋予丝纤维良好的弹性[11,21]。本研究所获得的嵌合蛛丝纤维的二级结构中β-折叠占比高达约32%,β-转角占比高达约40%(表2),表明在嵌合蛛丝纤维中,不同类型的丝蛋白仍保持各自的结构特征,并很可能表现出优异的抗拉伸强度及延展性。同时,本研究手工制得的嵌合蛛丝纤维与相同方法获得的重组蛛丝纤维[18]直径相近,且表面形态整体光滑,相比湿法纺丝[22~23],更加绿色环保,直径也更接近天然(图6)。

图6 嵌合蛛丝纤维的扫描电子显微镜图Fig.6 SEM image of chimeric spider silk fibers
现有的研究绝大多数局限于同种蜘蛛相同类型蛋白质的重复模块的叠加[17,24],本研究将同种蜘蛛的不同类型丝蛋白的重复模块相嵌合,在不含蛛丝蛋白的NT及CT的情况下嵌合蛛丝蛋白仍可以自组装形成丝纤维,且丝纤维表面形态均匀光滑。在嵌合蛛丝蛋白成丝后的二级结构中β-折叠的百分含量较高,说明嵌合蛛丝纤维很可能具有出色的机械性能,本研究可为产生具有优越机械性能的嵌合蛛丝纤维提供研究方向和理论基础。未来研究人员可以通过增加嵌合蛛丝蛋白重复模块的数量及改变优化纺丝过程的各项参数来制备嵌合蛛丝纤维,并更好地应用在现代科技生活中,如生物医学、组织工程、航空航天以及军事等众多领域。
