雌激素对Min6细胞线粒体自噬的影响
2020-11-19李思怡白博文张媚王雨佳周鑫宇赵玉岩
李思怡,白博文,张媚,王雨佳,周鑫宇,赵玉岩
(中国医科大学附属第一医院内分泌与代谢病科,沈阳 110001)
糖尿病是一种并发症众多,病程长的慢性疾病。胰岛β细胞数量减少和功能受损从而导致胰岛素分泌减少是糖尿病患者血糖升高的重要原因,因此,雌激素能够降低糖尿病患病风险可能与其对胰岛β细胞的保护作用有关。雌激素可以防止胰岛β细胞凋亡,维持胰岛素分泌,延缓糖尿病发病[1]。流行病学调查发现,绝经后妇女的糖尿病发病率比绝经前妇女高。多个研究[2-3]证实,雌激素替代疗法可以显著降低绝经后妇女的糖尿病患病风险。线粒体自噬既可以维持线粒体结构与功能稳定,又可以减少线粒体数量从而影响细胞存活,关于线粒体自噬对胰岛β细胞影响的研究目前较为少见。本文通过研究雌激素对胰岛β细胞 (Min6细胞) 线粒体自噬的影响,探讨雌激素对胰岛β细胞的保护作用。
1 材料与方法
1.1 材料
1.1.1 细胞:实验用Min6细胞购自北京协和细胞库。
1.1.2 试剂:RPMI 1640培养基 (美国Gibco公司),胎牛血清 (美国Gibco公司),0.25%胰蛋白酶 (美国Gibco公司),雌二醇 (美国Sigma公司),二甲基亚砜(DMSO,美国Sigma公司),Beclin-1 Antibody (英国Abcam公司),LC3B Antibody (英国Abcam公司),HSP60 Antibody(英国Abcam公司),TOM20 Antibody (英国Abcam公司),GAPDH Antibody (英国Abcam公司),辣根酶标记山羊抗兔IgG (中国中杉金桥生物技术有限公司),BCA 蛋白定量试剂盒 (中国弗德生物科技有限公司),ECL化学发光试剂盒 (中国碧云天生物技术公司)。
1.1.3 仪器:细胞培养箱 (美国Thermo公司),超净工作台 (中国苏州净化设备有限公司),透射电子显微镜 (日本JEOL公司),全自动酶标仪/荧光酶标仪 (瑞士Tecan公司),电泳仪 (美国Bio-Rad公司),电转膜装置 (美国Bio-Rad公司),图像分析软件 (美国Scoin Corporration)。
1.2 方法
1.2.1 细胞培养与分组:Min6细胞培养于含有10%胎牛血清的RPMI 1640培养基中,使用25 cm2培养瓶并在37℃,5%CO2的细胞培养箱中培养。待细胞长至80%~90%生长密度时,用0.25%胰蛋白酶消化获得单细胞悬液,按1 ∶2~1 ∶3的比例传代。根据前期实验发现E2的最适作用浓度为10-7mol/L,最适作用时间为24 h,将同时段培养的处于对数生长期的细胞分为对照组 (培养基培养细胞24 h) 和E2组(10-7mol/L E2处理细胞24 h)。
1.2.2 透射电子显微镜观察:细胞按照分组处理后用胰蛋白酶消化成细胞悬液收集离心,弃上清,沿管壁缓慢滴入预冷过的2.5%戊二醛,4 ℃固定1 h,PBS洗涤2次。1%锇酸4 ℃固定1 h后PBS再次洗涤3次,进行电镜标本脱水、包埋、切片 (厚度70~90 nm),柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液分别染色15 min。透射电镜观察,收集图像。
1.2.3 Western blotting:细胞按照分组处理后弃培养基,PBS清洗2次,用刮板收集细胞;RIPA裂解液冰上提取蛋白,采用BCA试剂盒蛋白定量;将定量好的蛋白与样品用移液枪移至事先配置好的浓缩胶和分离胶中,开始电泳 (浓缩胶中电压70 V,分离胶中电压改为120 V);将蛋白通过转膜 (200 mA) 从分离胶中转至PVDF膜上,5%BSA溶液封闭1 h,TBST洗膜10 min×3次,一抗4 ℃孵育过夜;去除一抗,TBST洗膜10 min×3次,二抗摇床上孵育1 h,TBST洗膜10 min×3次,ECL发光,荧光成像仪曝光成像,Image J分析条带灰度值。
1.3 统计学分析
采用SPSS 22.0软件进行统计分析,计量资料用表示,组间比较采用t检验。P< 0.05为差异有统计学意义。
2 结果
2.1 E2减少Min6细胞中线粒体自噬体形成
电镜结果显示,与对照组相比,E2组中线粒体自噬体数量较少,见图1。

图1 E2减少Min6细胞中线粒体自噬体的形成 ×20 000Fig.1 E2 reduces the formation of mitochondrial autophagosomes in Min6 cells ×20 000
2.2 E2对Min6细胞线粒体自噬的影响
与对照组 (0.82±0.09,0.63±0.03) 相比,E2组HSP60 (1.32±0.07) 和TOM20 (0.83±0.01) 表达水平升高,差异有统计学意义 (P=0.001 8和P=0.000 4)。与对照组 (1.30±0.10,1.14±0.09,1.04±0.08) 相比,E2组Beclin-1 (0.99±0.13)、LC3Ⅱ (0.79±0.08) 和LC3Ⅱ/LC3Ⅰ (0.78±0.09) 的表达水平降低,差异有统计学意义 (P=0.033 3,P=0.009 6和P=0.023 4),见图2。
3 讨论
糖尿病是由遗传因素和环境因素共同作用引发的一种慢性疾病,随着社会发展与人们生活方式的变化,糖尿病的发病率在近几十年呈上升趋势。根据国际糖尿病联合会发布的数据,2017年全球糖尿病患病率已有8.4%,据估计,2045年糖尿病患病率将上升至9.9%[4]。与同龄男性相比,绝经后女性糖尿病的发病率更高,且并发症发生速度更快,可能与体内雌激素水平降低有关。雌激素是人体内一种已经被证明对胰岛功能具有保护作用的类固醇激素[5-6],现有研究[7-8]证实Min6细胞中存在雌激素经典受体ERα和新型受体GPER表达,但相关文献较少,团队的前期研究已经证实了GPER在Min6细胞中表达,提示雌激素可能通过与受体结合参与Min6细胞的生理过程。
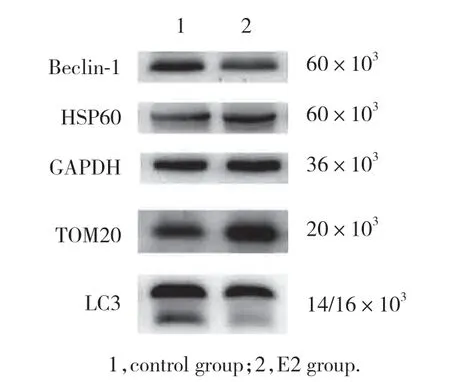
图2 Western blotting检测线粒体自噬相关蛋白的表达水平Fig.2 Expression levels of mitochondrial autophagy-related proteins measured using western blotting
自噬是细胞内发生的一种过多或异常蛋白质自我降解过程[9],而过度的自噬会引起胰岛β细胞的功能损害[10],进而增加糖尿病发生的风险。线粒体存在于真核细胞中,具有双模结构,是细胞的供能细胞器。其过氧化磷酸化生成的能量货币ATP通过参与多种代谢途径,为细胞正常活动提供大量能量,维持细胞内环境的稳态[11]。线粒体自噬有助于维持线粒体的健康和能量来源[12],而过度的自噬会损害线粒体功能并诱导细胞死亡[13]。目前关于雌激素对胰岛β细胞的保护机制尚不清楚,推测可能与雌激素对线粒体自噬的调控有关,为证实这一推测本研究检测了线粒体自噬体数量、线粒体相关蛋白和自噬相关蛋白。
线粒体相关蛋白表达量的变化可以反映线粒体总量的改变,从而进一步反映细胞线粒体自噬的发生。同时选取线粒体基质蛋白HSP60、线粒体膜蛋白TOM20进行检测,可以更全面地反映线粒体总量的变化。HSP60是由线粒体损伤引起的线粒体应激蛋白,主要定位于线粒体基质,在线粒体基质内的蛋白质折叠中发挥作用[14],是一种典型的线粒体分子伴侣。TOM20是一种线粒体外膜的转位酶,通过其N端疏水片段锚定于线粒体外膜上,其亲水域暴露于胞质侧[15]。在检测线粒体蛋白表达量时,同时选用线粒体基质蛋白HSP60和内膜蛋白TOM20来反映线粒体自噬活性更具有严谨性。Beclin-1通过调节PI3K生成和促进自噬体形成的ATG蛋白质来控制自噬过程[16],是自噬的关键调节因子。LC3与自噬体的发育和成熟相关,对自噬的发生至关重要,因此是公认的自噬活性评估标志蛋白,用于监测自噬活性[17]。自噬发生时,LC3从细胞质形式 (LC3Ⅰ) 转化为磷脂酰乙醇胺缀合形式 (LC3Ⅱ),并随后被募集至自噬体膜[18],因此可以用LC3Ⅱ/LC3Ⅰ来表示自噬的水平。本研究结果显示,在E2处理过的Min6细胞中Beclin-1和LC3Ⅱ/LC3Ⅰ减少,提示E2组自噬被抑制。同时E2组HSP60与TOM20蛋白相比对照组有所增加,说明E2组细胞内线粒体总量增多,线粒体自噬被抑制。电镜下E2组Min6细胞内线粒体自噬体数量比对照组有所减少也证实了这一结果。因此,本研究证实了雌激素对胰岛β细胞的线粒体自噬起抑制作用,其具体的作用机制与途径仍有待进一步研究。
综上所述,雌激素可能通过抑制线粒体自噬发挥对胰岛细胞的保护作用,从而降低糖尿病的发病风险。这一结论可以为绝经后妇女的糖尿病治疗与研究提供新的思路和理论依据。
