UBQLN-1和RUNX3在直肠癌组织中的表达和临床意义
2020-11-18孙光源郭圣超武雪亮薛军屈明郭飞韩磊韩洁
孙光源 郭圣超 武雪亮 薛军 屈明 郭飞 韩磊 韩洁
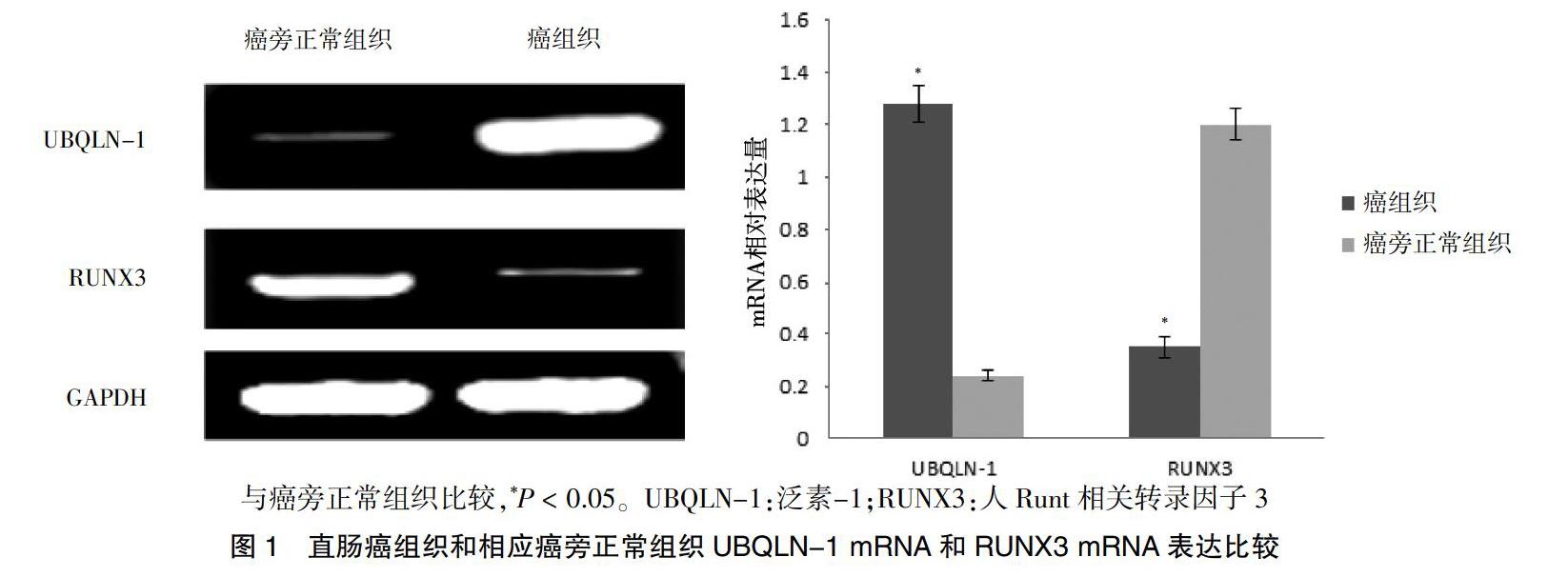
[摘要] 目的 探讨UBQLN-1(泛素-1)和人Runt相关转录因子3(RUNX3)在直肠癌组织中的表达和临床意义。方法 选取2017年6月—2019年6月河北北方学院附属第一医院行手术切除的85例直肠癌组织和相应癌旁正常组织,应用逆转录聚合酶链反应法(RT-PCR)和免疫组化法检测UBQLN-1及RUNX3 mRNA与蛋白水平,分析其与肿瘤临床病理特征间的关系及二者表达的相关性。 结果 直肠癌组织中UBQLN-1 mRNA表达水平高于癌旁正常组织,RUNX3 mRNA的表达水平低于癌旁正常组织,差异均有高度统计学(P < 0.01)。直肠癌组织中UBQLN-1阳性表达率高于癌旁正常组织,RUNX3阳性表达率低于癌旁正常组织,差异有高度统计学意义(P < 0.01)。直肠癌组织中UBQLN-1与RUNX3表达呈负相关(r = -0.225,P = 0.038)。 结论 UBQLN-1和RUNX3在直肠癌组织中的异常表达与其发生发展、演进密切相关,且二者呈明显负相关,可作为直肠癌诊断、治疗和预后评估的潜在分子生物学指标。
[关键词] 泛素-1;人Runt相关转录因子3;直肠癌;临床意义
[中圖分类号] R735.3+7 [文献标识码] A [文章编号] 1673-7210(2020)09(c)-0028-05
Expression of UBQLN-1 and RUNX3 in rectal cancer tissues and their clinical significance
SUN Guangyuan1 GUO Shengchao2 WU Xueliang1 XUE Jun1 QU Ming1 GUO Fei1 HAN Lei1 HAN Jie3
1.Department of General Surgery, the First Affiliated Hospital of Hebei North University, Hebei Province, Zhangjiakou 075061, China; 2.Graduate School, Hebei North University, Hebei Province, Zhangjiakou 075061, China; 3.Department of Ophtalmology, the Fourth Hospital of Zhangjiakou, Hebei Province, Zhangjiakou 075061, China
[Abstract] Objective To explore the expression of UBQLN-1 and RUNX3 in rectal cancer tissues and clinical significance. Methods From June 2017 to June 2019, 85 cases of rectal cancer tissues and adjacent normal tissues were selected from the First Affiliated Hospital of Hebei North University were selected. The mRNA and protein levels of UBQLN-1 and RUNX3 were detected by reverse transcription polymerase chain reaction (RT-PCR) and immunohistochemistry and the relationship between UBQLN-1, RUNX3 and the clinicopathological characteristics of tumors and the correlation between their expressions were analyzed. Results The expression of UBQLN-1 mRNA in rectal cancer tissues was higher than that in adjacent normal tissues; and the expression of RUNX3 mRNA in rectal cancer tissues was lower than that in adjacent normal tissues,and the differences were highly statistically significant (P < 0.01). The positive expression rate of UBQLN-1 in rectal cancer tissues was higher than that in adjacent normal tissues and the positive expression rate of RUNX3 was lower than that of adjacent normal tissues, with highly statistically significant differences (P < 0.01). UBQLN-1 was negatively correlated with RUNX3 expression in rectal cancer tissues(r = -0.225, P = 0.038). Conclusion The abnormal expressions of UBQLN-1 and RUNX3 in the rectal cancer tissues are closely related to their development and evolution, and rectal cancer tissues and adjacent normal tissues are significantly negatively correlated, which can be used as potential molecular biological indicators for the diagnosis, treatment and prognosis assessment of rectal cancer.
[Key words] Ubiquitin-1; Human RUNt-related transcription factor 3; Rectal cancer; Clinical significance
2018年全球癌症流行病学数据库显示[1],全球结直肠癌新增病例180万例,占新发癌症病例总数的10.2%,居恶性肿瘤第三位,结直肠癌死亡病例达80万,占癌症死亡总数的9.2%,恶性肿瘤排名第二。2015年我国结直肠癌新发病例约为38.80万例,发病率位居第三位,死亡病例约为18.7万例,死亡率位居第五位,防控诊疗形势不容乐观[2]
泛素-1(UBQLN-1)属于泛素样蛋白一族,在调节蛋白质降解中起重要作用。UBQLN-1功能的失活可诱导人类多种神经退行性疾病的病理过程,如阿尔茨海默病和亨廷顿病等[3-5]。此外,最新研究显示[6],UBQLN-1与人类乳腺癌、胃癌、非小细胞癌等多种肿瘤的发生和进展有关,但UBQLN-1在結直肠癌中的表达及相应的作用机制尚未见报道。人Runt相关转录因子3(RUNX3)是目前研究较热的一种抑癌基因,本研究之前已证实RUNX3蛋白阳性表达在结直肠癌组织中明显低于正常组织[7],但联合UBQLN1和RUNX3与直肠肿瘤的相关性及其预后的研究尚未见报道。
本研究通过对直肠癌组织行逆转录聚合酶链反应(RT-PCR)法和免疫组化SP法检测,旨在探讨UBQLN-1和RUNX3在直肠癌中的表达情况及与相关临床病理特征之间的关系,为直肠癌的早期筛查诊断和预后监测提供潜在可靠的分子生物学指标。
1 资料与方法
1.1 一般资料
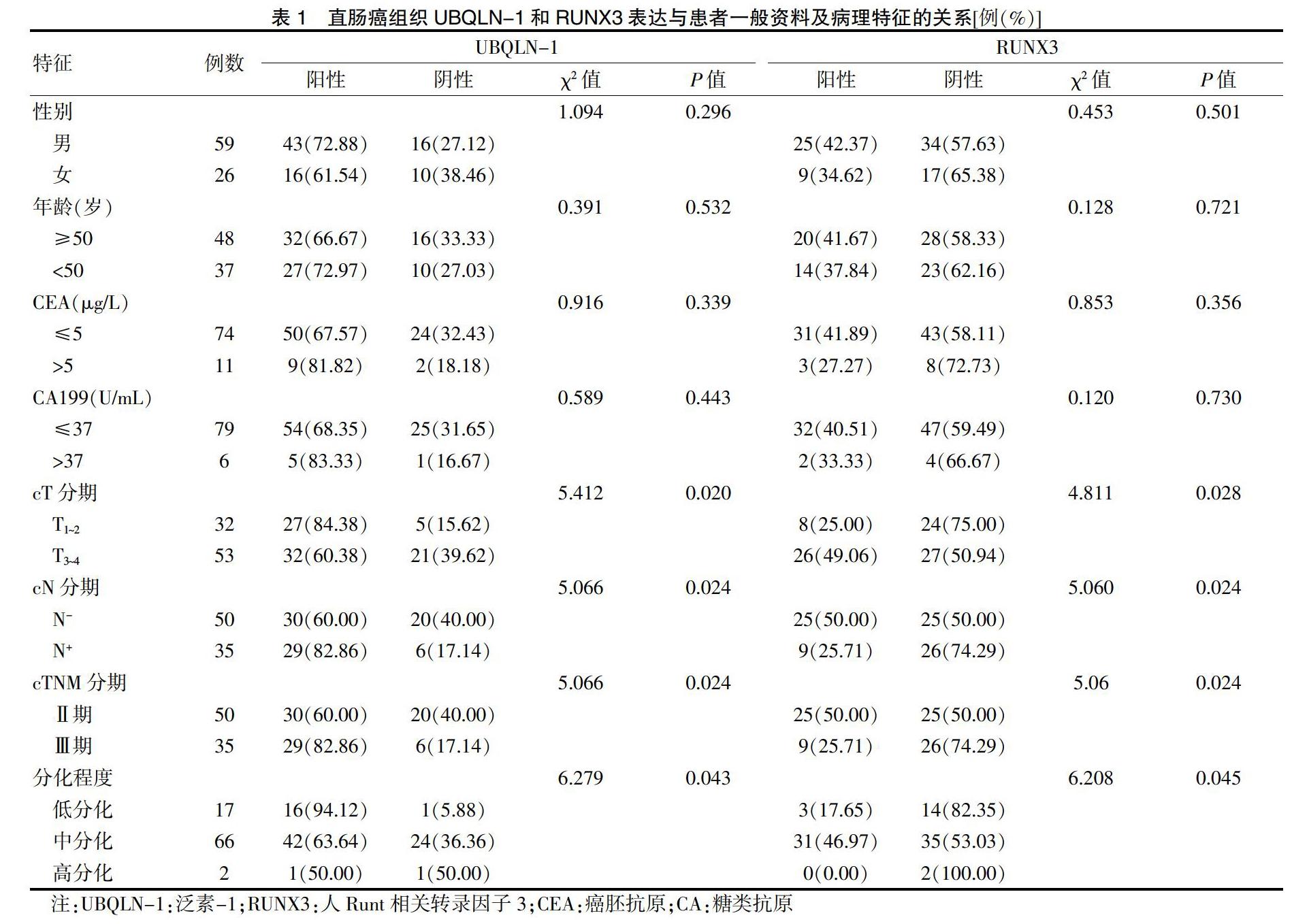
选取2017年6月—2019年6月河北北方学院附属第一医院(以下简称“我院”)行手术切除的85例直肠癌组织和相应癌旁正常组织。纳入标准:①相关检查诊断明确为直肠癌;②肝肾功能正常;③首次治疗。排除标准:①不配合治疗者;②临床资料不完整者;③合并其他系统恶性肿瘤及并发症者。其中男59例,女26例;年龄30~72岁,平均(51.2±7.7)岁;癌胚抗原(CEA)≤5 μg/L 74例,CEA>5 μg/L 11例;糖类抗原(CA)199≤37 U/mL 79例,CA199>37 U/mL 6例;cT分期T1~2、T3~4分别为32、53例;cN分期N-和N+分别为50、35例;临床病理分期[国际抗癌联盟UICC结直肠癌TNM分期系统(2018年第八版)[8]]cTNM分期:Ⅱ期50例,Ⅲ期35例;分化程度:低分化17例,中分化66例,高分化2例。本研究经我院医学伦理委员会批准,患者及家属知情同意。
1.2 方法
1.2.1 主要试剂 反转录试剂盒购于中国大连TaKaRa公司(货号:639505);引物购于中国广州鼎国生物科技有限公司;RIPA试剂购于上海基星生物科技有限公司(货号:PP1901);鼠抗UBQLN-1(货号:ab128011)、RUNX3(货号:ab224641)单克隆抗体购于美国Abcam公司;免疫组化试剂盒(货号:GK600705)、DAB显色剂(货号:GK347010)购于上海Gene Tech公司。
1.2.2 RT-PCR法检测直肠癌组织和癌旁正常组织UBQLN-1 mRNA和RUNX3 mRNA的表达 取直肠癌组织和相应癌旁正常组织100 mg,彻底匀浆后按Trizol一步法提取总RNA,测定RNA浓度;设计UBQLN-1上游引物:5′-GGAGACGGTCATCCCTGTAGAT-3′,下游引物:5′-GCTACACTGTACTGGGTCTTTTCCA-3′;RUNX3上游引物:5′-CTCTGCTCTGTCAGCTTCGG-3′,下游引物:5′-AGAATTTGGATTCCCGGTCCC-3′;GAPDH上游引物:5′-ACCACAGTCCATGCCATCAC-3′,下游引物:5′-TCCACCACCCTGTTGCTGTA-3′;反应体系:1×PCR Buffer 2.5 μL,cDNA模板2 μL,dNTP 0.5 μL,Taq酶1.25 μL,上、下游引物各1 μL,RNA酶抑制剂1 μL,加DEPC-H2O至总体积25 μL。根据试剂盒说明书操作进行扩增,产物经琼脂电泳后用Labworks 4.5图像系统分析。
1.2.3 免疫组化检测直肠癌组织和癌旁正常组织UBQLN-1和RUNX3蛋白的表达 分别取入组患者手术后的直肠癌组织和癌旁正常组织,4%甲醛溶液固定(固定液用量为组织的10倍),石蜡包埋、连续切片(厚度3 μm/张)。采用免疫组织化学染色SP法对直肠癌组织和癌旁正常组织中UBQLN-1和RUNX3的表达情况进行检测。将包埋好的石蜡依次进行切片、脱蜡和水化,磷酸盐缓冲液(PBS)冲洗3次,3 min/次,抗原修复自然冷却至室温,阻断内源性过氧化物酶,滴加一抗,37℃孵育60 min,PBS液冲洗3次,3 min/次,滴加二抗,室温孵育10 min,PBS液冲洗3次,3 min/次,滴加辣根酶标记链霉卵白素工作液,室温孵育10 min,PBS液冲洗3次,3 min/次,DAB显色,室温孵育10 min,复染,分化、返蓝,脱水、封片,40倍显微镜镜检并采图。
UBQLN-1蛋白阳性表达为棕黄色或棕褐色,主要位于细胞质中;RUNX3蛋白在结直肠癌中阳性表达为深棕褐色或棕黄色,主要位于细胞核中,而在正常组织中呈棕黄色颗粒,主要位于细胞浆中,且染色深度远小于细胞核。两者的染色评分标准参照文献[7]的标准:阳性细胞<10%为0分,10%~25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分;根据染色强度评分为:无染色0分,弱染色1分,中等染色2分,强染色3分;两项评分的乘积为最终的评分,总积分≤3分为阴性,>3分为阳性[9]。
1.3 统计学方法
采用SPSS 22.0统计学软件进行数据分析,计量资料用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料用百分率表示,组间比较采用χ2检验;相关性采用Pearson相关分析。以P < 0.05为差异有统计学意义。
2 结果
2.1 直肠癌组织和癌旁正常组织UBQLN-1 mRNA和RUNX3 mRNA表达比较
直肠癌组织中UBQLN-1 mRNA表达水平(1.28±0.07)高于癌旁正常组织(0.24±0.02),差异有高度统计学意义(t = 131.706,P = 0.000);直肠癌组织中RUNX3 mRNA的表达水平(0.35±0.04)低于癌旁正常组织(1.20±0.06),差异均有高度统计学(t = 108.674,P = 0.000)。见图1。
2.2 直肠癌组织和癌旁正常组织UBQLN-1和RUNX3蛋白表达比较
直肠癌组织中UBQLN-1阳性表达率为69.41%(59/85),高于癌旁正常组织的21.18%(18/85),差异有高度统计学意义(χ2=39.906,P = 0.000);直肠癌组中RUNX3阳性表达率为40.00%(34/85),低于癌旁正常组织的77.65%(66/85),差异有高度统计学意义(χ2=24.869,P = 0.000)。见图2(封三)。
2.3 直肠癌组织中UBQLN-1和RUNX3表达与患者一般资料及病理特征的关系
UBQLN-1和RUNX3与cT分期、cN分期和cTNM分期及分化程度密切相关(P < 0.05)。见表1。
2.4 直肠癌组织中UBQLN-1与RUNX3表达的相关性
直肠癌组织中UBQLN-1与RUNX3表达呈负相关(r = -0.225,P = 0.038)。
3 讨论
UBQLN-1属于泛素蛋白家族中的核小体表面蛋白,由11个外显子组成,位于人类染色体9q22,具有高度保守性,包含N端的UBL结构域,它介导泛素与蛋白酶体19S亚基的S5a组分的泛素受体以及C端的Uba相互作用。提示UBQLN-1通過连接泛素化机制和蛋白酶体调节蛋白酶体的降解[10-11]。UBQLN-1在不同的蛋白质降解机制和途径中发挥重要作用,包括泛素-蛋白酶体系统、自噬和内质网相关蛋白降解(ERAD)途径。通过与蛋白酶体的多泛素链结合以及与蛋白酶体的亚单位相互作用(通过泛素样结构域)介导蛋白酶体靶向错误折叠或积累的蛋白质进行降解[12-13];通过与内质网定位蛋白UBXN4、VCp和HERPUD1的相互作用,在ERAD途径中发挥作用,并可能在多泛素化的ERAD底物和蛋白酶体之间形成联系;UBQLN-1是自噬相关蛋白Lc3从胞液形式Lc3-Ⅰ成熟为膜结合型Lc3-Ⅱ所必需的,并可能通过介导自噬小体-溶酶体融合帮助自噬小体成熟为自溶酶体[14]。通过自噬途径降低TICAM 1的丰度,对TICAM 1/TRIF依赖的Toll样受体信号通路进行负性调节。
RUNX3基因定位于人类染色体1p36,全长约为67 kb,其表达产物RUNX3蛋白是一种包含415个氨基酸残基的异二聚体,该基因的沉默、失活导致癌症的发生[15-16]。研究证实[17-20],RUNX3主要通过调控转录生长因子β(TGF-β)和Wnt信号传导通路来抑制肿瘤细胞的生长。本团队前期已证实RUNX3在结直肠癌组织中的表达明显低于结直肠腺瘤和正常组织,因而RUNX3的失活在结直肠癌变的过程中发挥重要作用[21-25]。此外,Feng等[26]应用基因转染方法设置直肠癌HRC-9698细胞株的RUNX3过表达组,空白质粒组,阴性对照组和空白组,侵袭实验显示RUNX3基因在体外的过度表达能够抑制直肠癌细胞增殖,阻止细胞的侵袭和转移,从而为直肠癌的分子靶向治疗提供了新思路和新的治疗靶标。
本研究结果显示,UBQLN-1和RUNX3与cT分期、cN分期和cTNM分期及分化程度密切相关(P < 0.05),且UBQLN-1与RUNX3表达呈负相关(r = -0.225,P = 0.038)。目前,尚未有关于二者对术后患者预后方面的文献报道。
综上,相较于正常组织,直肠癌组织中UBQLN-1 mRNA与蛋白高表达,RUNX3 mRNA与蛋白低表达,随着癌组织分化程度变低、cTNM分期变晚,UBQLN-1的阳性表达率升高,而RUNX3的阳性表达率降低,在直肠癌的发生发展中,UBQLN-1的高表达或可调控RUNX3低表达。关于UBQLN-1和RUNX3在结直肠肿瘤领域中的研究目前相对较少,本研究结果显示UBQLN-1和RUNX3可作为直肠癌早期诊断、预后评估的潜在分子生物学指标,其具体作用机制及二者的相互关系尚需深入研究,这也是本课题今后的研究方向。
[参考文献]
[1] Bray F,Ferlay J,Soerjomataram I,et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]. CA Cancer J Clin,2018,68:394-424.
[2] 郑荣寿,孙可欣,张思维,等.2015年中国恶性肿瘤流行情况分析[J].中华肿瘤杂志,2019,41(1):19-28.
[3] Li X,Zhou J,Chen H,et al. The association between the UBQLN1 polymorphism and Alzheimer′s disease risk:A systematic review [J]. Cell Mol Biol,2017,63(5):94-96.
[4] Yue Z,Wang S,Yan W,et al. Association of UBQ-8i polymorphism with Alzheimer′s disease in Caucasians:a meta-analysis [J]. Int J Neurosci,2015,125(6):395-401.
[5] Luo L,Liu Y,Tu X,et al. Decreased expression of ubiquilin 1 following neonatal hypoxia ischemic brain injury in mice [J]. Mol Med Rep,2019,19(6):4597-4602.
[6] Kurlawala Z,Dunaway R,Shah PP,et al. Regulation of insulin-like growth factor receptors by Ubiquilin1 [J]. Biochem J,2017,474(24):4105-4118.
[7] 薛军,武雪亮,贾光辉,等.RUNX3蛋白在结直肠腺癌中的表达及临床意义[J].河北医药,2013,35(24):3708-3709.
[8] Weiser MR. AJCC 8th Edition:Colorectal Cancer [J]. Ann Surg Oncol,2018,25(6):1454-1455.
[9] Ben Brahim E,Ayari I,Jouini R,et al. Expression of epidermal growth factor receptor (EGFR) in colorectal cancer:An immunohistochemical study [J]. Arab J Gastroenterol,2018,19(3):121-124.
[10] Adegoke OO,Qiao F,Liu Y,et al. Overexpression of Ubiquilin-1 Alleviates Alzheimer′s Disease-Caused Cognitive and Motor Deficits and Reduces Amyloid-β Accumulation in Mice [J]. J Alzheimers Dis,2017,59(2):575-590.
[11] Fang X,Trexler C,Chen J,et al. Ushering in the cardiac role of Ubiquilin1 [J]. J Clin Invest,2018,128(12):5195-5197.
[12] Kim HT,Goldberg AL. UBL domain of Usp14 and other proteins stimulates proteasome activities and protein degradation in cellsl [J]. Proc Natl Acad Sci U S A,2018, 115(50):E11642-E11650.
[13] Liu Y,Qiao F,Wang H. Enhanced Proteostasis in Post-ischemic Stroke Mouse Brains by Ubiquilin-1 Promotes Functional Recovery [J]. Cell Mol Neurobiol,2017,37(7):1325-1329.
[14] Mizukami K,Abrahamson EE,Mi Z,et al. Immunohistochemical analysis of ubiquilin-1 in the human hippocampus:association with neurofibrillary tangle pathology [J]. Neuropathology,2014,34(1):11-18.
[15] Bangsow C,Rubins N,Glusman G,et al. The RUNX3 gene:sequence,structure and regulated expression [J]. Gene,2001,279(2):221-232.
[16] Coffman JA. Runx transcription factors and the developmental balance between cell proliferation and differentiation [J]. Cell Biol Int,2003,27(4):315-324.
[17] Lotem J,Levanon D,Negreanu V,et al. Runx3 at the interface of immunity,inflammation and cancer [J]. Biochim Biophys Acta,2015,1855(2):131-143.
[18] Choi SY,Park SK,Yoo HW,et al. Charged Amino Acid-rich Leucine Zipper-1(Crlz-1)as a Target of Wnt Signaling Pathway Controls Pre-B Cell Proliferation by Affecting Runx/CBFβ-targeted VpreB and λ5 Genes [J]. J Biol Chem,2016,291(29):15008-15019.
[19] 任約翰,蔡剑辉,陈积贤.抑癌基因Runx3在结直肠癌组织中的表达及意义[J].现代肿瘤医学,2018,26(1):72-76.
[20] 杨琼娇,许淑媛,黄晓明,等.RUNX3和Survivin在卵巢上皮性癌中的表达及其临床意义[J].临床和实验医学杂志,2011,10(2):87-89.
[21] 薛军,武雪亮,王立坤,等.结直肠腺癌、腺瘤、正常黏膜中RUNX3的表达及意义[J].临床与实验病理学杂志,2014,30(6):605-609.
[22] 薛军,武雪亮,屈明,等.结直肠癌组织RUNX3和MMP-2表达与MVD相关性研究[J].中华肿瘤防治杂志,2015, 22(24):1884-1888.
[23] 武雪亮,王立坤,薛军,等.结直肠腺癌中RUNX3表达与微淋巴管密度的关系及临床意义[J].安徽医科大学学报,2014,49(12):1825-1828.
[24] 薛军,武雪亮,王宇,等.联合检测runt相关转录因子3蛋白和基质金属蛋白酶-9表达在结直肠腺癌中的临床意义[J].中国医师进修杂志,2014,37(29):22-25.
[25] 薛军,武雪亮,王立坤,等.抑癌基因RUNX3表达与结直肠腺癌的关系[J].重庆医学,2014(22):2859-2861, 2864.
[26] Feng Y,Gao S,Gao Y,et al. Runx3 expression in rectal cancer cells and its effect on cell invasion and proliferation [J]. Oncol Lett,2019,18(3):3290-3294.
(收稿日期:2020-06-12)
