牛骨胶原蛋白肽制备工艺优化及抗氧化活性分析
2020-11-17魏洁琼余群力韩玲韩广星张新军曹晖罗小婵
魏洁琼,余群力,韩玲,韩广星,张新军,曹晖,罗小婵
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.山东绿润食品有限公司,山东 临沂 276000;3.宁夏夏华肉食品有限公司,宁夏 中卫 751700;4.陕西秦宝牧业股份有限公司,陕西 宝鸡 721000)
胶原蛋白是由动物细胞合成的一种生物性高分子[1],是维持正常组织构造和性能的必要成分[2],具有良好的生物化学和生物相容性[3].胶原蛋白肽是胶原蛋白在一定的外部条件下发生水解后得到的产物,与胶原蛋白相比食用后利用率较高,易被人体吸收.国内外许多研究表明,胶原蛋白肽可能有助于预防老年动脉粥样硬化[4],促进成骨细胞的生长[3],长期摄入可能改变消化道的外型或内型蛋白酶活性,从而有益身体健康[5].
随着我国肉牛养殖的集约化和肉类加工业的发展,肉牛屠宰加工副产物也随之增加,牛骨是其中主要的副产物之一,其含有丰富的蛋白质、矿物质、脂肪等营养成分,其中胶原蛋白为骨源蛋白质的主要成分[6].因此,从牛骨中提取胶原蛋白并进一步制备成胶原蛋白肽,是一个具有开发潜力的科技成果转化途径,且综合利用骨副产物不仅可以减少环境污染,还具有很高的经济和社会效益[7].
目前国内外已有不少关于胶原蛋白肽功能特性的研究报道:鸡胸骨胶原蛋白肽具有抗氧化、抗炎和抑制软骨细胞凋亡的作用[8];阿拉斯加鳕皮胶原蛋白肽对烧伤后小鼠的肠道紧密连接有保护作用[9];超滤法分离得到分子量小于3 ku的猪骨胶原多肽原溶液,其蛋白质浓度最低,但ACE抑制率最高[10].李娇娇[11]采用复合风味蛋白酶和木瓜蛋白酶优化鹅骨抗氧化肽的制备工艺并对其分离纯化,得到了小于5 ku的鹅骨抗氧化肽,该肽具有很高的超氧阴离子自由基清除能力.张康华等[12]采用双酶分步酶解制备的猪皮胶原蛋白肽在体内外均有不同程度的抗氧化能力,且分子量越小抗氧化活性越强.通过对前人研究的总结发现,目前关于牛骨胶原蛋白肽的提取及不同分子量肽组分抗氧化性的报道还相对较少.因此,本研究以牛骨为原料,筛选酶解效果最优的酶,对酶添加量、酶解时间、pH值、酶解温度进行单因素试验,并在此基础上优选试验因素,利用响应面设计试验得出牛胶原蛋白肽的最佳提取条件,并对不同分子量的肽组分的抗氧化活性进行研究,以期使现有的牛骨资源得到充分利用,变废为宝,为牛骨产品的深度开发提供理论基础和技术支持.
1 材料与方法
1.1 试验材料
1.1.1 材料与试剂 牛骨原料采购于宁夏夏华肉食品有限公司,随机选取发育正常、健康无病的牛腿骨,剔除筋肉等,切成块状于-80 ℃冷冻贮存.
2,2-联苯基-1-苦基肼基(2,2-Diphenyl-1-picrylhydrazyl,DPPH),上海麦克林生化科技有限公司;木瓜蛋白酶、中性蛋白酶、碱性蛋白酶、胰蛋白酶,日本Solarbio公司;其他试剂均为国产分析纯.
1.1.2 仪器与设备 LHS-150SC电热恒温干燥箱,上海一恒科技有限公司;FA1-204B型电子天平,上海佑科仪器仪表有限公司;pHS-3C酸度计,德国仪表有限公司;HH-2型电热恒温水浴锅,北京科伟永兴仪器有限公司;UV-2450紫外分光光度仪,上海光谱仪器有限公司.
1.2 试验方法
1.2.1 骨胶原蛋白肽制备的工艺流程 牛骨→脱脂→脱钙→酸溶酶法提取胶原蛋白→酶解→超滤分段→冻干→多肽.
1.2.2 酶的筛选 分别在同等酶添加量3%和同等酶活力10 000 U/g条件下对胶原溶液进行酶解,以多肽提取率为指标,选用中性蛋白酶、碱性蛋白酶、木瓜蛋白酶和胰蛋白酶在各自理论最适条件下进行酶解,通过对比优选效果最佳的酶.
称取牛骨胶原蛋白用磷酸盐缓冲液溶解配制成80 g/L的胶原溶液作为底物.按照试验设计调节恒温水浴锅至各自理论最适温度,加入酸或碱调节溶液pH值至各自理论最适pH值,加入酶进行酶解.酶解到达预定时间后,沸水浴灭酶5 min终止反应,迅速冷却至室温后,以4 000 r/min离心15 min,取上清液备用.
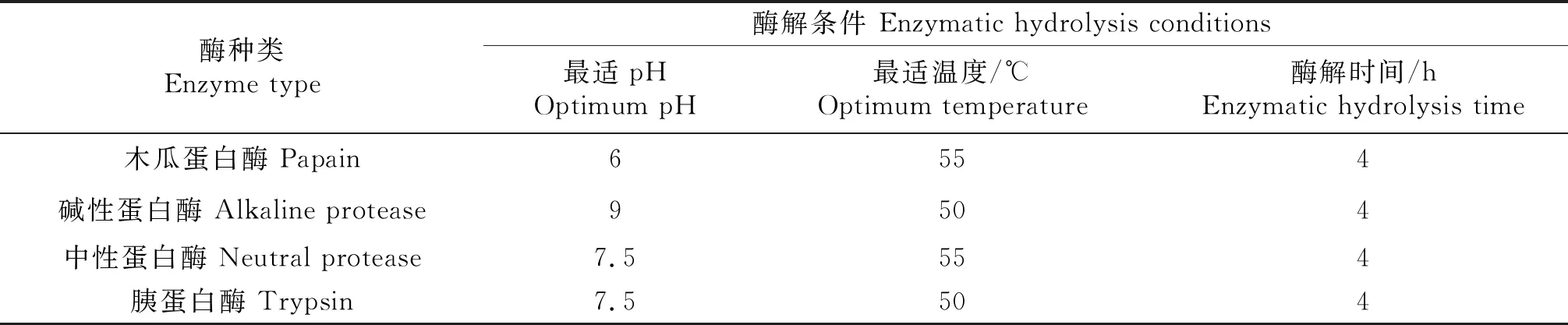
表1 各种酶的最适条件
1.2.3 酶解单因素试验 碱性蛋白酶在骨胶原蛋白质量浓度80 g/L、酶解温度50 ℃、pH 9.0、酶添加量3.0%、酶解时间4 h的条件下,设置酶添加量(2.0%、2.5%、3.0%、3.5%、4.0%、4.5%)、酶解时间(2、3、4、5、6、7 h)、pH值(7.5、8.0、8.5、9.0、9.5、10.0)、酶解温度(35、40、45、50、55、60 ℃)为因素,改变其中一个因素,保持其他因素不变,以多肽提取率为指标进行单因素试验.
1.2.4 响应面试验 根据单因素试验结果,选取酶添加量(A)、酶解时间(B)、pH值(C)、酶解温度(D)为影响因素,以多肽提取率为响应值进行4因素3水平的响应面分析试验.

表2 Box-Behnken试验因素与水平
1.2.5 多肽提取率的测定 参考程妍[13]的方法略作修改.

1.2.6 多肽分子量分段 使用装有截留分子量为10、3 ku超滤膜的Amicon-Ultra-15超滤离心管对骨胶原蛋白酶解液进行分离,离心机转速为6 500 r/min,离心时间40 min.分别收集3个组分:分子量大于10 ku的组分Ⅰ、分子量在3~10 ku范围内的组分Ⅱ以及分子量小于3 ku的组分Ⅲ,将所得的各个组分冷冻干燥.
1.2.7 抗氧化性测定
1.2.7.1 DPPH自由基清除能力的测定 参考刘倩霞等[14]方法并略作调整.以95%乙醇溶解DPPH,配制成0.2 mmol/L的DPPH溶液.将2 mL样品溶液与2 mL DPPH溶液于漩涡震荡仪混合均匀,室温避光反应30 min,于517 nm波长处测定吸光度.按下列公式计算:

式中:Ai为2 mL样品溶液+2 mL DPPH溶液的吸光度;Aj为2 mL样品溶液+2 mL 95%乙醇溶液的吸光度,Ao为2 mL DPPH溶液+2 mL 95%乙醇溶液的吸光度.
1.2.7.2 超氧阴离子自由基清除能力的测定 采用ALI、Li X C等[15-16]的方法,略有改动.取样品溶液0.2 mL与5.6 mL 0.05 mol/L Tris-Hcl缓冲液(pH 8.2)混匀后,再加入0.1 mL邻苯三酚溶液(用0.01 mol/L HCl配制成0.003 mol/L,25 ℃水浴预热)于漩涡振荡仪反应30 s后,在325 nm波长处测定30 s时的吸光度A1,300 s时的吸光度A2;蒸馏水取代样品溶液作空白组.用5.6 mL Tris-Hcl缓冲液、0.2 mL蒸馏水和0.2 mL 0.01 mol/L HCl的混合液调零.按下列公式计算:
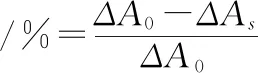
式中:ΔAs=A2-A1;ΔA0为空白组吸光度.
1.2.7.3 羟自由基清除能力的测定 参照李娇娇[11]方法,取9 mmol/L FeSO4和9 mmol/L的水杨酸-乙醇溶液各1 mL,在反应体系中加入1 mL样品溶液,加入l mL 8.8 mmol/L H2O2启动反应,37℃保温30 min.空白组加入1mL蒸馏水替换同体积的样品溶液.以蒸馏水为参比液,在510 nm下测定吸光值.按下列公式计算:

式中:Ao为空白对照液的吸光度;Ax为加入样品溶液后的吸光度;ΔAxo为酶解液的本底吸光度.
1.2.7.4 还原力的测定 参考Gu F L等[17]的方法.取1 mL样品,与2.5 mL磷酸盐缓冲溶液(0.2 mol/L,pH 6.6)、2.5 mL 1%铁氰化钾溶液混匀,50 ℃水浴20 min,迅速冷却后加入2.5 mL 10%三氯乙酸溶液,3 000 r/min离心10 min,取2.5 mL上清液,依次加入0.5 mL 0.1% FeCl3溶液、2.5 mL蒸馏水,室温下静置10 min,于700 nm波长处测定吸光度.样品的吸光值越大,说明其还原能力越强.
1.3 数据处理
上述测定至少重复3次试验,数据使用Microsoft Excel 2010软件整理,采用SPSS 21.0软件进行统计和方差分析.
2 结果与分析
2.1 酶的筛选
由图1可知,不同蛋白酶对骨胶原蛋白的酶解效果差异显著,这可能由于不同蛋白酶作用位点不同.经过方差显著性分析表明,在相同酶浓度和相同酶活力条件下,碱性蛋白酶的多肽提取率均较高.因此认为,碱性蛋白酶为骨胶原蛋白肽制备过程中酶解效果最优的酶.
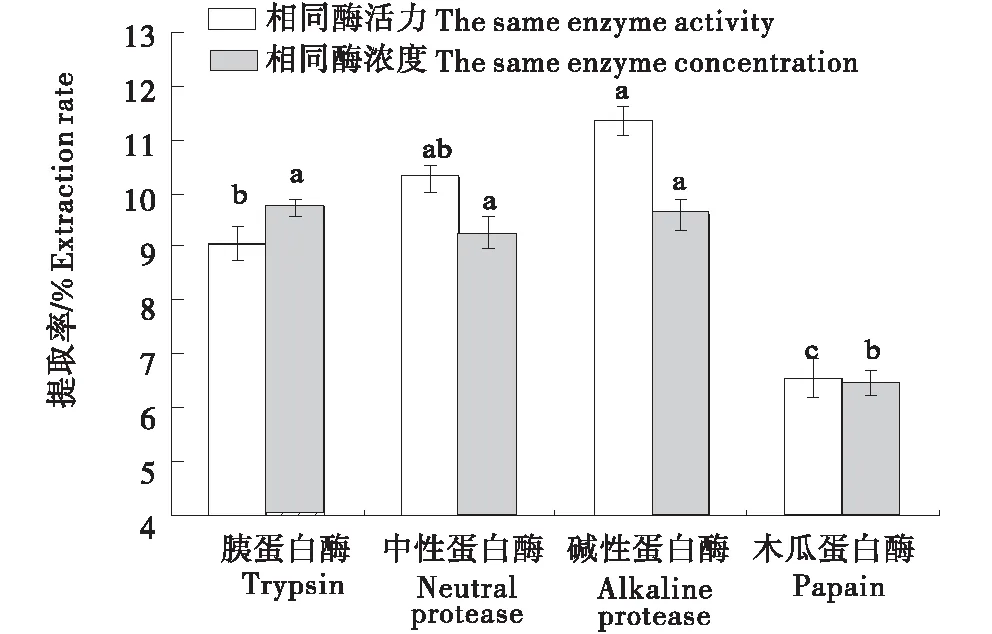
不同小写字母代表差异显著性(P<0.05).The different small letters show significant difference(P<0.05).图1 各蛋白酶酶解效果比较Figure 1 Enzymatic effects of different kinds of enzymes
2.2 单因素试验结果
由图2-A可见,碱性蛋白酶在酶添加量为3%时达到最大值15.11%,多肽提取率高于或低于3%均有下降.这可能是由于在底物浓度足够的条件下,适宜的酶和底物能够充分结合、反应完全,所以在一定的水解时间内,多肽提取率也随之增加.当酶添加超量时,超量部分酶无法与底物结合,且可能对反应产生抑制作用.
如图2-B所示,在酶解2~5 h内,多肽提取率随时间的延长而增加,6 h时多肽提取率最大,达到了6.88%,但与5 h 时多肽提取率6.68%相比差异不显著,并逐渐趋于稳定.为节省成本,酶解时间为5 h较为适宜.
由图2-C可知,当水解液pH值在7.5~9.0范围内,多肽提取率随pH的增大而增大(P<0.05),pH 9.0时达最大值7.86%;随着pH值的不断增大,多肽提取率开始下降.这可能是不适宜的环境导致酶的空间构造发生变化,使部分酶活性降低所致.
图2-D表明,当温度在30~45 ℃范围,多肽提取率随温度的上升而增大(P<0.05),在50 ℃时达最大值11.71%之后;随着温度的逐渐升高,多肽提取率开始下降.这可能是由于温度升高使酶发生了部分变性,从而抑制了反应的进行.

图2 单因素试验结果Figure 2 Results of single factor experiments
2.3 响应面试验结果
利用Design-Expert 8.0设计软件,采用Box-Behnken设计试验方案,对酶解工艺参数进行优化.结果见表3,由此获得二次回归方程:
多肽提取率/%=12.76+0.12A+0.100B+0.002C+0.15D-0.20AB-0.13AC+0.11AD-0.11BC+0.50BD+0.22CD-1.154A2-1.18B2-1.30C2-1.22D2

表3 碱性蛋白酶响应面试验设计及结果

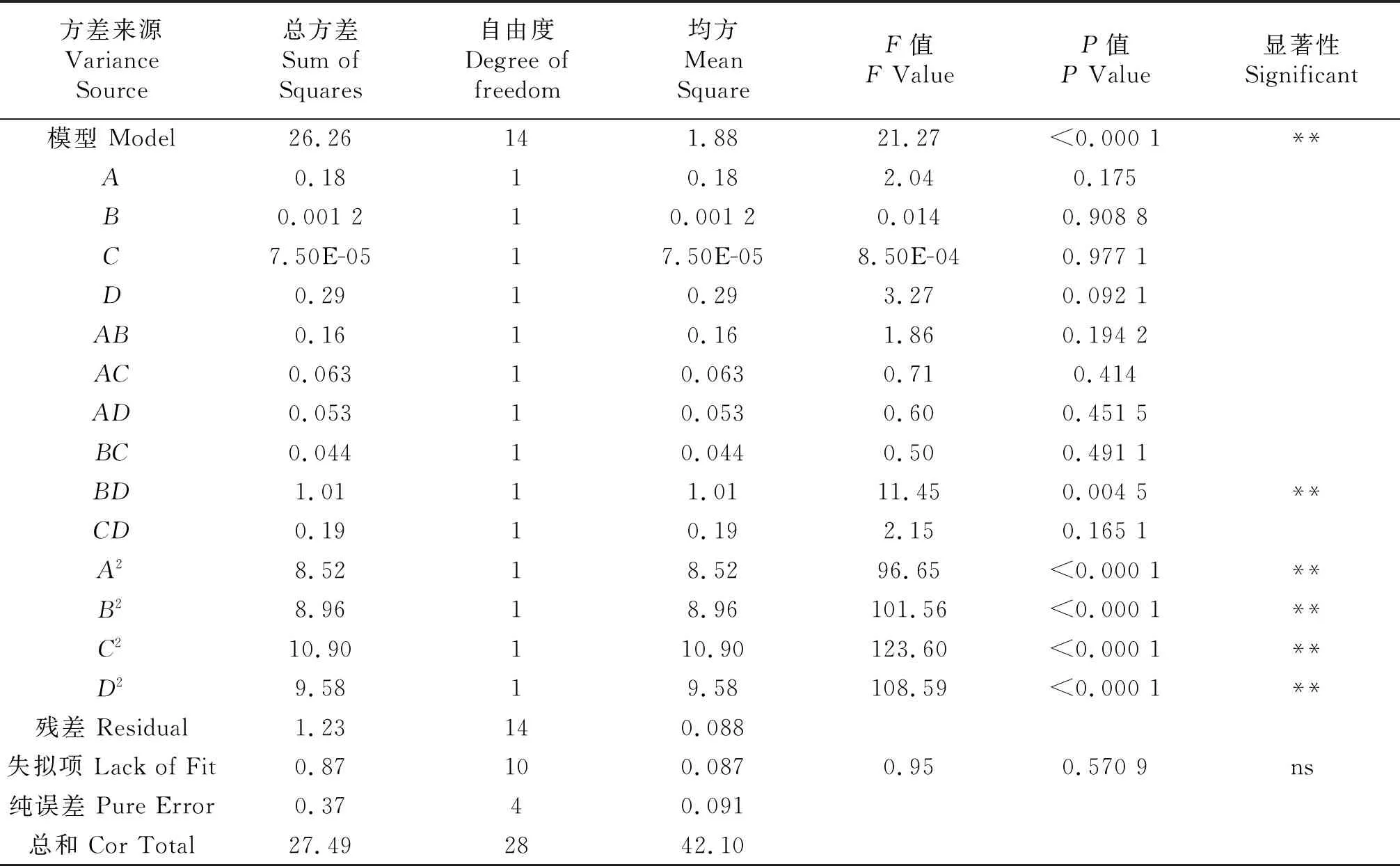
表4 碱性蛋白酶二次回归方程模型方差分析
综合单因素及响应面试验结果,得到碱性蛋白酶制备骨胶原蛋白肽的优化工艺参数为酶添加量3.03%、酶解时间5.01 h、pH值9.0、酶解温度50.35 ℃,预测多肽提取率为12.76%.为使实际应用过程中操作方便,将工艺参数修正为酶添加量3.0%、酶解时间5.0 h、pH值9.0、酶解温度50.4℃,在此条件下得到多肽提取率为12.45%,实际值与理论值基本相符,说明模型对碱性蛋白酶酶解骨胶原蛋白工艺参数优化可行,具有一定的实用价值.
2.4 抗氧化性
2.4.1 DPPH自由基清除能力 由图3可知,所有组分清除DPPH自由基的能力随着各自浓度的升高而增强.在浓度为5 mg/mL时,DPPH自由基抑制顺序为:组分Ⅲ>组分Ⅱ>组分Ⅰ>酶解液,清除率分别为(48.90±1.73)%,(44.99±1.47)%,(38.56±1.59)%和(25.52±1.19)%.结果表明,所有分级组分(Ⅰ、Ⅱ、Ⅲ)均比酶解液具有更高的清除率,且分子量越小DPPH自由基清除能力越好.
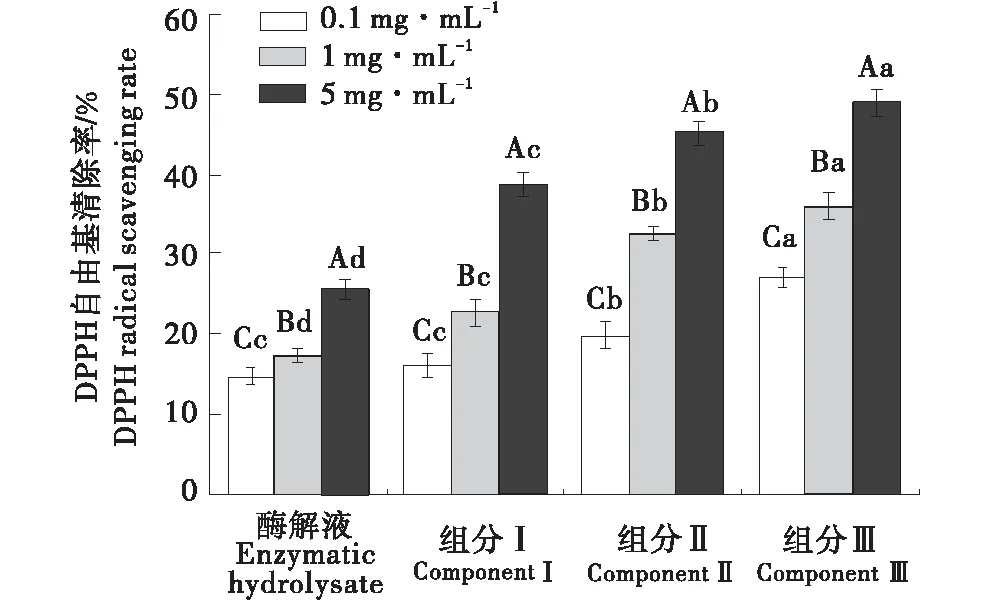
不同大写字母代表组内差异显著;不同小写字母代表组间差异显著(P<0.05).The different capital letter means difference in the same group(P<0.05);The different small letter means difference between groups(P<0.05).图3 不同分子量对DPPH自由基清除能力的影响Figure 3 Effects of DPPH radical scavenging activity of different molecular weights
DPPH是一种稳定的自由基,其醇溶液呈深紫色,当其遇到提供质子的底物(如抗氧化剂)时,自由基被清除并且吸收率降低[18],从而使溶液颜色从深紫色变为黄色,接受电子或氢原子成为稳定的抗磁性分子[19].试验结果表明,牛骨胶原蛋白肽具有较强的清除DPPH的能力.
2.4.2 超氧阴离子自由基清除能力 超氧阴离子是人体内产生的一种活性氧自由基,过多的超氧阴离子将会损伤细胞、破坏人类机体生理功能[20].由图5可见,超氧阴离子的清除能力随着浓度的升高而增大,与其他抗氧化指标相同,在组分Ⅲ(M<3 ku)时具有最好清除效果.结果表明,水解产物分级的超氧阴离子清除率值明显高于原始酶解液,组分Ⅲ具有比组分Ⅰ和组分Ⅱ更好的清除能力.当浓度为5 mg/mL时,组分Ⅲ的超氧阴离子清除率高达(51.13±1.63)%,其次是组分Ⅱ(45.94±1.53)%和组分Ⅰ(42.503±1.56)%.结果表明,牛骨多肽的抗氧化活性与其浓度和分子量均密切相关.

不同大写字母代表组内差异显著;不同小写字母代表组间差异显著(P<0.05).The different capital letter means difference in the same group(P<0.05);The different small letter means difference between groups(P<0.05).图4 不同分子量对超氧阴离子自由基清除能力的影响Figure 4 Effects of superoxide anion radical activity of different molecular weights
2.4.3 羟自由基清除能力 活性氧自由基是不稳定的,易与体内的其他基团或物质发生反应,导致细胞损伤,甚至导致疾病[21].因此,去除羟基自由基可能是一个生物体对各种疾病最有效的防御之一.由图5可知,牛骨多肽对羟自由基的清除能力呈浓度依赖性,随着浓度的增大,其清除能力呈上升趋势.试验结果显示,各组分对羟自由基影响顺序为:组分Ⅲ>组分>Ⅱ组分Ⅰ>酶解液,并且表明不同分子量牛骨多肽对羟自由基清除存在量效关系.多肽浓度为 5 mg/mL 时,各组分的清除率达到最高,分别为(87.31±1.76)%、(85.83±1.41)%、(82.51±0.93)%、(70.86±1.08)%.
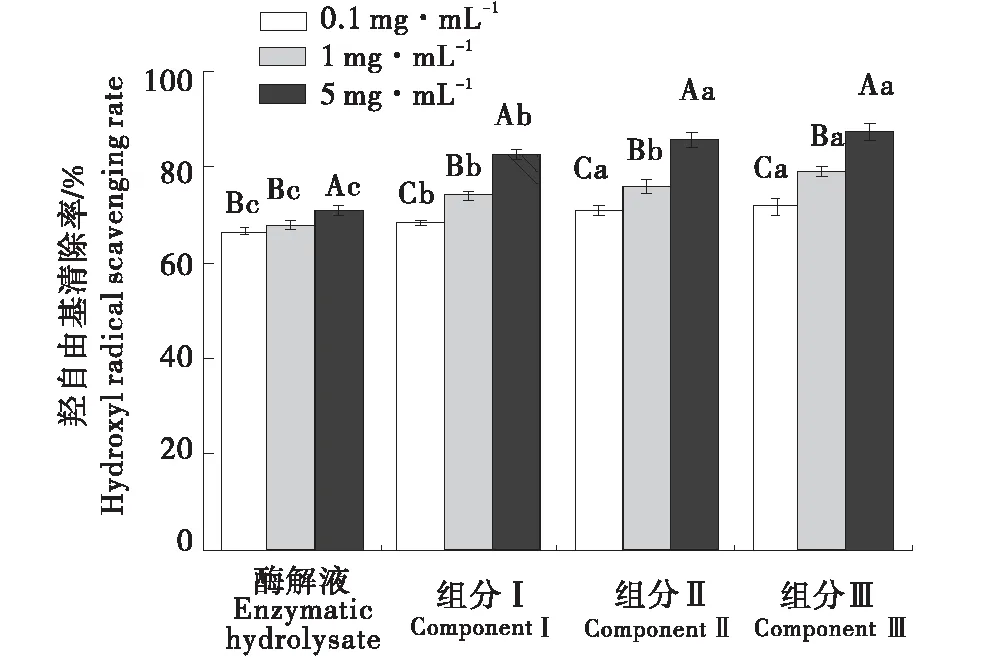
不同大写字母代表组内差异显著;不同小写字母代表组间差异显著(P<0.05).The different capital letter means difference in the same group(P<0.05);The different small letter means difference between groups(P<0.05).图5 不同分子量对羟自由基清除能力的影响Figure 5 Effects of Hydroxyl radical scavenging activity of different molecular weights
2.4.4 还原力 还原力测定通常用于评估天然抗氧化剂提供电子或氢的能力,与其抗氧化性呈正相关[22].由图6可知,多肽浓度越高,还原力越大,抗氧化能力越强.酶解液在0.1 mg/mL时吸光度为0.099,5.0 mg/mL时为0.112,增大了11.6%,组分Ⅲ在0.1 mg/mL时吸光度为0.119,5.0 mg/mL达到0.142,增大了16.2%.在相同多肽浓度下,组分Ⅲ的增加趋势显著优于酶解液.酶解后的产物能够提高还原力是由于其中存在的抗氧化肽能够将铁氰化钾中的Fe3+还原成Fe2+,并进一步生成普鲁士蓝,通过测定700 nm处的吸光度可间接反映出水解物的还原能力[23].
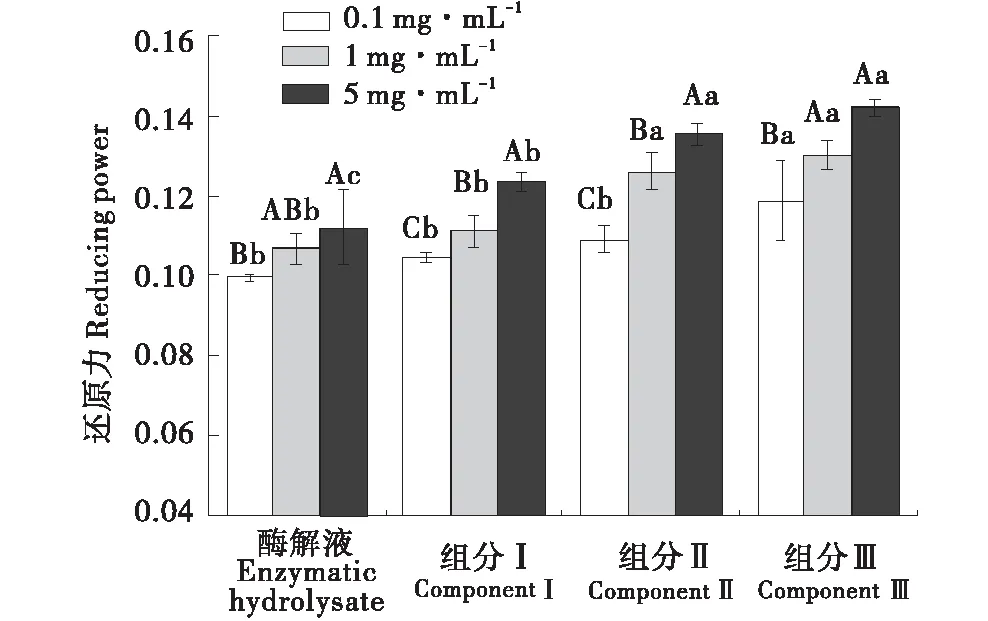
不同大写字母代表组内差异显著;不同小写字母代表组间差异显著(P<0.05).The different capital letter means difference in the same group(P<0.05);The different small letter means difference between groups(P<0.05).图6 不同分子量对还原力的影响Figure 6 Effects of Reducing power of different molecular weight
3 讨论
牛骨胶原蛋白肽制备过程受酶添加量、酶解时间、pH值、酶解温度等因素的影响,在一定的条件范围内,肽提取率会随影响因素的变化而变化.本研究中肽提取率随酶添加量的增加呈先增高后降低的趋势,这与朱瀛等[24]研究的木瓜蛋白酶水解鸡骨泥制备短肽中结果相似,可能原因是在底物浓度足够的条件下,适宜的酶和底物能够充分结合、反应完全,所以在一定时间内,肽提取率也随之增加;当酶添加超量时,超量部分酶无法与底物结合,且可能对反应产生抑制作用.试验中随着酶解时间的延长,肽提取率呈先升高后逐渐稳定的趋势,这可能由于在酶解初期,暴露的酶切位点较多,利于水解反应的进行,使得肽提取率升高,但随着酶解时间的延长,可供酶切的位点减少,不能有效地促进酶与底物的结合,导致水解反应放缓[14].试验中酶解温度的升高使得肽提取率先上升后下降,此结果与徐荣荣等[25]研究的超声波辅助酶法水解酪蛋白工艺优化结果相似,这可能由于酶解温度升高,酶作用位点释放,加速了底物蛋白和酶的反应,促进水解进程,使肽片段暴露;当温度继续升高使得酶的活性中心发生构象的改变,酶被破坏[26],肽提取率下降.试验中随着pH值的增大,肽提取率随之先增加后缓慢降低,这可能是不适宜的环境导致酶的空间结构发生改变,使部分酶活性降低.本试验在单因素试验基础上,采用Box-Behnken设计响应面试验得到最佳酶解条件为酶添加量3%、酶解时间5 h、pH 9.0、酶解温度50.4℃,该条件下进行酶解验证得到提取率为12.45%,结果较优化之前显著提高,说明碱性蛋白酶可有效酶解骨胶原蛋白,且该方法简单易操作,成本低廉,有利于骨资源的合理利用.
本试验通过对DPPH自由基、超氧阴离子自由基清除能力的测定,评价各组分肽的抗氧化活性,分析了不同分子量肽段的抗氧化活性.结果表明,不同分子量的肽段均对DPPH自由基、羟自由基、超氧阴离子自由基具有良好的清除能力,并有较强的还原能力.其中DPPH自由基和超氧阴离子自由基清除活性与徐兆刚等[27]研究的河蚌蛋白抗氧化肽相比较弱,这可能是因为原料和酶种类的不同造成所提取的物质浓度不同,从而影响其抗氧化活性;羟自由基和超氧阴离子自由基清除能力与张康华等[12]提取的猪皮胶原肽清除能力相当,但DPPH自由基清除率相对较弱,这可能由于双酶酶解得到的胶原肽分子量更小,具有更好的DPPH自由基清除活性.还原力与葛晓鸣[28]等研究的海马酶解多肽还原力一致,分子量愈小还原力愈大.由此可见,骨胶原蛋白多肽具有一定的抗氧化活性,目前提取的胶原蛋白肽是多种肽的混合物,今后需对其分离、纯化及活性进行深入研究.
4 结论
1) 优选得到具有最佳酶解效果的碱性蛋白酶,其酶解工艺条件为:酶添加量3%、酶解时间5 h、pH 9.0、酶解温度50.4 ℃,在此条件下胶原蛋白肽提取率为12.45%,结果较优化之前显著提高.
2) 超滤得到的3种不同分子量的肽组分均具有抗氧化活性,其中组分Ⅲ(M<3 ku)的抗氧化活性最强,组分Ⅱ(10 ku
3) 本研究既充分利用了牛骨中的蛋白质资源,也为肉牛屠宰加工副产物牛骨的精深加工提供了新思路和新方法.
